福建省漳州市2020届高三高考适应性测试化学
漳州市2020届高中毕业班第二次高考适应性测试
理科综合试题 化学部分
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。共16页300分,请考生把答案填写在答题纸上。
可能用到的相对原子质量:H1 C12 N14 O16 Al27 Fe56
第I卷(选择题:共126分)
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.中央电视台《国家宝藏》栏目不仅彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法不正确的是
A.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南中“杓”的材质为Fe3O4
B.宋《莲塘乳鸭图》缂丝中使用的蚕丝的主要成分是蛋白质
C.宋王希孟《千里江山图》中的绿色颜料铜绿,主要成分是碱式碳酸铜
D.清乾隆“瓷母”是指各种釉彩大瓶,其主要成分是二氧化硅
8.设NA代表阿伏伽德罗常数的值,下列说法正确的是
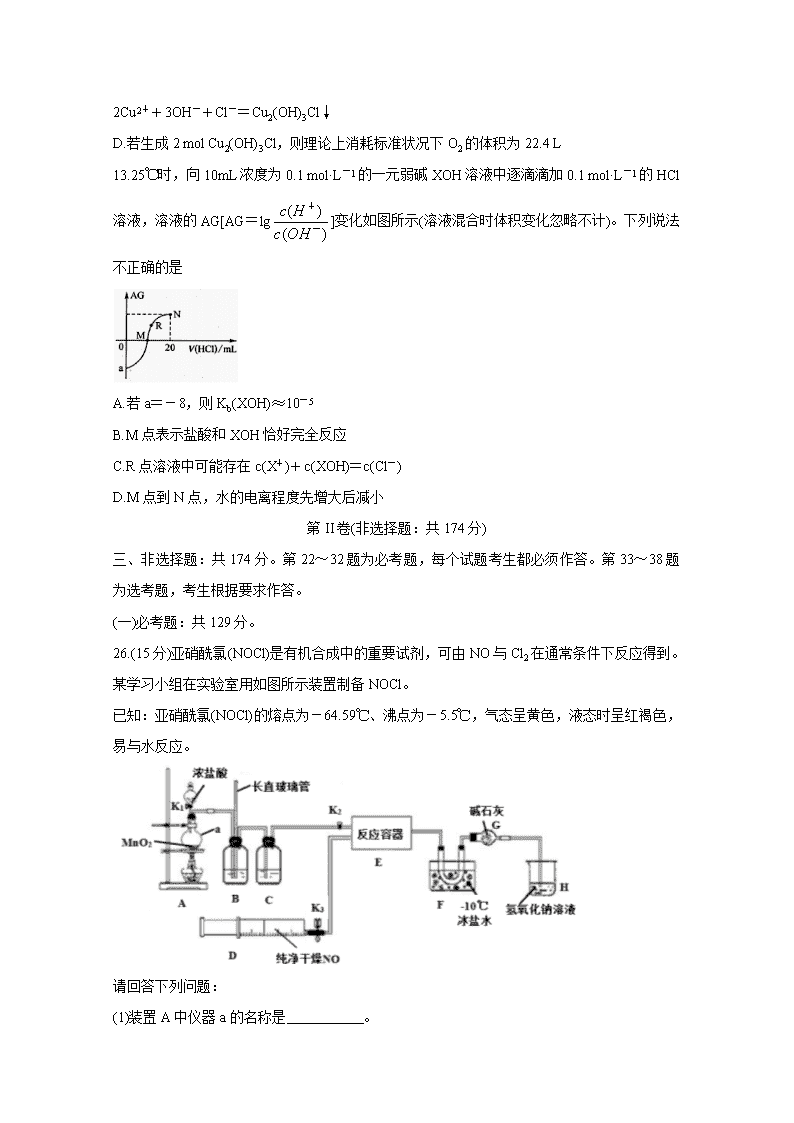
A.28 g的乙烯和环丙烷混合气体中所含原子总数为6NA
B.在标准状况下,9.2 g NO2含有的分子数为0.2NA
C.常温下,56 g铁与足量的浓硫酸反应,转移的电子数为3NA
D.公共场所用75%的乙醇杀菌消毒预防新冠病毒,1 mol乙醇分子中含有的共价键的数目为7NA
9.萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
A.a和b都属于芳香烃
B.a和c分子中所有碳原子均处于同一平面上.
C.在一定条件a、b和c均能与氢气发生加成反应
D.b和c均能与新制Cu(OH)2悬浊液反应生成砖红色沉淀
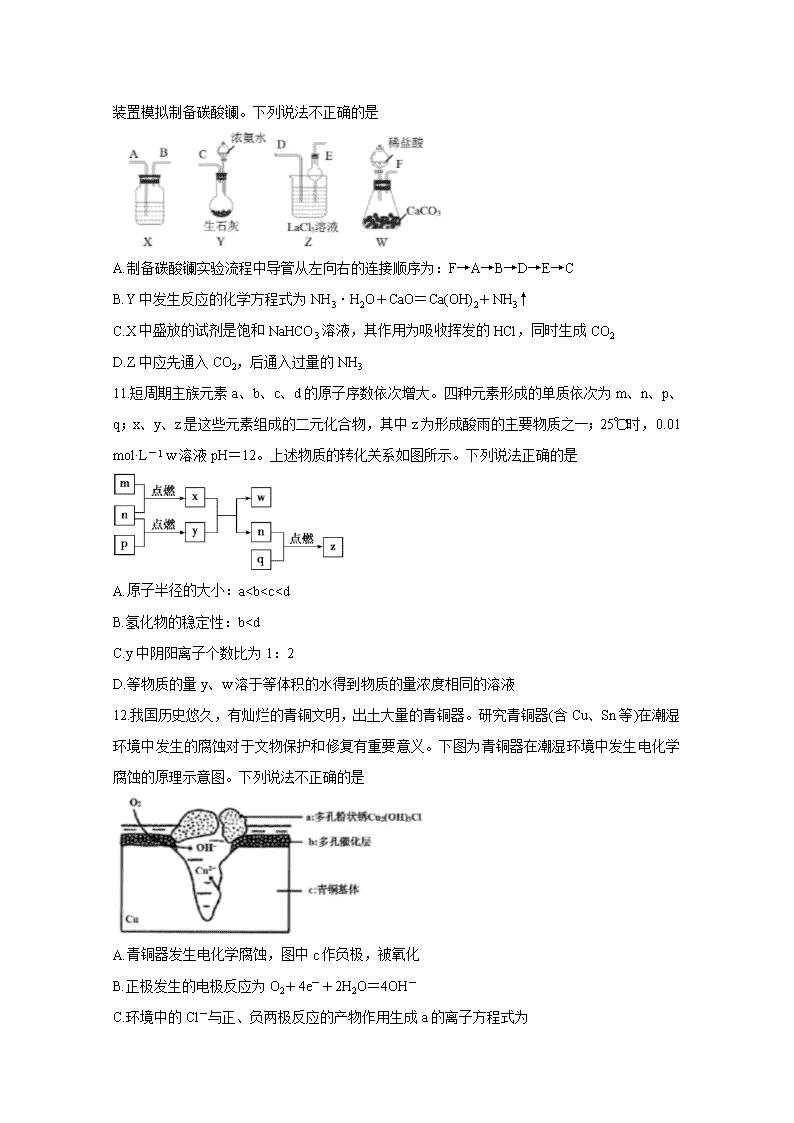
10.碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:
2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2
O。某化学兴趣小组利用下列实验装置模拟制备碳酸镧。下列说法不正确的是
A.制备碳酸镧实验流程中导管从左向右的连接顺序为:F→A→B→D→E→C
B.Y中发生反应的化学方程式为NH3·H2O+CaO=Ca(OH)2+NH3↑
C.X中盛放的试剂是饱和NaHCO3溶液,其作用为吸收挥发的HCl,同时生成CO2
D.Z中应先通入CO2,后通入过量的NH3
11.短周期主族元素a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01 mol·L-1 w溶液pH=12。上述物质的转化关系如图所示。下列说法正确的是
A.原子半径的大小:a
10-14)
②Ksp[Fe(OH)3]=2.16×10-39,Ksp[Ni(OH)2]=2×10-15
③Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH
ii.R-+·OH=OH-+·R
iii.H2O2+2·OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是 。
(2)“沉铁”时,若溶液中c(Ni2+)=0.01 mol·L-1,加入碳酸钠调溶液的pH为 (假设溶液体积不变,1g6≈0.8)使Fe3+恰好沉淀完全(离子的浓度≤1.0×10-5 mol·L-1),此时 (填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时pH=3的草酸溶液中= (保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是 。
(4)加入Fe2+和H2O2能够实现“脱络”的原因是 。
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为三氧化二镍。写出该反应的离子方程式: 。
28.(14分)CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-) c(Na+)(填“>”“<”或“=”)。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1;
键能E(O=O)=499.0 kJ·mol-1
①CO(g)+O2(g)CO2(g)+O(g)的△H= kJ·mol-1
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足:
c(CO)·c(O2)=c(CO2)·c(O),则此时反应 (填“向左”或“向右”)进行。
(3)己知:反应CO2(g)CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;
反应2CO2(g)2CO(g)+O2(g)中1 mol CO2在不同温度下的平衡分解量如下图2。
①分析图1,求2min内v(CO2)= 。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K= (计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
①由表1可知,该反应的最佳催化剂为 (填编号);
图2中a、b、c、d四点是该温度下CO的平衡转化率的是 。
②有利于提高CO转化为CH3OH的平衡转化率的措施有 。
A.使用催化剂CuO-ZnO-ZrO2 B.适当降低反应温度
C.增大CO和H2的初始投料比 D.恒容下,再充入a mol CO和3a mol H2
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.(15分)[化学——选修3:物质结构与性质]
氮化铝(AlN)陶瓷是一种新型无机非金属材料,最高可稳定到2473K,导热性好、热膨胀系数小,是良好的耐热冲击材料。制取原理为:Al2O3+3C+N22AlN+3CO回答下列问题:
(1)氮化铝的晶体类型为 。在上述化学方程式中第二周期元素的第一电离能由小到大的顺序是 。
(2)基态氧原子电子占据最高能级的原子轨道的形状是 ,未成对电子数为 。
(3)等电子体具有相似的结构。CO与N2互为等电子体,CO分子中σ键与π键数目,之比为 。
(4)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化 (填“是”或“否”)理由为 。
(5)AlN晶体结构如图所示,1个Al原子周围距离最近的Al原子数为 个;若晶胞结构的高为a nm,底边长为b nm,NA表示阿伏伽德罗常数的值,则其密度为
g·cm-3(列出计算式)。
36.(15分)[化学——选修5:有机化学基础]
高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下(A~I)均为有机物):
回答下列问题:
(1)反应①的化学方程式为 ;F的官能团名称为 。
(2)反应②的类型是 。D→E所需试剂、条件分别是 、 。
(3)G的结构简式为 。
(4)芳香族化合物W的化学式为C8H8O2,且满足下列条件的W的结构共有 种(不考虑立体异构)。
i.遇FeCl3溶液显紫色; ii.能发生银镜反应。
其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1的是 (写出结构简式)。
(5)设计以甲苯和乙醛为原料制备的合成路线。无机试剂任选,合成路线的表示方式为:AB…目标产物。