高中化学选修2《矿石资源 化石燃料》
点击高考
《“设计”一座硫酸厂》从硫酸的原料、合成、厂址的选择的角度来介绍相关知识,在这些方面联系着很多高考的热点: 硫及硫的化合物的性质、硫及硫的化合物相关实验、环境保护问题等等。我查阅了2001年以来的高考题,发觉本节知识在历年高考中占有重要的地位—平均每年都有10分左右题目在这里出现,并且更多的是以实验的形式出现。
通过仔细分析研究,我选出这几年高考中相关的几个代表性题目,供大家参考学习,以便大家明白学习本节的目标和重要性。
例1.(2001年)长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量a g样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到b g固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?其理由是:______________________。
(2)步骤③中加盐酸使溶液呈强酸性的目的是:__________________________。
(7)步骤⑦的“合格”标准是:______________________________________________。
(8)实验测得样品中无水亚硫酸钠的质量分数是:____________________________。
(列出算式,不需化简)
答案:(1)不能;在酸性溶液中,NO3-能将SO32-氧化成SO42-,造成结果错误(2)保证得到的沉淀都是BaSO4,没有BaSO3(3)连续两次称量的质量不变(4)
例2.(2003年)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
气体
a
b
c
d
C2H4
乙醇
浓H2SO4
NaOH溶液
浓H2SO4
Cl2
浓盐酸
MnO2
NaOH溶液
浓H2SO4
NH3
饱和NH4Cl溶液
消石灰
H2O
固体NaOH
NO
稀HNO3
铜屑
H2O
P2O5
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
答案:(1)NO2)①C2H4;装置中没有温度计,无法控制反应温度②Cl2;反应生成的Cl2被c中的NaOH溶液吸收了③NH3;反应生成的NH3被c中的H2O吸收了
例3.(2004年)强热硫酸亚铁固体可发生如下反应,2FeSO4 Fe2O3+SO2↑+SO3↑,若将此反应生成的气体通入BaCl2溶液中,则( )
A、析出BaSO3沉淀 B、析出BaSO4沉淀
C、逸出SO3气体 D、逸出SO2气体
答案:BD
例4:(2003年)对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是()
A Br- B SO42- C H2SO3 D NH4+
答案:B
对比中寻求解题策略
解题策略对于考生来说重要性不言自明,解题策略也就是考试战略,大到一次全面的考试具体方略,小到一个题目的解题技巧。每个小题的解题方法和技巧加和起来组成一次考试的策略,但是不同试题,需要不同的方法和技巧,不能一尘不变,要因题而异,在变化中寻求最适合这种题的策略。下面我选择两个有关硫及硫的化合物的高考试题,来谈一下解题策略。
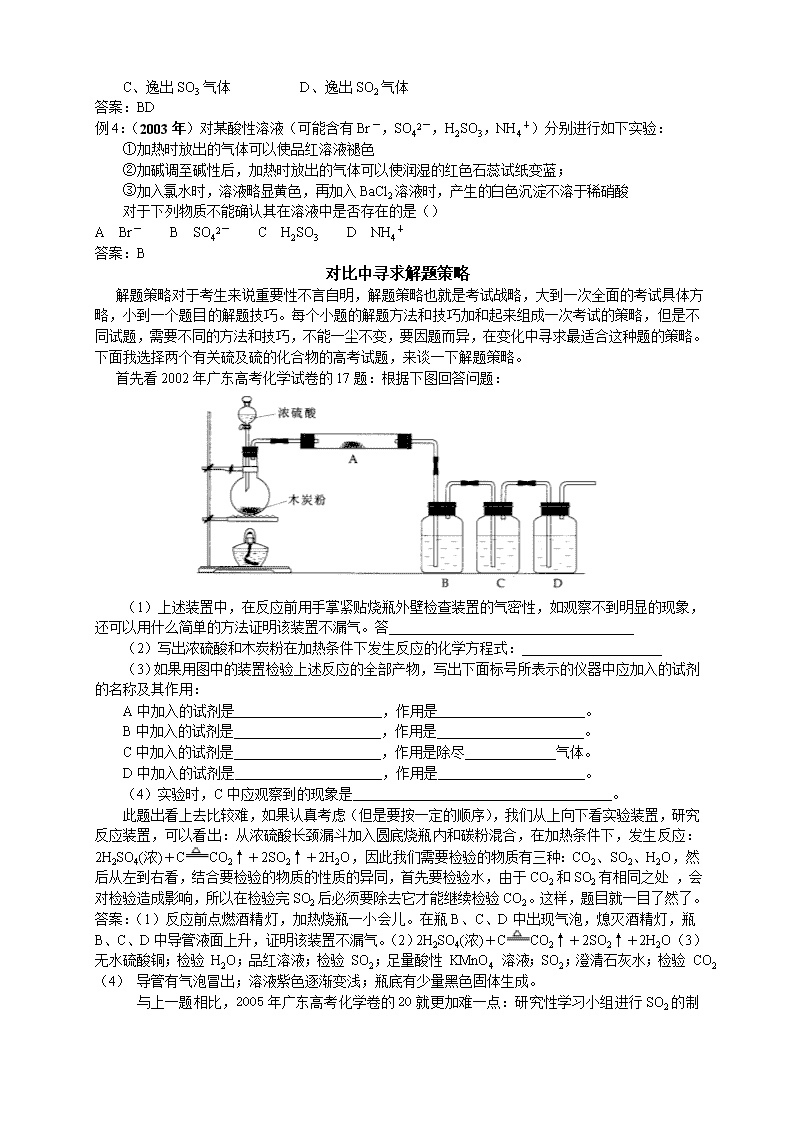
首先看2002年广东高考化学试卷的17题:根据下图回答问题:
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。答
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
C中加入的试剂是 ,作用是除尽 气体。
D中加入的试剂是 ,作用是 。
(4)实验时,C中应观察到的现象是 。
此题出看上去比较难,如果认真考虑(但是要按一定的顺序),我们从上向下看实验装置,研究反应装置,可以看出:从浓硫酸长颈漏斗加入圆底烧瓶内和碳粉混合,在加热条件下,发生反应:2H2SO4(浓)+CCO2↑+2SO2↑+2H2O,因此我们需要检验的物质有三种:CO2、SO2、H2O,然后从左到右看,结合要检验的物质的性质的异同,首先要检验水,由于CO2和SO2有相同之处 ,会对检验造成影响,所以在检验完SO2后必须要除去它才能继续检验CO2。这样,题目就一目了然了。
答案:(1)反应前点燃酒精灯,加热烧瓶一小会儿。在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气。(2)2H2SO4(浓)+CCO2↑+2SO2↑+2H2O(3)无水硫酸铜;检验 H2O;品红溶液;检验 SO2;足量酸性 KMnO4 溶液;SO2;澄清石灰水;检验 CO2(4) 导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成。
与上一题相比,2005年广东高考化学卷的20就更加难一点:研究性学习小组进行SO2
的制备及性质探究实验。(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
带孔橡胶塞 锥形瓶 集气瓶 分液漏斗 导管 液体 固体
②实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_______________________________________________________;
②溴水溶液,现象是_______________________________________________________;
③硫化钠溶液,现象是_____________________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因_____________________;验证方法__________________________。
②原因_____________________;验证方法__________________________。
③原因_____________________;验证方法__________________________。
此题不但要会看图还要会组装仪器,难度就加大了,但是万变不离其中,题目的内容总是和它要考擦的内容一致。根据反应原理,我组装仪器应该按照:反应装置→干燥或除杂质装置→检验装置→尾气吸收装置,在同一组装置内按照从上向下的原则组装。组装好后,再结合题目认真考虑,与上题对比找出共性。
答案:.(1) ①如右图配置②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。(2)①溶液褪色②溶液褪色③有浅黄色沉淀(或溶液变浑浊) (3)①NaSO3 变质;取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质②不是浓硫酸;用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
由此可以看出,只要是有关带有装置的实验题关键在于结合题目有关条件来研究装置,研究试验装置是有一定策略的,一般是按照:从上到下、从左到右的策略,这样就不会漏掉相关内容,当把题目装置看完后,组装仪器和题目解答都出来了!
金属冶炼解析及典型例题
广东 杨关敬
金属的冶炼方法和金属活动性有着很大的关系,金属的活泼程度不同,对应的冶炼方法也截然不同,根据不同金属的活动性,冶炼方法大致如下:
(1)K、Ca、Na、Mg、Al等活泼金属:一般采用的是电解熔融盐或氧化物的方法冶炼。
(2)Zn、Fe、Sn、Pb、Cu等金属,一般采用还原剂(如CO、H2、 C)等高温还原的方法冶炼,必要时再进一步精炼。
(3)Hg、Ag等较不活泼的金属,一般采用高温分解相应的化合物的方法冶炼。
但是人们根据生产条件的变化,同一种金属也可能采用多种冶炼方法,因此在试题的表达中,就会出现不同类型,现举例如下:
【例1】不能用热分解法制得的金属是( )
A.Fe B.Ag C.Mg D.Hg
【解析】热分解法一般用于很不活泼银、汞等金属的冶炼,它们的化合物大多不稳定,比如氯化银受热时能够分解为相应的单质金属,而活泼金属的化合物一般相当稳定,加热是很难分解。因此,比较活泼的铁和镁不能够通过热分解法制的。
答案:AC
【例2】将n mol木炭粉和1 mol氧化亚铁在反应器中混合,隔绝空气加强热.
(1)可能发生的化学反应有:
④_____________________
(2)若n <,充分反应后,反应器中的固体物质是____,气体产物是___________
(3)若n >4,充分反应后,反应器中的固体物质是____,气体产物是___
(4)若反应的气体产物是混合物。n的取值范围是:_________.
(5)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为_________.
【解析】 (1)由反应①、②、③可知,可能发生的反应④为
(2)、(3)、(4)和(5)问为多步反应的计算问题,凡多步反应的计算问题首先要
通过过程反应找出总反应.此题中①、③为过程反应,总反应为
然后通过总反应(有时要结合过程反应)来求解.
(2)由反应②
当n <时FeO过量,故充分反应后,反应器中的固体物质是FeO和Fe;气体产物是CO2.
(3)当n>4时,由②知碳过量,发生反应④:
②和④两反应共消耗碳 mol十 mol=1 mol <4 mol,在④反应中碳亦过量,故反应器中固体物质是C和Fe;气体产物是CO.
(4)若反应的气体产物是混合物,则对于②反应,C过量,即n>,对于④反应C不足量,即n<+=1,综合即得
7,溶液Y是黑色粘稠的煤焦油,上层X是粗苯等
C.气体Z中有些成分易燃,且可以还原氧化铜
D.液体Y是一种纯净物
解析思路:本题以一个模拟实验装置切题,对煤的干馏产物进行考查。将煤隔绝空气加强热使其分解,可得到多种物质,属于化学变化,A正确。所得的产物有焦炉气(含有甲烷、氢气、乙烯、一氧化碳等)、煤焦油(不溶于水的一种多成分混合物)、粗氨水(溶于水)、焦炭等,焦炉气中的氢气等可以还原氧化铜,且易燃,C正确。氨水的pH>7,煤焦油层居于水层以下,苯及二甲苯等居于水层以上,故B正确。由于煤焦油中含多种物质成分,属于混合物,D错误。
错因分析:在解析过程中,往往由于对煤的干馏没有一个理性认识,而认为煤的干馏只是一个简单的分离过程,而容易错选A。
答案:D
例2.已知将煤进行干馏,可以得到粗苯等物质,将苯与溴水混合,充分振荡后静置,用分液漏斗分出上层液体放置于一试管中,若向其中加入一种试剂,可发生反应并产生白雾.这种试剂是
A.浓H2SO4 B.HN03 C.锌粉 D.铁粉
解析思路:本题以煤的干馏为背景,对苯的性质进行考查。分液漏斗上层液体是苯和Br2的混合物。苯和纯Br2在铁粉作催化剂的条件下会发生取代反应,生成溴苯,同时还有HBr,HBr与空气中的水蒸气结合形成小液滴,所以形成白雾。
错因分析:在解析过程中往往因审题不细,只注意到“将苯与溴水混合”,忽视了“充分振荡后静置,用分液漏斗分出上层液体放置于一试管中”
,从而认定不发生反应,最终造成空答,也有一些同学对HBr的性质掌握不扎实,不清楚白雾是什么,而错答B。
答案:D
例3.近年来,矿难时常发生,2005年冬,由于人为因素造成的大矿难,令人心悸,148条性命,因工作人员的疏忽而离开了这个世界。在煤矿的煤井里,除了采取必要的安全措施,如“通风、严禁烟火等”外,还要随时监测瓦斯的含量。当瓦斯的在空气中提及分数含量为5%~~15%,点燃就会爆炸,那么假如要想瓦斯爆炸最强烈,请问甲烷所占的体积分数为
A.15% B.10.05% C.9.5% D.5%
分析思路:本题从煤矿矿难入手,对瓦斯爆炸这一社会热点展开考查,没有考查常规的甲烷的结构、性质等,而是对瓦斯发生最大爆炸时候的极限进行考查。本题要想使瓦斯爆炸最强烈,则要使甲烷和空气中的氧气充分反应,
错因分析:而很多同学因为认识不到“本题要想使瓦斯爆炸最强烈,则要使甲烷和空气中的氧气充分反应,”,而错答。
答案:C
例4. 已知煤经过干馏后可以制得多种芳香族化合物,下列来自煤的芳香烃的一氯取代物的同分异构体的数目最多的是
解析思路:本题考查了同学们的空间思维能力,要求能够正确判定这几类芳香烃的一氯代物的种类。解析本题的关键是对几种芳香烃的空间结构有一个明确地认识,从而正确书写出一氯代物的结构。它们的一氯代物结构:A中物质有两种一氯代物;B有三种一氯代物;C中有三处同分异构体;D物质有五种一氯代物同分异构体。
错因分析:由于对这些芳香烃的空间构型认识模糊,导致容易漏答,或者是重复计算,不能正确而造成错误。
答案:D
例5.已知将煤高温干馏可除了可以得到苯、二甲苯外,还可以得到三甲苯和甲乙苯,它们的分子式都是C9H12,其同分异构体共有6种。其中有n种同分异构体将它们分别进行一硝化(即:向分子中苯环上导入一个硝基),都分别只能得到两种异构体产物(C9H12NO2)。则n等于
A.0 B.1 C.2 D.3
解析思路:本题通过对硝化产物数目的考查,展开对三甲苯和甲乙苯可能出现的同分异构体的结构的考查。在解析过程中首先要分析分子式为C9H12的三甲苯和甲乙苯可能出现的同分异构体的结构,然后对它们的同分异构体进行一硝化,得到一硝化产物,从而得出答案。
错因分析:在解析过程中,往往由于对三甲苯和甲乙苯的同分异构体的结构推导出现错误,而最终错答本题。
答案:C
例6. 已知将煤处理后可以得到二甲苯,二甲苯苯环上的一溴代物共有3种。可以用还原的方法得到3种二甲苯,它们的熔点分别列于下表
6种溴二甲苯的熔点
234℃
206℃
213.8℃
204℃
214.5℃
205℃
对应还原的二甲苯
13℃
-54℃
-27℃
-54℃
-27℃
-54℃
由此推断熔点为234℃的分子的结构简式为_________________,熔点为54℃
的分子结构简式____________________。
解析思路:本题看似无从下后,因此很多学生都出现了错误,其实解析本题是考查了二甲苯以及溴二甲苯的结构,我们可以从题给信息得知,溴二甲苯六种各自不同的熔点,告诉我们这是六种一溴代物,而二甲苯只有3种沸点。根据沸点的不同,推论得到三种物质从而得出答案。
错因分析:不能正确地领会信息,不能将熔点和知识连接起来,而造成了空答。
答案:
煤干馏产物——芳香族化合物高考试题欣赏
广东 李晓风
煤干馏产物——芳香族化合物是重要的工业原料,也是高中化学的重要内容,在历年的高考中都占有一席之地,下面选择两高考题,供大家参考。
HO
HO
HO─—COOH
例1.(2005年广东卷)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为:
(1)用没食子酸制造墨水主要利用了___________________类化合物的性质(填代号)。
A、醇 B、酚 C、油脂 D、羧酸
(2)没食子酸丙酯且有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为________________________________________________。
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_________________________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有___________种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:
__________________________________________________ ___________
解析:苯环作为一种官能团具有它的特殊性质,当其他官能基团与它相连接时,会受到它的影响。羟基与苯环相连后是酚,酚与铁离子显示特殊的颜色。没食子酸上有羧基、羟基,所以它具有羧酸的性质,又具有酚的性质,可以发生脂化、加成、使有些物质显示特殊颜色、取代等等反应。此题是对有机物官能团和反应类型的综合考察。大家容易错在只考虑官能团,而不考虑官能团之间相互影响造成的官能团性质的变化。
HO
HO
HO─—COOCH2 CH2 CH3
答案:(1) B(2)
HO─—COOCH2 CH3 + 2NaOH → NaO─—COONa + CH3 CH2OH + H2O
Δ
(3) C11H14O3
(4)
例2.(2002年广东卷)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。
(1)写出A人的结构简式:
A ,C:
(2)D有很多同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中三个的结构简式是
请写出另外两个同分异构体的结构简式:
和
解析:一般芳香族化合物知识容易出现在选择题和推断题中,其中一推断题居多,由于芳香族化和物的特殊结构,增加了考试的难度,是加大考题区分度的一种策略。但面对这种考题,大家不要心慌,只要静下心来,根据各个官能团的性质(吸电子还是推电子等)认真思考它们之间相互影响,找出其中的奥妙,就没问题了。此题用逆推法很容易看出C是苯甲醇,B是苄基氯,A就是甲苯了,下面答案很快就出来了。
答案:(1)A:-CH3 C:-CH2―OH
(2)
矿石资源·化石燃料例题解析
矿石资源和化石燃料对人们的生产生活起着十分重要的作用。下面我们通过例题从化学的角度分析关于它们在生活、生产中的应用。
【例1】 关于化工厂的设计是将实验室的研究成果转化为工业化工生产的重要基础工
作,需要考虑许多综合问题,所以设计一座化工厂是非常复杂,那么根据已学的知识试分析“设计”一座硫酸厂应在哪里选择厂址。
一座硫酸厂的转化器中将SO2和O2以体积比为1/2混合后,通入接触室发生反应 2SO2 + O2≒2SO3(g) 达平衡时,在同温、同压下测得反应前与反应后混合气体的密度之比为13/15。求SO2的转化率?又知工业上反应前后混合气体的密度比上述的密度比稍小,试回答SO2接触氧化为SO3时不采取加压措施的原因。
【解析】化工厂厂址的选择是一个复杂的问题,它涉及原料、水源、能源、土地供应、市场需求、交通运输和环境保护等诸多因素.应对这些因素全面综合地考虑,权衡利弊,才能做出正确的选择.硫酸厂厂址的选择,就应考虑以上的各种因素外,还应考虑到,硫酸是一种腐蚀性液体,不能像普通固体化工产品那样可以较多的贮存,需要随产随销.硫酸的运输成本较高,1t H2SO4的运价约为1t黄铁运价的三倍,这就决定了硫酸厂应靠近消费中心,比靠近原料产地更有利.工厂规模的大小,主要由硫酸的用量的多少来决定.此外,硫酸厂选址应避开人口稠密的居民区和环境保护要求高的地区.
根据相同条件下气体的密度之比等于同体积气体的质量之比,且反应前后质量守恒,可得出气体的密度之比等于气体体积的反比。 设反应前混合气体中SO2的体积为1 L,O2 应为2L达平衡时SO2的转化的体积为x 。
在工业上不加压,SO2的转化率就达80% 以上,已经很高,若再加压SO2的转化率提高不大,但对设备的要求要提高许多,故没有必要再加压。
【例1】 砖瓦是用含铁元素等杂质的粘土隔绝空气烧制成的,当烧窑作业邻近结束时,若
用淋洒水办法来降低温度,窑内处于还原性气氛,砖块中的铁以氧化亚铁的形式存在,因而砖成青色。若用捅开的窑顶自然冷却的办法,砖就变成了红色。
⑴从化学角度看,砖瓦呈红色的原因是 。
⑵现在一块红砖,实验台上有浓硫酸、3mol/L的盐酸、0.1mol/L的硫氰化钾溶液、0.1mol/L的氯化铁溶液、0.01mol/L的氢氧化钠溶液、蒸馏水等试剂,请选用中学化学的常用仪器,设计一个实验,用最简捷的方法验证红砖中含有三价铁。(简述实验步骤,所用仪器、产生现象、所得结论)
【解析】(1)Fe2+在空气中不稳定,所以捅开窑顶,空气进入窑内,铁元素被氧化成三价铁,生成红色的Fe2O3。
(2)由(1)中知道红砖中含的是Fe2O3 ,要检验红砖中是否含有Fe3+ ,就得将Fe2O3转化为Fe3+ 。检验Fe3+ 用KSCN溶液,因为Fe3+ 与SCN-形成红色的络合物。
实验方法:将少许红砖研成粉末,取少许粉末加过量盐酸,振荡,静置,取上层清液加KSCN溶液,若呈血红色溶液,证明含有Fe3+。
【例3】石油分馏可以得到汽油,1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备:
填写下列空白:
①写出本题中制备1,2-二溴乙烷的两个化学反应方程式: , 。
② 安全瓶b可以防止倒吸,并可检查实验进行时试管d是否发生堵塞,请写出发生堵塞时瓶b中的现象_
② 容器c中的NaOH溶液的作用是:_____ 。
③ 某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果的气密性没有问题,试分析其可能的原因。
【解析】①要制得1,2-二溴乙烷首先要得到乙烯,所以先制乙烯。实验室制乙烯的方法是用在浓硫酸的条件下加热乙醇(温度控制在170℃)。
用乙烯在与溴加成就得到溴乙烷 CH2==CH2+Br2 → CH2BrCH2Br
②b中水面下降,玻璃管中水柱上升,甚至溢出。
③氢氧化钠能与酸性氧化物反应,所以用以除去酸性气体(或除CO2、SO2等)
④可能的原因有两种 : A、乙烯发生过快 B、温度控制不当
【例4】为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上通过生石灰和含硫的煤混合使用可以“固硫”(避免硫化合物进入大气),最后生成石膏。试回答:
⑴ 整个“固硫”反应所涉及的反应类型包括:①化合②分解③置换④复分解⑤氧化还原反应⑥非氧化还原反应⑦离子反应⑧非离子反应(分子反应)。其中正确的是( )
A.①⑤⑥⑦ B.①②③⑤⑧ C.①⑤⑥⑧ D.②④⑤⑦
⑵ 第一步“固硫”反应的化学方程式中所需气态物质的化学计量数之和为( )
A.1 B. 2 C.3 D.4
⑶ 比较此法与“石灰石粉末与含硫煤混合”法哪个更好些?为什么?
⑷ 你认为减少酸雨产生可采取的措施是( )
①少用煤作燃料②把工厂的烟囱造高 ③先将燃料煤脱硫 ④在土壤中加石灰防止酸化
⑤开发新能源,避免含S、N的氧化物大量排放
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
【解析】
⑴ 在含硫的煤中加生石灰“固硫”的反应是CaO+ SO2== CaSO3、2CaSO3+O2== 2CaSO4,由以上化学方程式可知涉及到的反应类型有化合、氧化还原反应、非氧化还原反应和非离子反应。
⑵ 易错选B。主要是区分哪一个反应是第一步“固硫”反应。
⑶ 有的学生误认为是“石灰石粉末与含硫煤混合”法更好。忽略了实际生产中石灰石分解为CaO需消耗很高能量,浪费煤,使生产成本提高。
⑷把烟囱造高不能减少SO2的排放量;在土壤中施放石灰虽可中和酸雨造成的酸性,但由于生成CaSO4,长期使用会使土壤板结,影响土质。
〖答案〗:
⑴ C;⑵ A;⑶ 在含硫煤中加入生石灰的方法更好,因为此法节约煤,成本低;⑷ C 。
一道与环保有关的典题解析
有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改变汽油组成的办法来改善汽油的燃烧性能。例如,加入 CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有 。(填写编号)
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要的成分是 。能说明它是正四面体而非正方形平面结构的理由是 。(填写编号)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体③它是非极性分子 ④它的键长和键角都相等
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50 km·h-1行驶了40 km。要有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济的制氢方法是 。(填写编号)
①电解水②锌和稀硫酸反应③光解海水
其次,制得纯氢气后还需要解决的问题是 。(例举其一)
解析:(1)只要写出结构简式
就可以看出答案;
(2)天然气的主要成分是甲烷,若为平面正方形结构,则其二元取代物有两种同分异构体,而正四面体的二元取代物不存在同分异构体;(3)电解水消耗大量的电能,锌和稀硫酸的反应也不适合于工业大量生产,只有利用太阳光使海水光解才是经济的方法。但氢气的密度小、沸点低,输送和储存有一定的难度。此题考查了有机化合物的结构和环保知识,有机化合物的结构是有机化学的基础,是每年必考内容,环保问题也日益受到重视,必将在今后的高考中重现。
答案:(1) ③ (2) 甲烷 ② (3) ③ 氢气的输送和贮存