- 2021-08-23 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年四川省成都外国语学校高二上学期入学考试化学试题(Word版)
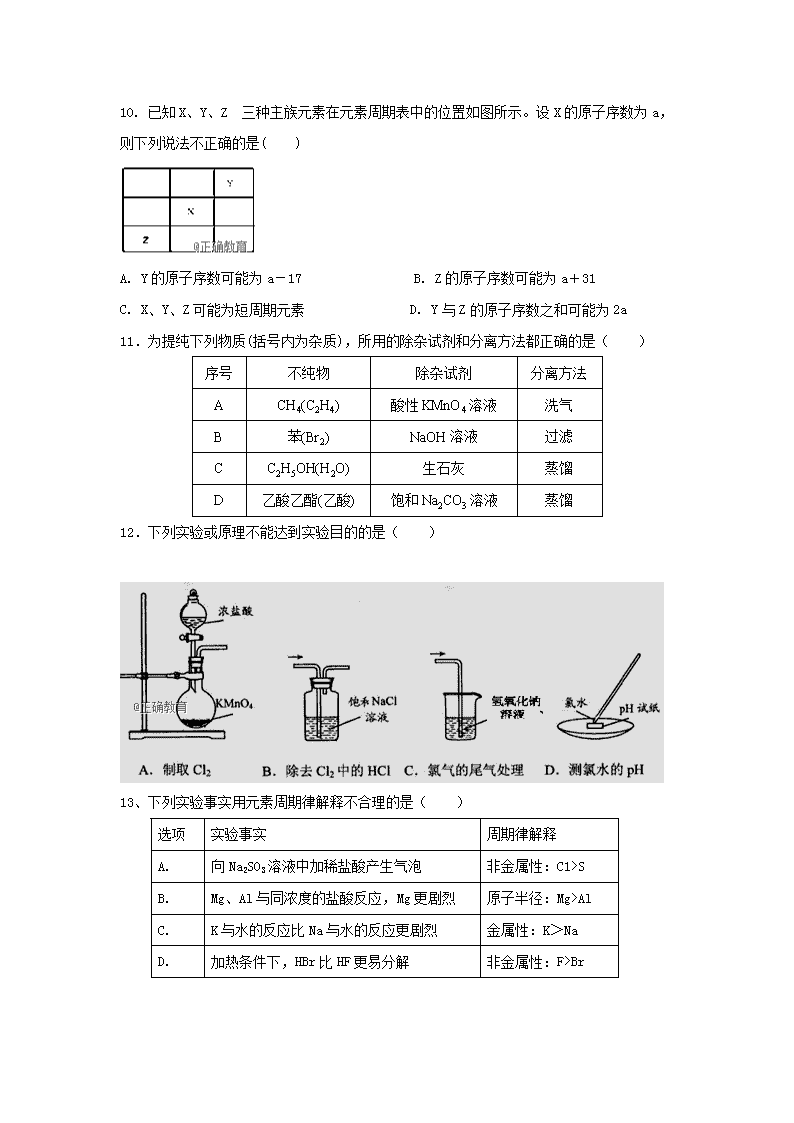
成都外国语学校2018-2019上学期入学考试高二化学试题 出题人:王启卫 审题人:谭建武 注意事项: 1、本试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分。 2、本堂考试90分钟,满分100分。 3、答题前,考生务必先将自己的姓名、学号填写在答卷上,并使用2B铅笔填涂。 常见古诗文记载 化学知识 A 《泉州府志》:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。 泥土具有吸附作用,能将红糖变白糖 B 《荀子·劝学》:冰水为之,而寒于水。 冰的能量低于水,冰变为水属于吸热反应 C 《本草纲目》:釆蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如石(石碱),浣衣发面。 石碱具有碱性,遇酸产生气体 D 《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测。 性质不稳定,撞击易爆炸 可能用到的相对原子质量:H -1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 K-39 Mn-55 Fe-56 Cu-64 第Ⅰ卷(选择题) (共26个小题,每小题只有一个选项符合题目要求。每小题2分,共52分。) 1. 化学知识无处不在,下列与古诗文记载对应的化学知识不正确的是( ) 2. 下列各组化合物中,化学键的类型完全相同的是( ) ①CaCl2 和Na2S ②CO2 和CS2 ③Na2O 和Na2O2 ④HCl 和NaOH A. ①② B. ①③ C. ②③ D. ②④ 3、下表中对于相关物质的分类全部正确的是( ) 选项 纯净物 混合物 碱性氧化物 非电解质 A. 液氧 漂白粉 Al2O3 CO B. 生理盐水 氢氧化铁胶体 Na2O2 乙醇 C. 碱石灰 盐酸 K2O Cl2 D. 胆矾 水玻璃 CaO SO2 4. 下列有关化学用语的表示方法中正确的是( ) A. 次氯酸的电子式: B. Na+的结构示意图: C. 用电子式表示MgCl2的形成过程为: D. M2+离子核外有a个电子,b个中子,M原子符号为M 5.Ne是最早发现的Ne元素的稳定同位素,汤姆逊(J.J.Thomson) 和阿斯通(F.W.Aston)在1913年发现了Ne。下列有关Ne和Ne的关系说法正确的是( ) A.同分异构体 B.不同的核素 C.性质相同 D.同系物 6.下列金属用热还原法冶炼的是( ) A.钠 B.银 C.铁 D.汞 7.下列物质中,不属于化石燃料的是( ) A.煤 B.石油 C.天然气 D.酒精 8.下列离子方程式正确的是 ( ) A.硫化钠溶液跟稀硝酸相混合:S2-+2H+=H2S↑ B.在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解: 3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O C.碳酸钠溶液中通入过量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- D.硫酸氢钠溶液与氢氧化钡溶液以等物质的量混合: SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O 9.下列各组离子在PH=1的无色溶液中,因发生氧化还原反应而不能大量共存的是 ( ) A. Na+、K+、CO32-、NO3- B. NH4+、Na+、NO3-、S2- C. Al3+、Na+、MnO4-、I- D. NH4+、OH-、SO42-、K+ 10. 已知X、Y、Z 三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是( ) A. Y的原子序数可能为a-17 B. Z的原子序数可能为a+31 C. X、Y、Z可能为短周期元素 D. Y与Z的原子序数之和可能为2a 11.为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( ) 序号 不纯物 除杂试剂 分离方法 A CH4(C2H4) 酸性KMnO4溶液 洗气 B 苯(Br2) NaOH溶液 过滤 C C2H5OH(H2O) 生石灰 蒸馏 D 乙酸乙酯(乙酸) 饱和Na2CO3溶液 蒸馏 12.下列实验或原理不能达到实验目的的是( ) 13、下列实验事实用元素周期律解释不合理的是( ) 选项 实验事实 周期律解释 A. 向Na2SO3溶液中加稀盐酸产生气泡 非金属性:C1>S B. Mg、Al与同浓度的盐酸反应,Mg更剧烈 原子半径:Mg>Al C. K与水的反应比Na与水的反应更剧烈 金属性:K>Na D. 加热条件下,HBr比HF更易分解 非金属性:F>Br 14、图中U→Z六种物质在适当条件下能实现图示箭头方向一步转化,且反应①、②均为置换反应,满足条件的物质组是( ) 序号 U W Y X ① Na H2O Na2O2 NaOH ② Fe H2O C H2 ③ HBr Cl2 H2O HC1 ④ CuCl2 (aq) A1 HCl(aq) AlCl3(aq) A.②④ B.②③ C.①②④ D.①②③④ 15.下列有关性质的比较,不能用元素周期律解释的是( ) A.酸性:HCl>HF B.金属性:Na>Mg C.碱性:KOH>NaOH D.热稳定性:HCl>HBr 16. 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下图所示。下列描述错误的是( ) A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法 B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品 C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小 D. 用SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O==4H++SO+2Br- 17、肼(N2H4)又称联氨,可用如下方法制备:CO(NH2)2+ClO-+OH- → N2H4+Cl-+CO32- +H2O [CO(NH2)2中N为-3价,方程式未配平]。下列说法不正确的是 ( ) A.N2H4是氧化产物 B.N2H4中存在极性键和非极性键 C.配平后,OH-的化学计量数为2 D.生成3.2 g N2H4转移0.1 mol电子 18.下列关于人体所需的基本营养物质的说法错误的是( ) A.在人体内,油脂的主要反应是在脂肪酶催化下水解为高级指肪酸和甘油 B.加酶洗衣粉中的酶其实是蛋白质 C.糖类、油脂、蛋白质都能在一定条件下发生水解反应 D.糖类都由C、H、O三种元素组成 19. 下列反应属于取代反应的是( ) A.乙烯通入溴水中 B.光照甲烷与氯气的混合气体 C.苯与溴水混合后撒入铁粉 D.在镍做催化剂的条件下,苯与氢气反应 20.下列物质中,在一定条件下既能发生加成反应,也能发生取代反应,但不能使KMnO4酸性溶液褪色的是( ) A.乙烷 B.苯 C.乙烯 D.乙醇 21.下列检验方法,利用该气体的氧化性的是( ) A.Cl2使湿润的淀粉碘化钾试纸变蓝 B.SO2使品红溶液褪色 C.NH3使湿润的红色石蕊试纸变蓝 D.NO遇到空气变为红棕色 22.已知乙烯分子中含有一个碳碳双键,分子呈平面结构,六个原子都在同一平面上,下列对丙烯(CH3-CH=CH2)结构和性质的推断正确的是( ) A.丙烯分子中所有的原子都在同一平面上 B.丙烯分子中三个碳原子有可能在同一条直线上 C.过量的丙烯通入浓溴水中,观察到溴水褪色,溶液均一稳定 D.丙烯既可以发生加成反应,又可以发生取代反应 23.下列化合物中同分异构体数目最少的是( ) A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯 24.下列关于高分子化合物与单体的说法中正确的是( ) A.单体为一种物质时,则单体只能发生加聚反应 B.在28 g乙烯、丙烯和聚乙烯树脂中,含有的碳原子数目为2NA C.可由两种单体通过加聚反应制得 D.工程塑料ABS树脂 可由3种单体通过缩聚反应制得 25. 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( ) A.2种 B.3种 C.4种 D.5种 26、某链状有机物分子中含m个 、n个-CH2-、X个-CH3,则X的数目可能是( ) A.3m+2n B.m+2n C.m+2 D.3m 第Ⅱ卷 (非选择题共48分) 27.(16分)( I)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答: (1)D元素在周期表中位置为_____________________; (2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________; (3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________; (4)用电子式表示C2E的形成过程__________________________________________; (5)1 mol F与A元素的最高价氧化物反应时转移的电子数为_________。 ( II )、(8分)某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题: (1)按右图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称是 ; 实验过程中,装置B中观察的现象是 ;装置C中有白色沉淀生成,该沉淀是 (填化学式)。 (2)装置A反应容器中还会产生CO2气体,请写出产生CO2的化学方程式 。 (3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为 (填序号);然后再进行的操作是从a处多次鼓入N2,其目的是 。 28、(16分)( I ).(共6分) 下表是A、B两种有机物的有关信息: A B ①分子模型为:; ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 根据表中信息回答下列问题: (1)关于A的下列说法中,不正确的是 (填标号)。 a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2 (2) A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n= 时, 这类们机物开始出现同分异构休。 (3) B与乙醇反应的化学方程式为 ,反应类型为 。 (4)以A为原料可直接生产一种高分子化合物P,则P的结构简式为 。 ( II )(10分). 已知有机物A~F有如图转化关系: 已知:①2CH3CHO+O2 2CH3COOH+2H2O; ②CH3CH2OHCH2=CH2↑+H2O(该反应属于消去反应)。 ③A的分子式为C10H20O2; ④B分子中含2个甲基; ⑤ D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种; ⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白: (1)B可以发生的反应有 (填序号)。 ①取代反应 ②消去反应 ③加聚反应 ④氧化反应 (2)D分子所含有的官能团的名称是 。 (3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式 。 (4)写出下列转化的化学方程式: B+E―→A: ; B―→C: ; F―→G: 。 29.(16分) 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一, 其流程如下: 资料显示:Ⅰ.pH=2时, NaNO2溶液只能将I- 氧化为I2,同时生成NO; Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl; Ⅲ.5SO32-+2IO3-+2H+=I2+5SO42-+H2O; Ⅳ.I2在碱性溶液中反应生成I-和IO3-。 (1)反应①的离子方程式 。 (2)方案甲中,根据I2的特性,分离操作X的名称是 。 (3)已知:反应②中每吸收3molI2转移5mol电子,其离子方程式是 。 (4) Cl2、 酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是 。 (5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。 请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3 溶液 A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。 B. 。 (6).某学生计划用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸450 mL。回答下列问题: 实验过程中,不必使用的是________(填字母)。 A.托盘天平 B.量筒 C.容量瓶 D.250 mL烧杯 E.胶头滴管 F. 500 mL试剂瓶 (7) 除上述仪器中可使用的以外,还缺少的仪器是________;在该实验中的用途是_____________________________________________________。 (8 ) 量取浓盐酸的体积为______ mL,应选用的量筒规格为________。 (9) 配制时应选用的容量瓶规格为______________。 高二入学考试化学参考答案 1—5:BADDB 6—10:CDBBC 11—15:CDAAA 16—20:CDCBB 21—25:ADABC 26C 27(16分)( I)、 (1). 第三周期IIIA族 (2). (3). S=C=O (4). C+SO2CO2+S (5). (6). NA或6.02×1023 ( II )、(1)分液漏斗(1分);品红试纸褪色(1分),石蕊试纸变红(1分);BaSO4(1分)(2)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(2分) (3)③②④(1分);除尽装置中的空气,防止空气中的CO2影响实验(1分) 28、( I ).(共6分)(1)C(1分) (2)4(1分) (3)CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O(2分), 酯化(或取代)反应(1分) (4)(1分) ( II )(10分).(1)①②④(1分) (2)羧基(1分) 29、(16分)(1)2NO2-+2 I-+4H+ =I2+2NO+2H2O (2分) (2)升华(或加热)、冷凝结晶(无冷凝结晶不扣分)(2分) (3)3I2+3CO32-=5I-+IO3-+3CO2 (或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-) (2分) (4)氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2(或亚硝酸钠仅能把碘离子氧化成碘单质,意思对即可) (2分) (5)从水层取少量溶液于试管中,加入几滴淀粉溶液,滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-;另从水层中取少量溶液于试管中,加入几滴淀粉溶液,加硫酸酸化,滴加Na2SO3溶液,振荡,溶液变蓝,说明滤液中含有IO3-(2分) (6)A(1分) (7)玻璃棒 稀释浓盐酸时起搅拌作用,使溶液混合均匀;将烧杯中稀释的溶液转移到容量瓶中时起引流作用(1分) (8)4.2 (1分)10 mL(1分) (9)500 mL(1分)查看更多