- 2021-08-23 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年山西省芮城市高二3月月考化学 word版
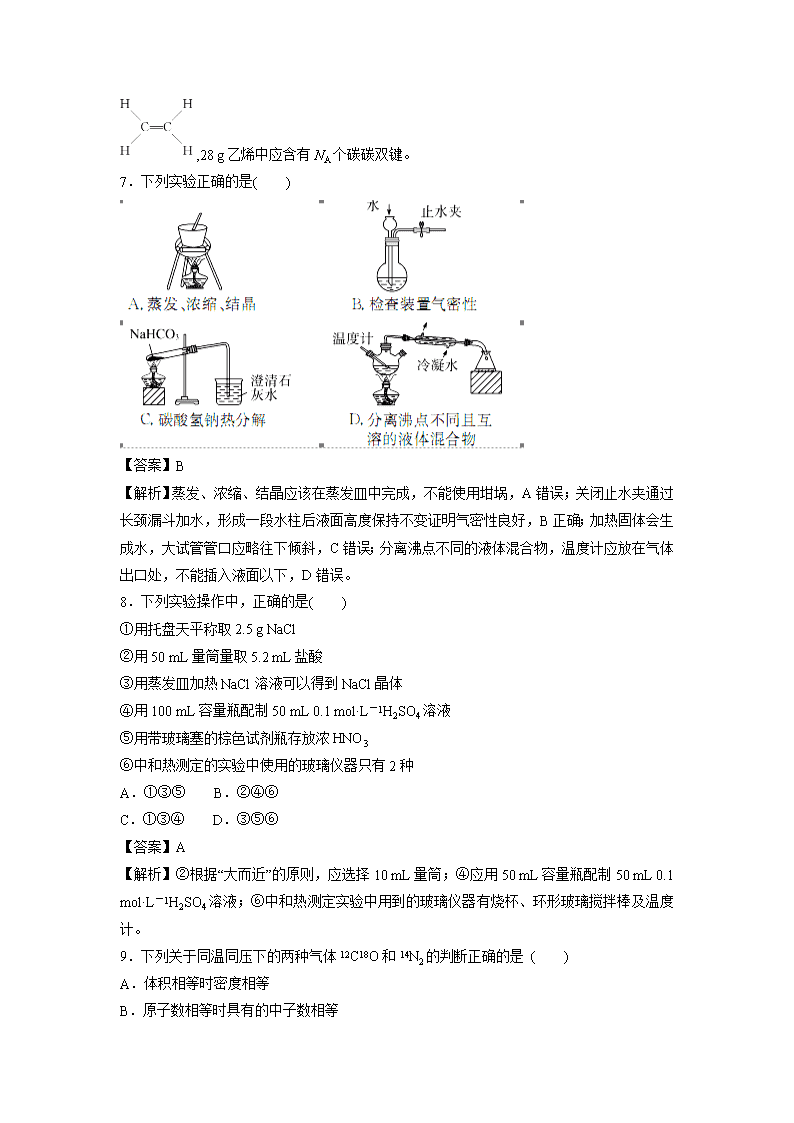
山西省芮城市2019-2020学年高二3月月考化学测试题 一、 选择题(每小题只有一个正确选项,每小题4分,共60分) 1.我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离( ) A.苯和水 B.乙酸乙酯和乙酸 C.食盐水和泥沙 D.硝酸钾和硫酸钠 答案 B 解析 烧酒的制造工艺利用蒸馏的方法,可用于分离沸点不同的液体混合物。A项,苯和水互不相溶,可用分液的方法分离,错误;B项,乙酸乙酯和乙酸沸点不同,可用蒸馏的方法分离,正确;C项,泥沙不溶于水,可用过滤的方法分离,错误;D项,硝酸钾和硫酸钠的溶解度不同,可用重结晶的方法分离,错误。 2.下列说法正确的是(NA代表阿伏加德罗常数的值)( ) A.1 mol Na被完全氧化为Na2O2,失去的电子数为2 NA B.常温常压下,16 g O3气体含有氧原子数为NA C.常温常压下,22.4 L CO2含有分子数为NA D.18 g D2O所含有电子数为10NA 【答案】B 3.关于化学实验操作或实验事故处理,下列叙述错误的是( ) A.用滴管吸取液体后,滴管内剩余的液体应滴回原试剂瓶 B.实验室制取氧气结束时,先把导管从水中移出,再撤去酒精灯 C.碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 D.稀释浓硫酸时,把浓硫酸沿着器壁慢慢注入水中,并不断搅拌 【答案】A 4.同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是( ) A.x∶y等于甲与乙的相对分子质量之比 B.x∶y等于甲与乙的分子个数之比 C.x∶y等于同温同压下甲与乙的密度之比 D.y∶x等于同温同体积下等质量的甲与乙的压强之比 【答案】B 5.下列有关实验原理或操作正确的是( ) A.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2 B.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶 C.洗涤沉淀时(如图2),向漏斗中加适量水,搅拌并滤干 D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 【答案】B 【解析】A项,不能用图1装置收集NO,错误;B项,利用SO2的还原性,用KMnO4酸性溶液除去,正确;C项,洗涤沉淀时,在过滤器中的沉淀中加入蒸馏水,浸没沉淀,让水自然流下,不用玻璃棒搅拌,错误;D项,乙醇不可以作为萃取剂,错误。 6.设NA为阿伏加德罗常数的数值,下列说法正确的是( ) A.1 mol甲烷中含有10NA个质子 B.27 g铝被完全氧化成氧化铝,失去2NA个电子 C.标准状况下,22.4 L苯含有NA个C6H6分子 D.常温常压下,28 g乙烯含有2NA个碳碳双键 【答案】A 【解析】B项,应失去3NA电子;C项,标况下,苯为液体;D项,乙烯的结构式为 ,28 g乙烯中应含有NA个碳碳双键。 7.下列实验正确的是( ) 【答案】B 【解析】蒸发、浓缩、结晶应该在蒸发皿中完成,不能使用坩埚,A错误;关闭止水夹通过长颈漏斗加水,形成一段水柱后液面高度保持不变证明气密性良好,B正确;加热固体会生成水,大试管管口应略往下倾斜,C错误;分离沸点不同的液体混合物,温度计应放在气体出口处,不能插入液面以下,D错误。 8.下列实验操作中,正确的是( ) ①用托盘天平称取2.5 g NaCl ②用50 mL量筒量取5.2 mL盐酸 ③用蒸发皿加热NaCl溶液可以得到NaCl晶体 ④用100 mL容量瓶配制50 mL 0.1 mol·L-1H2SO4溶液 ⑤用带玻璃塞的棕色试剂瓶存放浓HNO3 ⑥中和热测定的实验中使用的玻璃仪器只有2种 A.①③⑤ B.②④⑥ C.①③④ D.③⑤⑥ 【答案】A 【解析】②根据“大而近”的原则,应选择10 mL量筒;④应用50 mL容量瓶配制50 mL 0.1 mol·L-1H2SO4溶液;⑥中和热测定实验中用到的玻璃仪器有烧杯、环形玻璃搅拌棒及温度计。 9.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是 ( ) A.体积相等时密度相等 B.原子数相等时具有的中子数相等 C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等 答案 C 解析 根据阿伏加德罗定律并结合微粒间相互关系逐一分析。A项根据阿伏加德罗定律,同温同压下,同体积的任何气体含有相同的分子数,即气体的物质的量相同,但由于12C18O与14N2的摩尔质量不相等,故质量不相等,密度也不相等;B项二者都是双原子分子,原子数相等时二者的物质的量相等,二者所含中子数不相等,1个12C18O分子含有16个中子,1个14N2分子含有14个中子;C项同温同压下,同体积的气体的物质的量相等,且1分子12C18O与14N2中均含有14个电子,故12C18O与14N2具有的电子数相等;D项12C18O与14N2质子数相等,质量相等时二者物质的量不相等,含有的质子数也不相等。 10.仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的的是( ) 选项 实验目的 仪 器 A 除去氢氧化铝胶体中的泥沙 漏斗(带滤纸)、烧杯、玻璃棒 B 从食盐水中获得NaCl晶体 坩埚、玻璃棒、酒精灯、泥三角 C 用0.10 mol·L-1的盐酸测定未知浓度的NaOH溶液浓度 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 D 用MnO2和浓盐酸制取干燥、纯净的Cl2 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 【答案】B 11.在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( ) a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④ d.氢原子个数①>③>④>② A.abc B.bcd C.abd D.abcd 答案 D 解析 先把题中提供的量都分别转化为各物质的物质的量,然后再比较它们的体积、密度等。标准状况下6.72LCH4的物质的量为0.3mol,3.01×1023个HCl分子的物质的量为0.5mol,13.6gH2S的物质的量为0.4mol,然后进行比较即可得出结论。 12.下列有关实验操作正确的是( ) A.称量氢氧化钠固体 B.检验铁粉与水蒸气反应产生的氢气 C.配制175 mL 0.10 mol·L-1盐酸 D.分离两种互溶但沸点相差较大的液体混合物 【答案】B 【解析】A项,称量NaOH固体时应遵从“左物右码”的原则且不能在滤纸上称量,错误;C项,用100 mL的容量瓶无法配成175 mL溶液,错误;D项,蒸馏时冷凝管中的水应从下端进,上端出,错误。 13.下列实验操作完全正确的是( ) 编号 实 验 操 作 A 钠与水的反应 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 B 配制一定浓度的氯化钾溶液1 000 mL 准确称取氯化钾固体,放入1 000 mL 的容量瓶中,加水溶解,振荡摇匀,定容 C 排除碱式滴定管尖嘴部分的气泡 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 D 取出分液漏斗中所需的上层液体 下层液体从分液漏斗下端管口流出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 【答案】C 【解析】A项,钠保存在煤油中,表面有覆盖的煤油,所以应用滤纸吸去表面的煤油,且钠与水反应剧烈,水的量不应太多,错误;B项,配制步骤为计算、称量、溶解、转移、定容等步骤,不能直接在容量瓶中进行,错误;D项,分液时,下层液体从下口流出,上层液体只能从上口倒出,若从下口流出,会混有下层液体,错误。 14.NA表示阿伏加德罗常数的数值,下列说法不正确的是( ) A.将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH B.1mol·L-1CH3COOH与1mol·L-1CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA C.常温常压下,3.6gH2O中含有电子数为2NA D.含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g 答案 B 解析 A项,根据电荷守恒,NH的物质的量等于NO的物质的量;B项,没有指明混合溶液的体积;C项,×10NA·mol-1=2NA;D项,质量为16 g·mol-1×2 mol=32 g。 15.从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是( ) 【答案】C 二..填空题(每空4分,共40分) 16.标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则: (1)混合气体的密度是 。 (2)混合气体的平均摩尔质量是 。 (3)CO2和CO的体积之比是 。 答案 (1)1.339 g·L-1 (2)30 g·mol-1 (3)1∶7 解析 (1)ρ==≈1.339 g·L-1。 (2)解法一:n==0.5 mol,M===30 g·mol-1。 解法二:M=ρ·Vm=1.339 g·L-1×22.4 L·mol-1≈30 g·mol-1。 (3)同温同压下,两种气体体积之比等于其物质的量之比,最简单的方法是用十字交叉法计算: =。 17.(1)在25 ℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为 。 (2)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为 。 答案(1)30 g·mol-1(2)44 g·mol-1 解析 (1)温度、压强相同时,气体体积之比等于其物质的量之比,15∶8=∶,M(A)=30 g·mol-1。 (2)温度、体积相同时,气体压强之比等于其物质的量之比,4∶11=∶,M(A)=44 g·mol-1。 18.某实验小组利用如下装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。 按图连接好实验装置。检查装置的气密性,方法是_____________________________ ________________________________________________________________________。 答案 关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质玻璃管,若导管口有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,导管内形成一段水柱,并且一段时间不回落,说明装置气密性良好 19.化学是一门以实验为基础的科学。 (1)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是________(填字母)。 A B C D 干燥氯气 吸收NH3 石油的分馏 制取乙酸乙酯 (2)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): 称取粗盐滤液精盐 ①第Ⅰ步操作的名称是____________。 ②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。 ③第Ⅴ步操作所需玻璃仪器的名称是__________________________________________。 答案 (1)B (2)①溶解 ②有影响 ③漏斗、玻璃棒、烧杯 解析 (1)A中应长管进短管出;B中NH3不溶于CCl4,不会引起倒吸,且上层的水会吸收NH3,防止NH3逸出;C中石油分馏中,温度计的水银球应在蒸馏烧瓶的支管口处;D中由于蒸出的乙酸乙酯中含有乙醇、乙酸,它们均易溶于水,当导管口插入液面以下时易发生倒吸,饱和食盐水应改为饱和Na2CO3溶液。 (2)除去粗盐中的可溶性杂质,实际上就是除去镁离子(用氢氧化钠溶液)、钙离子(用碳酸钠溶液)、硫酸根离子(用氯化钡溶液),多余的钡离子用碳酸钠溶液除去,故氯化钡溶液加在碳酸钠溶液之前,沉淀通过过滤除去,滤液中多余的氢氧根离子和碳酸根离子用稀盐酸除去。过滤时用到的主要仪器:漏斗、玻璃棒、烧杯、铁架台等,题目中要求是玻璃仪器,填前三种。 查看更多