- 2021-08-06 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届甘肃省兰州市第四中学高二上学期期末考试试题(解析版)
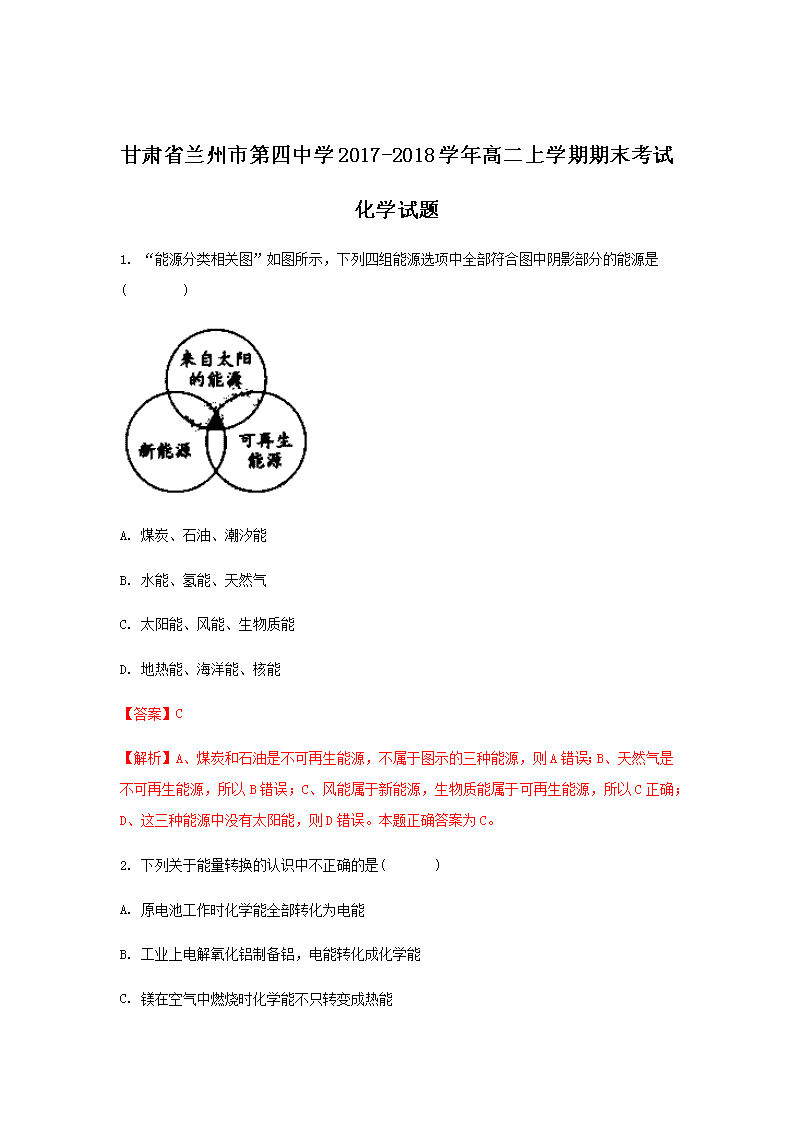
甘肃省兰州市第四中学2017-2018学年高二上学期期末考试 化学试题 1. “能源分类相关图”如图所示,下列四组能源选项中全部符合图中阴影部分的能源是( ) A. 煤炭、石油、潮汐能 B. 水能、氢能、天然气 C. 太阳能、风能、生物质能 D. 地热能、海洋能、核能 【答案】C 【解析】A、煤炭和石油是不可再生能源,不属于图示的三种能源,则A错误;B、天然气是不可再生能源,所以B错误;C、风能属于新能源,生物质能属于可再生能源,所以C正确;D、这三种能源中没有太阳能,则D错误。本题正确答案为C。 2. 下列关于能量转换的认识中不正确的是( ) A. 原电池工作时化学能全部转化为电能 B. 工业上电解氧化铝制备铝,电能转化成化学能 C. 镁在空气中燃烧时化学能不只转变成热能 D. 绿色植物光合作用过程中太阳能转变成化学能 【答案】A 【解析】试题分析:A、能量的转化不一定都是100%的,所以原电池工作时化学能不可能全部转化为电能,A不正确;B、工业上电解氧化铝制备铝,属于电解原理,电能转化成化学能,B正确;C、镁在空气中燃烧时发出耀眼的白光,因此化学能不只转变成热能,C正确;D、绿色植物光合作用过程中生成葡萄糖,太阳能转变成化学能,D正确,答案选A。 考点:考查能量转化的有关判断 3. 下列分别是利用不同能源发电的实例图形,其中不属于新能源开发利用的是 ( ) A. 风力发电 B. 太阳能发电 C. 火力发电 D. 潮汐能发电 【答案】C 【解析】试题分析:A、风能是清洁无污染的环保新能源,A不符合题意;B.太阳能是清洁无污染的新能源,B不符合题意;C、火力发电需要煤作燃料,煤是不可再生能源,也不是环保新能源,C符合题意;D、潮汐和海风发电是新开发利用的环保新能源,D不符合题意,答案选C。 考点:考查了能源的种类的相关知识 4. 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( ) A. B. C. D. 【答案】A 【解析】根据题目所给数据可写出热化学方程式为由此可判断A是该热化学方程式的逆反应的1/2,即,所以A正确;B题目要求生成的水是水蒸气,所以B错误;氢气燃烧是放热反应,△H<0,所以CD都是错误的。本题正确答案为A。 5. 下列说法可以证明反应N2+3H32NH3已达平衡状态的是( ) A. 1个N≡N键断裂的同时,有6个H—H键断裂 B. 1个N≡N键断裂的同时,有3个H—H键断裂 C. 1个N≡N键断裂的同时,有6个N—H键断裂 D. 1个N≡N键断裂的同时,有6个N—H键形成 【答案】C 【解析】试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。选项ABD中反应速率的方向是相同的,一定不能说明。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,答案选C。 考点:考查可逆反应平衡状态的判断 点评:该题是中等难度的试题,该题也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确平衡状态的特点,如何结合具体的可逆反应灵活运用即可。 6. 关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是( ) A. 取等体积的醋酸和盐酸溶液分别稀释至原溶液的倍和倍,结果两溶液的pH仍然相同,则m>n B. 取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 C. 取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多 D. 两种酸溶液中c(CH3COO-)=c(Cl-) 【答案】B 【解析】试题分析:A、pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,促进醋酸的电离,结果两溶液的pH仍然相同,所以醋酸稀释的倍数大,即m>n,故A正确;B、pH相同则氢离子浓度相同,所以取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸等于醋酸,故B错误;C、pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸消耗NaOH的物质的量比盐酸多,故C正确;D、pH相同则氢离子浓度相同,所以氢氧根离子浓度也相同,根据电荷守恒c(CH3COO-)=c(Cl-),故D正确。 考点:本题考查弱电解质的电离平衡、离子浓度判断。 7. 用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( ) A. 22.30mL B. 22.35mL C. 23.65mL D. 23.70mL 【答案】B 【解析】试题分析:滴定管刻度自上而下逐渐减小,所以读数为22.35mL,答案选B。 考点:考查滴定管读数 8. 下图各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( ) A. ②①③④ B. ④③①② C. ④②①③ D. ③②④① 【答案】C 【解析】试题分析:①铁为活泼金属,可与稀硫酸发生反应生成氢气,发生化学腐蚀,反应的离子方程式为Fe+2H+═Fe2++H2↑;②B为原电池装置,Fe较活泼为原电池的负极,发生氧化反应被腐蚀,电极方程式为:Fe-2e=Fe2+,Sn为正极,发生还原反应,电极方程式为2H++2e-=H2↑;③Zn比Fe活泼,形成原电池反应,锌被氧化,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,铁做正极被保护,④铁做负极发生氧化反应被腐蚀,电极方程式为Fe-2e=Fe2+,铜做正极;①发生化学腐蚀,②发生电化学腐蚀,③锌比铁活泼,铁做原电池的正极而被保护,④发生电化学腐蚀,其中两个电极活泼些相差越大铁腐蚀速率越大,②④都是铁做负极被腐蚀,④中电极金属活泼性相差大所以腐蚀速率快,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为④>②>①>③,故答案为C。 【考点定位】考查金属的电化学腐蚀与防护 【名师点晴】注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法是解题关键;明确引起金属腐蚀的原理是答题的关键,关于金属的电化学腐蚀需要掌握以下规律:1、对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。2.活动性不同的两金属:活动性差别越大,活动性强的金属腐蚀越快。3.对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快,且氧化剂的浓度越高,腐蚀越快。4.电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。5.对于不同氧化剂来说,氧化性越强,金属腐蚀越快。反之,防腐措施由好到差的顺序为:外接电源的阴极保护法防腐>牺牲阳极的阴极保护法防腐>有一般防护条件的防腐>无防护条件的防腐。 9. 难溶电解质AB2饱和溶液中,c(A2+) = xmol·L-1,c(B-) = ymol·L-1,则Ksp值为( ) A. B. xy C. xy2 D. 4xy2 【答案】C 【解析】试题分析:根据难溶电解质的化学式可知,Ksp=c(A+)·c2(B-)=xy2,答案选C。 考点:考查溶度积常数的有关判断 点评:本题是常识性知识的考查,难度不大,主要是识记性,不难得分。 10. 相同温度下,根据三种酸的电离常数,下列判断正确的是( ) A. 三种酸的强弱关系:HX>HY>HZ B. 反应HZ+Y-===HY+Z-能够发生 C. 相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大 D. 相同温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX 【答案】B 【解析】A、按照HX、HY、HZ的顺序,三种酸的电离常数依次增大,说明三种酸依次增强,即HX查看更多
- 当前文档收益归属上传用户