2020学年高二化学上学期期末考试试题(A卷)
2019学年高二化学上学期期末考试试题(A卷)
时间:90分钟 满分:100分
相对原子质量:H-1 N-14 O-16 Na-23 S-32 Cu-64 Ba-137
一、选择题(本题包括18小题,1-8每小题2分,9-18每小题3分,共46分。每小题只有一个选项符合题意)
1.电化学在生产和日常生活中有着重要的应用。下列说法正确的是( )
A.扩大铅蓄电池、汞锌锰干电池的生产,满足消费需求
B.铁管道与直流电源正极相连,可减缓管道腐蚀
C.电解氯化镁饱和溶液,可制得金属镁
D.轮船上挂锌锭防止铁腐蚀属于牺牲阳极的阴极保护法
2.有关化学反应原理的说法正确的是( )
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.反应物的热效应与是否使用催化剂无关
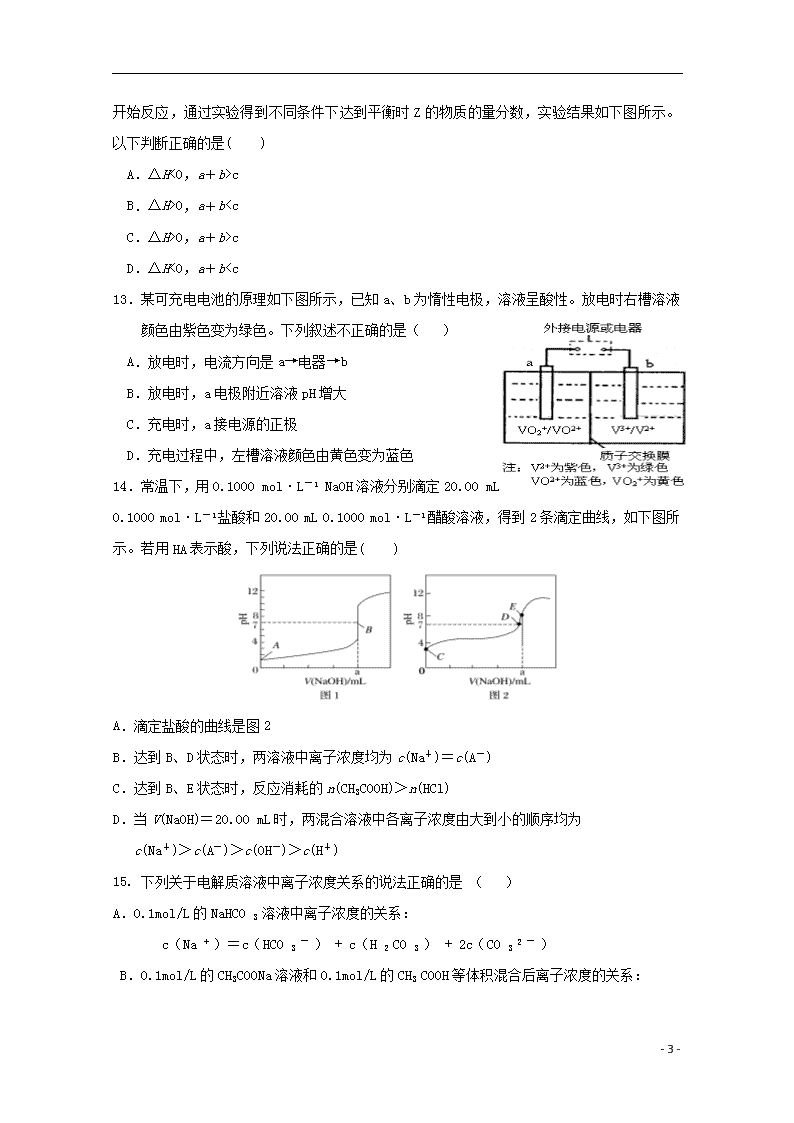
C.已知中和热△H=-57.3 kJ/mol,则1mol浓H2SO4和1mol Ba(OH)2的反应热△H=2×(-57.3) kJ/mol
D.向AgNO3溶液中通入少量HCl气体,溶液的导电性明显增强
3.等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是( )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3
4. 已知FeCl3溶液中存在下列平街:Fe3+ + 3 H2O Fe(OH)3 + 3 H+,下列操作能使FeCl3的水解 程度增大且溶液的酸性增强的是( )
A.加入FeCl3固体 B.加水 C.加入少量浓盐酸 D.升温
5.已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g) =2P2O5(s);△H= -a kJ/mol
4P(红磷,s)+5O2(g) =2P2O5(s);△H= -b kJ/mol
若a、b均大于零,则a和b的关系为( )
A.a>b B.a=b C. a<b D.无法确定
6. 在空气中直接蒸干灼烧下列盐的溶液:①Fe2(SO4)3 ②Na2CO3 ③AlCl 3 ④ NaHCO3
可以得到相应盐的晶体(可以含有结晶水)的是 ( )
A.①② B.①③ C.②④ D.③④
7.下列溶液均处于25℃,有关叙述正确的是( )
- 10 -
A.将醋酸溶液加水稀释1000倍,pH增大3
B.在PH均为3的盐酸和FeCl3溶液中,由水电离的c(OH-)均为1×10-3mo1·L-1
C.PH=8的Ba(OH)2溶液和PH=8的氨水中,由水电离的c(OH-)均为1×10-8mo1·L-1
D.PH=13的NaOH溶液与PH=1的盐酸混合后,一定有c(H+)=c(OH-)
8.化学平衡常数(K)、电离常数(Ka、Kb)、水的离子积常数(KW) 、溶度积常数(Ksp)等常数是表示判断物质性质的重要常数,下列关于这些常数的说法中,正确的是( )
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B. Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)和水的离子积常数(KW)均变大
D.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,
则Ksp(BaSO4)>Ksp(BaCO3)
9.在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
A.x=1 B.2 min内A的反应速率为0.6 mol·L-1·min-1
C.B的转化率为40% D.若混合气体的压强不变,则表明该反应已达到平衡状态
10.采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如右图所示。则下列符合题意的是( )
A. B点的速率比C点的大
B. A、B、C三点的平衡常数KA、KB、KC的大小关系为:KA=KB>KC
C. 若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为5L
D. 若增大H2的浓度 , ,则CO 和H2的平衡转化率(α)均会增大
11.相同体积的pH均为3的强酸和弱酸溶液分别跟等质量的镁充分反应,下列说法错误的是( )
A.刚开始时两种溶液中产生H 2 的速率相同
B.若有一种溶液中镁有剩余,则有剩余的是强酸溶液
C.若两种溶液中镁均无剩余,则两者产生等量的氢气
D.若两种溶液中镁均有剩余,则两者产生等量的氢气
12.为了探究外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y物质的量比为a∶b
- 10 -
开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。以下判断正确的是( )
A.ΔH<0,a+b>c
B.ΔH>0,a+b
0,a+b>c
D.ΔH<0,a+b c(NH4+) > c(Na+) >c(OH-)>c(H+)
16.下列实验能达到预期目的的是 ( )
编号
实验内容
实验目的
A
室温下,用pH试纸分别测定浓度为0.1molL -1 NaClO溶液和
0.1molL -1 CH3COONa溶液的pH
比较HClO和CH3 COOH的酸性强弱
B
向含有酚酞的Na2CO3 溶液中加入少量BaC12 固体,溶液红色变浅
证明Na2CO3 溶液中存在水解平衡
C
向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2 溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3 溶液,又生成红褐色沉淀
证明在相同温度下的
Ksp:Mg(OH)2>Fe(OH)3
D
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大
证明非金属性S>C
17. 已知25℃时,电离常数K a (HF)=3.6×10 -4 ,溶度积常数K sp (CaF 2 )=1.46×10 -10 。现向1 L 0.2molL -1 HF溶液中加入1 L 0.2 molL -1 CaCl 2 溶液,则下列说法中,正确的是( )
A.25℃时,0.1 molL -1 HF溶液中pH=1
B.K sp (CaF 2 )随温度和浓度的变化而变化
C.该体系中有CaF 2 沉淀产生
D.加入CaCl 2 溶液后体系中的c(H + )浓度不变
18.常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-) - n(H+) = (a -0.05)mol
C.随着NaOH的加入,不断增大
D.当n(NaOH)=0.1mol时,c(OH-)>c(Cl-) - c(NH3•H2O)
二.非选择题(本题包括5小题,共54分)
19.(14分)按要求完成下列各小题:
- 10 -
(1) 纯碱去油污的原理(用离子方程式表示) ;
(2)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(3)现有PH值相同的两种溶液:HCl和NH4Cl,甲同学想知道具体的PH值,但手上只有一张用蒸馏水润湿过的PH试纸,那么他应该用该试纸测 溶液的PH值才会更准确;
用PH试纸正确测PH值的操作方法是 。
(4)已知某溶液中存在OH-、H+、NH、Cl- 四种离子,某同学推测其离子浓度大小顺序有如下四种关系:A. cC(Cl-)>C(NH)>C(H+)> C(OH-) B.cC(Cl-)>C(NH)>C(OH-)>C(H+)
C.cC(NH)>C(Cl-)>C(OH-)>C(H+) D.cC(Cl-)> C(H+)>C(NH)>C(OH-)
填写下列空白:
①若溶液中只溶解了一种溶质,则上述四种离子浓度的大小顺序为 (填序号)。
②若上述关系中D是正确的,则溶液中的溶质为 ;
③若该溶液是由体积相等的稀盐酸和氨水混合而成,且呈中性,则混合前
C(HCl) C (NH3·H2O)(填“大于”、“小于”或“等于”)。
20.(10分)为了测定血液中钙的含量,某小组设计了实验方案,步骤如下:
a.将2mL的血液用蒸馏水稀释至100ml,用25mL滴定管移取25.00ml至锥形瓶中
b.在锥形瓶中加入过量的草酸铵晶体(NH4)2C2O4,生成CaC2O4沉淀
c.过滤出的CaC2O4用硫酸处理使其转化成草酸(H2C2O4)
d.利用H2SO4酸化后浓度为1.0×10-4mol/L的KMnO4溶液滴定上述的草酸(H2C2O4)溶液。氧化产物为CO2,还原产物为Mn2+
(1)请写出酸化后的KMnO4滴定H2C2O4溶液的化学方程式
(2)判断滴定终点的方法是
(3)利用酸化后的KMnO4溶液滴定草酸(H2C2O4)溶液,正确的操作顺序是
①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
A.③⑥①②④⑤ B.⑤①②⑥④③ C.③⑥①②④ D.③①②④⑥
(4)若装KMnO4溶液的滴定管只用水洗涤,则所测结果 (填“偏高”、“偏低”或“无影响”)。
(5)滴定消耗的标准液KMnO4的体积数据记录:
- 10 -
滴定次数
滴定前刻度(ml)
滴定后刻度(ml)
第一次
0.10
20.12
第二次
0.30
22.40
第三次
0
19.98
计算,血液中含钙的浓度为 g/L。
21.(11分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应
大气固氮
N2 (g)+O2 (g)2NO(g)
工业固氮
N2 (g)+3H2 (g)2NH3(g)
温度/℃
27
2000
25
400
450
K
3.84×10-31
0.1
5×108
0.507
0.152
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因 。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系 。
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,正极的电极反应式是 。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)4NH3(g)+3O2(g),则其反应热ΔH=___________________。
已知:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ·mol-1
- 10 -
2H2(g) +O2(g)2H2O(l) △H=-571.6kJ·mol-1
22. (10分)25 ℃时,电离平衡常数 CH3 COOH :1.8×10-5 H2 CO3 : K1 :4.3×10-7
K2 :5.6×10-11 HClO: 3.0×10-8 回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是_____________;(填编号,下同)
a.CO3 2- b.ClO- c.CH3 COO- d.HCO3 -
(2)下列反应不能发生的是: ;
a.CO3 2- + CH3 COOH=CH3 COO- + CO2↑+H 2 O b.ClO- +CH3 COOH=CH3 COO-+HClO
c.CO3 2- + HClO=CO2↑+H2 O + ClO - d.2 ClO- + CO2 +H2 O=CO3 2- +2 HClO
(3)用蒸馏水稀释0.10 molL -1 的醋酸,则下列各式表示的数值随水量的增加而增大的是_________;
A.c(CH 3 COOH)/c(H + ) B.c(CH 3 COO - )/c(CH 3 COOH)
C.c(H + )/ K W D.c(H + )/c(OH - )
(4常温下某溶液中由水电离出的氢离子浓度为10-9mol/L,则溶液的PH值可能为 .
(5)在浓度均为0.1 mol/L的Cl- 和 I-混合溶液中,已知KSP(AgCl)= 1.6×10-10
KSP(AgI)= 1.5×10-16 。若向混合溶液中逐滴加入AgNO3 溶液并充分搅拌时,当AgCl沉淀开始析出时,溶液中Ag+ 的浓度是_____________.
23.(9分)钡盐生产中排出大量的钡泥[主要含BaCO 3 、BaSO 3 、Ba(FeO 2 )2 等],某主要生产BaCO 3 的化工厂利用钡泥制取Ba(NO 3 )2 晶体及其他副产物,其部分工艺流程如下:
已知:① Fe(OH)3 和Fe(OH)2 完全沉淀时,溶液pH分别为3.2和9.7。②Ba(NO3 )2 在热水中溶解度大于冷水中溶解度。③K SP (BaSO 4 )=1.1×10 -10 ,K SP (BaCO 3 )=5.1×10 -9 。
(1)该厂生产的BaCO 3 因含有少量BaSO 4 而不纯,提纯的方法是:将产品加入足量的饱和Na 2 CO3 溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO 2)2 与HNO 3 反应生成两种硝酸盐,化学方程式为: 。
(3)废渣2为 (写出化学式)。该厂结合本厂实际,选用的X为
- 10 -
(从下列选项中选择);① BaCl 2 ②Ba(NO 3 )2 ③BaCO 3 ④Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO 3 )2 的纯度为 。
- 10 -
莆田六中2019学年高二上学期期末化学试卷(A)参考答案
一、选择题(本题包括18小题,1-8每小题2分,9-18每小题3分,共46分。每小题只有一个选项符合题意)
1-5:DBCDA 6-10:ACCBB 11-15:DADBD 16-18:BCC
二.非选择题(本题包括5小题,共54分)
19.(共14分)
(1) CO32-+H2OHCO3-+OH-(2分)
(2)Al3+ + 3HCO3-Al(OH)3↓+3 CO2↑(2分)
(3) NH4Cl (2分);把PH试纸放在洁净的玻璃片或表面皿上,用玻璃棒沾取待测液点在PH试纸的中部,然后跟标准比色卡对照,读出PH值(2分)。
(4)①A;(2分)②NH4Cl和HCl;(2分)③小于(2分)
20.(10分)
(1)3 H2SO4+ 2KMnO4+5H2C2O4 10CO2↑+2MnSO4+ K2SO4+8H2O (2分)
(2)溶液从无色变紫红色,且半分钟内不褪色(2分)
(3) C (2分) (4) 偏高(2分)
(5) 0.4 g/L (2分)
21(11分)
(1)①吸热(1分)
②K值小,正向进行的程度小(或转化率低),不适合大规模生产;(2分)
③从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适;(2分)
(2)A(1分);р2>р1;(1分)
(3)N2+6e-+6H+=2NH3;(2分)
(4)+1530 kJ·mol-1(2分)
22. (10分)(1)a、b、d、c (2分)
(2)c、d (2分)
(3)B(2分)
(4)9或5(2分)
(5)1.6×10 - 9 mol/L (2分)
- 10 -
23.(9分)(1)BaSO4 (s)+CO3 2- (aq)BaCO3 (s)+SO4 2- (aq) (2分)
(2)Ba(FeO2 )2 +8HNO3 = Ba(NO3 )2 +2Fe(NO3 )3 +4H2 O; (2分)
(3)Fe(OH)3 (1分);③ (1分);(4)c (1分)
(5) ×100% (2分)
- 10 -