2018-2019学年宁夏银川一中高二下学期期末考试化学试题 Word版
银川一中 2018/2019 学年度(下)高二期末考试
化 学 试 卷
命题人:
(考试时间:120 分钟 满分:100 分)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Si—28 Cl—35.5 Fe—56
Cu—64
一、选择题(每题只有一个正确答案,25 题,共 50 分)
1. 下列说法正确的是
A.道尔顿、汤姆生、卢瑟福和门捷列夫对原子结构模型的建立作出了卓越的贡献
B.3f 能级中最多可容纳 14 个电子
C.若将 15P 原子的电子排布式写成 1s22s22p63s23px23py1,它违背了洪特规则
D.s 轨道的电子云形状为圆形的面,若 2s 的电子云半径比 1s 电子云半径大说明 2s 能级的
电子比 1s 的多
2. 下列有关化学用语使用正确的是
A. 基态碳原子的价电子轨道表示式为 ↑↓ ↑↑
B. NH4Cl 的电子式:
C. Br 原子的基态简化电子排布式为 4s24p5
D. 石英的分子式:SiO2
3. 下列说法正确的是
A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B.最外层电子数为 ns2 的元素都在元素周期表第 2 列
C.处于最低能量的原子叫做基态原子,1s22s22p1x―→1s22s22p 1y过程中形成的是发射光谱
D.已知某元素+3 价离子的电子排布式为 1s22s22p63s23p63d5,该元素位于周期表中的第四周
期第 VIII 族位置,属于 ds 区
4.下列现象与氢键有关的是
①NH3 的熔、沸点比第ⅤA 族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小 ④尿素的熔、沸点比乙醛的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
2s 2p
5.关于乙炔分子中的共价键说法正确的是
A.sp 杂化轨道形成 σ 键属于极性键,未杂化的 2p 轨道形成 π 键属于非极性键
B.C—H 之间是 sps 形成 σ 键,与 sp σ 键的对称性不同
C.(CN)2 与乙炔都属于直线型分子,所以(CN)2 分子中含有 3 个 σ 键和 2 个 π 键
D.由于 π 键的键能比 σ 键的键能小,乙炔分子 C===C 双键的键能小于 C—C 单键的键能
的 2 倍,所以乙炔化学性质活泼易于发生加成反应
6. 下列各组晶体物质中,化学键类型相同,晶体类型也相同的是
①刚玉(Al2O3)和 TNT ②石墨和生铁 ③BF3 和 SF6 ④金刚砂和 BN
⑤AlCl3 和 NH4H ⑥CS2 和 HCHO
A.①②③ B.③④⑥ C.④⑤⑥ D.①③⑤
7.下列化合物中含 3 个“手性碳原子”的是
A.OHC—CH—CH2OH B.OHC—CH—C—Cl
C. HOOC—CH—C—C—Cl D.CH3—CH—C-CH3
8. 下列有关微粒间作用力的说法正确的是
A.硼酸[B(OH)3]晶体具有与石墨相似的层状结构, 则分子中 B 原子发生的是 sp2 杂化,不
同层分子间主要作用力是范德华力
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类
似也有方向性和饱和性
C.干冰气化和冰融化克服的分子间作用力相同
D. 离子晶体熔融状态电离过程中,只有离子键被破坏
9.下列有关说法不正确的是
A.CH4、SF6、二氯乙烯(反式)、H2O2 都是含极性键的非极性分子
B.在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
C.酸性:H2CO3
SnCl2> SO3> NH3> CCl4
D.BeF2 分子中,中心原子 Be 的价层电子对数等于 2,其空间排布为直线,成键电子对
数等于 2,没有孤对电子
11.下列关于杂化轨道的叙述中不正确的是
A.分子中心原子通过 sp3 杂化轨道成键时该分子不一定为正四面体结构,所以杂化轨道理
•••
•••
论与 VSEPR 模型分析分子的空间构型结果常常相互矛盾
B.杂化轨道用于形成 σ 键或用于容纳未参与成键的孤电子对
C. SF2 和 C2H6 分子中的中心原子 S 和 C 都是通过 sp3 杂化轨道成键
D.苯分子中所有碳原子均采取 sp2 杂化成键,苯环中存在 6 个碳原子共有的大 π 键
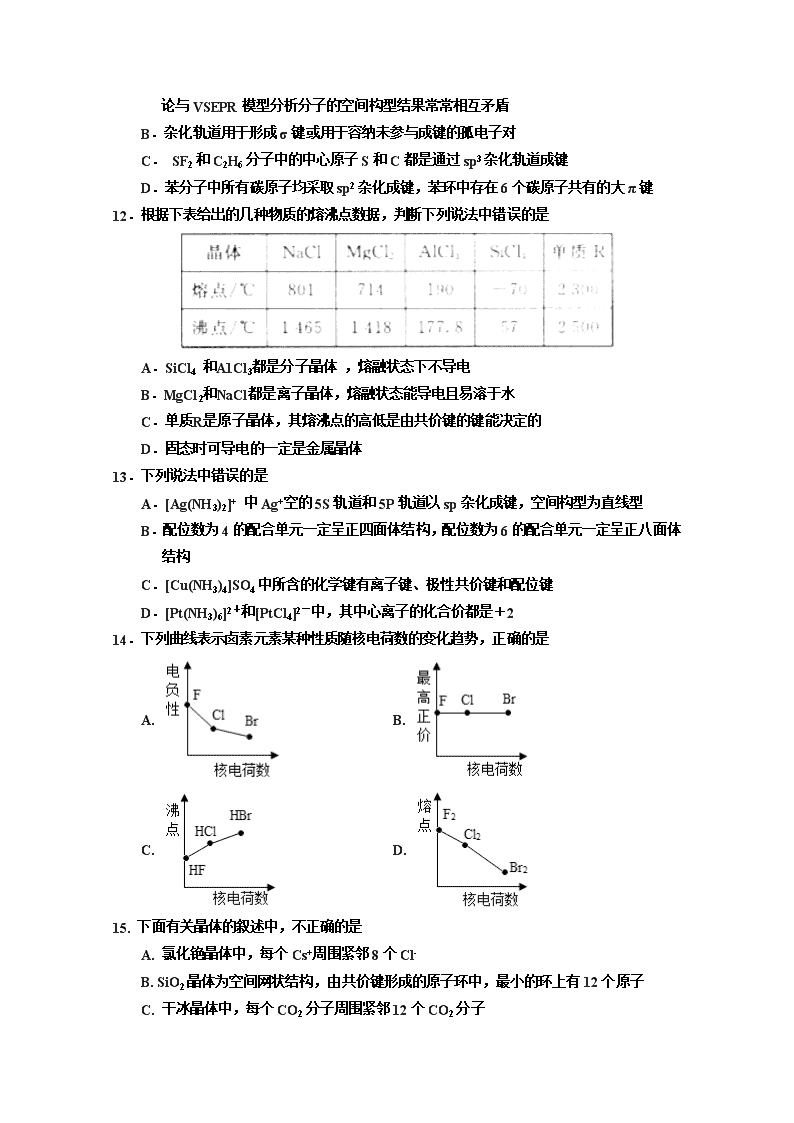
12.根据下表给出的几种物质的熔沸点数据,判断下列说法中错误的是
A.SiCl4 和A1Cl3都是分子晶体 ,熔融状态下不导电
B.MgCl2和NaCl都是离子晶体,熔融状态能导电且易溶于水
C.单质R是原子晶体,其熔沸点的高低是由共价键的键能决定的
D.固态时可导电的一定是金属晶体
13.下列说法中错误的是
A.[Ag(NH3)2]+ 中 Ag+空的 5S 轨道和 5P 轨道以 sp 杂化成键,空间构型为直线型
B.配位数为 4 的配合单元一定呈正四面体结构,配位数为 6 的配合单元一定呈正八面体
结构
C.[Cu(NH3)4]SO4 中所含的化学键有离子键、极性共价键和配位键
D.[Pt(NH3)6]2+和[PtCl4]2-中,其中心离子的化合价都是+2
14.下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是
A. B.
C. D.
15. 下面有关晶体的叙述中,不正确的是
A. 氯化铯晶体中,每个 Cs+周围紧邻 8 个 Cl-
B. SiO2 晶体为空间网状结构,由共价键形成的原子环中,最小的环上有 12 个原子
C. 干冰晶体中,每个 CO2 分子周围紧邻 12 个 CO2 分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
16. 下列有关性质的比较中,正确的是
A. 硬度:白磷>冰>二氧化硅 ; 在水中的溶解度:NH3> CO2> SO2 >H2
B. 非金属性:N>O>P>S; 碱性:KOH>NaOH>Al(OH)3>Ca(OH)2
C. 共价键的键能:硅>碳化硅>金刚石; 晶格能:CsCl >NaCl> CaO
D. 氢键强弱:N···H<O···H<F···H; 范德华力强弱:NH3< PH3< AsH3
17. 下表列出了某短周期元素 R 的各级电离能数据(用 I1、I2 表示,单位为 kJ·mol-1)
I1 I2 I3 I4 …
R 740 1500 7700 10500 …
下列关于元素 R 的判断中一定正确的是
A.R 元素的原子最外层共有 4 个电子 B.R 的最高正价为+3 价
C.R 元素位于元素周期表中第ⅡA 族 D.R 元素基态原子的电子排布式为 1s22s2
18.下列各物质中,按熔点由高到低的顺序排列正确的是
A.石墨>金刚石>SiO2 B. KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li D.CH4>SiH4>GeH4>SnH4
19. 现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;
③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是
A. 第一电离能: ④>③>②>① B. 原子半径:③>④>②>①
C. 最高正化合价:③>④=②>① D. 电负性: ④>③>②>①
20. 四种短周期元素 W、X、Y、Z 的原子序数依次增大。其原子的最外层电子数之和为 19,
W 和 X 元素原子内质子数之比为 1:2,X2+和 Z-的电子数之差为 8。下列说法不正确的是
A. WZ4 分子中 W、Z 原子通过共价键结合且最外层均达到 8 电子结构
B. 离子半径从大到小的顺序是 Y、Z 、X
C. W、Y、Z 元素最高价氧化物对应的水化物中酸性最强的是元素 Z
D. W 与 Y 通过离子键形成离子化合物
21.如图,铁有 δ、γ、α 三种同素
异形体,三种晶体在不同温度
下能发生转化。下列说法不正
确的是 δFe γFe αFe
A.δFe 晶胞中含有 2 个铁原子,每个铁原子等距离且最近的铁原子有 8 个
B.晶体的空间利用率: δFe > γFe> αFe
C.设 γFe 晶胞中铁原子的半径为 d, 则 γFe 晶胞的体积是 16 2d 3
D.已知铁的相对原子质量为 a,阿伏加德罗常数为 NA(mol-1),δFe 晶胞的密度
为 g/cm3,则铁原子的半径 r(cm)= 3
4
· 3 2a
NAρ
22.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部
分为 0 价,部分为-2 价,如图所示为超氧化钾晶体的一个
晶胞,则下列说法正确的是
A.超氧化钾的化学式为 KO2,每个晶胞含有 4 个 K+和 4 个 O-2
B.晶体中每个 K+周围有 8 个 O-2 ,每个 O -2 周围有 8 个 K+
C.晶体中与每个 K+距离最近的 K+有 8 个,晶体中与每个 O -2 距离最近的 O -2 有 6 个
D.晶体中其中 0 价氧和-2 价氧的物质的量之比为 1:1
23.以 NA 表示阿伏加德罗常数的值,下列说法正确的是
A.36g 冰(图甲)中含共价键数目为 4NA
B.12g 金刚石(图乙)中含有 σ 键数目为 4NA
C.44g 干冰(图丙)中含有 NA 个晶胞结构单元
D.12g 石墨(图丁)中含 π 键数目为 3NA
24.通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示下列关
于这些晶体结构和性质的叙述不正确的是
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结
构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个 Si 原子形成 4 个 Si-O 共价单键
25.氮化钠和氢化钠都是离子化合物,有关它们的叙述
①原子半径:rNa>rN>rH ②离子半径:
ρ
③与水反应都是氧化﹣还原反应 ④水溶液都显碱性
⑤与盐酸反应都只生成 NaCl
⑥氢化钠晶体结构与氯化钠晶体相同,与钠离子距离最近的钠离子共有 12 个
其中正确的是
A.全都正确 B.①④⑥ C.①④⑤ D.②③⑤
二、填空题(每空 1 分或 2 分,共 50 分)
26. (10 分,每空 1 分)完成下列填空。
(1) 原子序数为 24 的元素基态原子核外有________个未成对电子,电子占据的最高能层
符号为________,该能层具有的原子轨道数为________
(2)B 元素基态原子中能量最高的电子其电子云在空间有_______个伸展方向,原子核外有
个运动状态不同的电子。
(3)在下列物质中:①NH3 ②I2 ③CH4 ④Na2O2 ⑤H2O2 ⑥CO2 ⑦NaOH ⑧CH3COONH4,
既存在非极性键又存在极性键的极性分子是__________;既存在 σ 键又存在 π 键的非极性分
子是________,既存在 σ 键又存在 π 键的离子晶体是________
(4)1molNH4BF4 含有 mol 配位键, 1mol [Zn(CN)4]2-中含有 σ 键的数目
为 .
27. (14 分,每空 2 分)如图是元素周期表的一部分:
(1)表中属于 S 区的非金属元素是________(用元素符号表示),元素⑩核外电子排布式为
________________,
(2)元素③④⑤电负性由小到大 (用元素符号表示)
(3)若元素③用 R 表示,为什么可以形成 RCl3 分子,不可以形成 RCl5 分子:
_______________ ___。
(4)元素⑤ 与⑧ 元素相比非金属性较强的是________(写元素名称),下列表述中能证明这
一事实的是__________。
A.气态氢化物的挥发性和稳定性 B.两元素的电负性
C.单质分子中的键能 D.含氧酸的酸性
E.氢化物中 X—H 键的键长 F.两单质在自然界中的存在形式
(5) 元 素 ⑦ 的 氧 化 物 与 元 素 ⑧ 的 最 高 价 氧 化 物 的 水 化 物 反 应 的 离 子 方 程 式 为
______________________。
28.(10 分,每空 1 或 2 分)
现有 X、Y、Z、T 四种短周期元素,原子序数依次增大。请根据下列相关信息,回答问
题。
元素 相关信息
X 原子的 1s 轨道上只有 1 个电子
Y 原子的 L 层上 s 电子数等于 p 电子数
Z 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的
T 负二价的元素 T 的氢化物在通常情况下是一种液体,且 T 的质量分数为 88.9%
(1) Z2X4 分子中 Z 原子采取________杂化,写出与之互为等电子体的有机物的结构简式
________.
(2) Cl2T 分子的空间构型 , Z2T 的电子式 .
(3) 请用价层电子对互斥理论解释 ZX -2 和 ZX3 的键角∠XZX 的大小:_____________
____________________________________________________________________________.
(4) Y 晶体的晶胞如图所示,该晶胞含有 个 Y 原子,
若晶胞的密度为 d g·cm-3,阿伏加德罗常数的值为 NA(mol-1),则
晶胞参数为 a= pm。(用含 d 、NA 的式子
表示)
29. (16 分,每空 2 分)
明代宋应星 《天工开物·铜》写到:“凡铜供世用,出山与出炉,止有赤铜。以炉甘石或
倭铅参和,转色为黄铜;以砒霜等药制炼为白铜;矾、硝等药制炼为青铜;广锡参和为响铜;
倭铅和写﹝泻﹞为铸铜。初质则一味红铜而已。”回答下列问题:
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子
的第三能层的能级全部排满,其原子外围电子的轨道表示式:________________________
(2) 在 CuSO4 溶 液 中 加 过 量 氨 水 后 再 向 该 溶 液 中 加 入 一 定 量 乙 醇 会 析 出
[Cu(NH3)4]SO4·H2O , 写 出 此 过 程 中 蓝 色 絮 状 沉 淀 滴 加 过 量 氨 水 的 离 子 反 应 方 程
式 ,[Cu(NH3)4]SO4·H2O 中与 Cu2+形成配位键
的原子是________(填元素符号),若要确定[Cu(NH3)4]SO4·H2O 是晶体还是非晶体,最科学的
方法是对其进行_______________________实验。
(3)含有钡元素的盐的焰色反应为_______色,许多金属盐都可以发生焰色反应,其原因是
______________________
(4)黄铜矿是主要的炼铜原料,CuFeS2 是其中铜的主要存在
形式。四方晶系 CuFeS2 晶胞结构如图所示。
①Cu+的配位数为__________,
②已知:底边 a=b=0.524 nm,高 c=1.032 nm,NA 为阿伏
加德罗常数的值,CuFeS2 晶体的密度是_______ _g•cm3
(列出计算表达式即可)。
高二期末化学试卷参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 C A A B D B C D A D A D B
题号 14 15 16 17 18 19 20 21 22 23 24 25
答案 A D D C A A D B A A B B
26. (1)6 N 16 (2)3 5 (3) ⑤ ⑥ ⑧ (4)2 8NA
27.(1)H 1s22s22p63s23p63d64s2 或[Ar]3d64s2
(2) N
查看更多