2018-2019学年广东省佛山市三水区实验中学高二上学期第五学段考试化学试题 Word版
2018-2019学年三水实验中学高二第二次月考
化学理科试题
一、单选题(20小题,共40分)
1. 未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且可以再生.下列最有希望的新能源是( )①天然气 ②煤 ③石油 ④太阳能 ⑤氢能.
A. ①③⑤ B. ②③④ C. ①④⑤ D. ④⑤
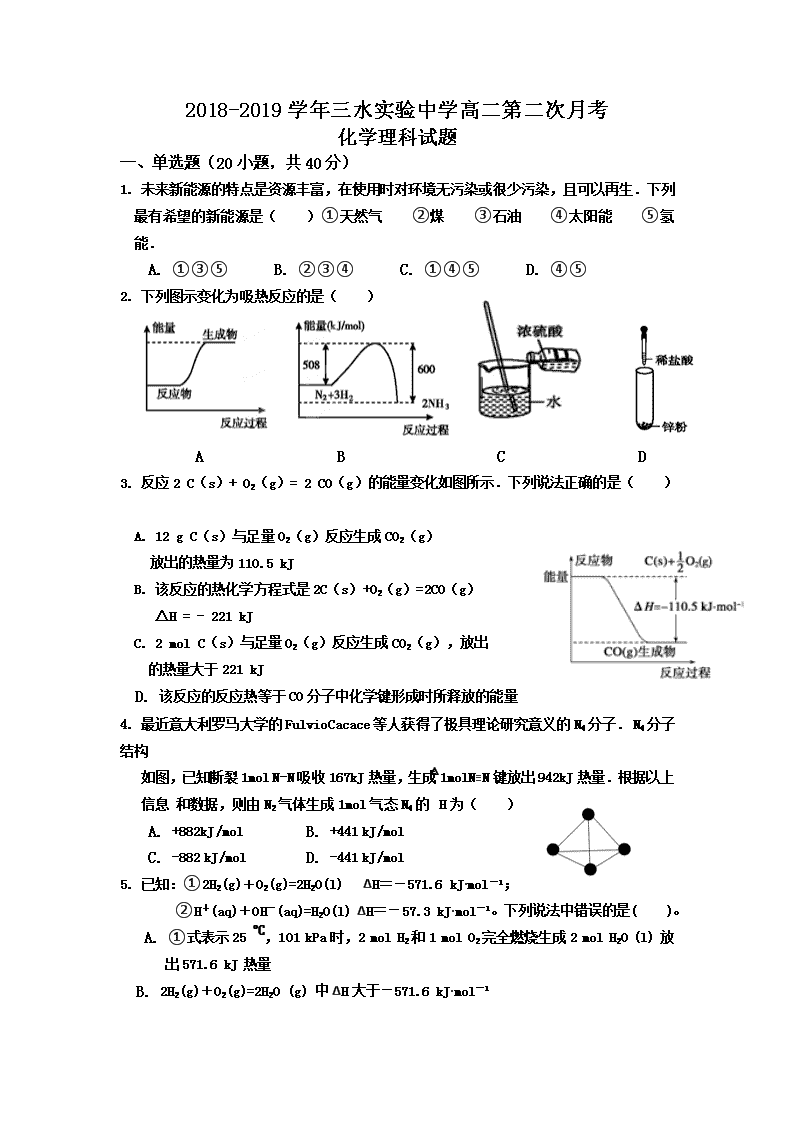
2. 下列图示变化为吸热反应的是( )
A B C D
3. 反应2 C(s)+ O2(g)= 2 CO(g)的能量变化如图所示.下列说法正确的是( )
A. 12 g C(s)与足量O2(g)反应生成CO2(g)
放出的热量为110.5 kJ
B. 该反应的热化学方程式是2C(s)+O2(g)=2CO(g)
△H = - 221 kJ
C. 2 mol C(s)与足量O2(g)反应生成CO2(g),放出
的热量大于221 kJ
D. 该反应的反应热等于CO分子中化学键形成时所释放的能量
的总能量与O2分子中化学键断裂时所吸收的总能量的差
4. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子. N4分子结构
如图,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N键放出942kJ热量.根据以上信息 和数据,则由N2气体生成1mol气态N4的△H为( )
A. +882kJ/mol B. +441 kJ/mol
C. -882 kJ/mol D. -441 kJ/mol
5. 已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。下列说法中错误的是( )。
A. ①式表示25 ℃,101 kPa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O (l) 放
出571.6 kJ热量
B. 2H2(g)+O2(g)=2H2O (g) 中ΔH大于-571.6 kJ·mol-1
C. 将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ
D. 将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ
6. 对于300mL 1mol•L-1盐酸与铁片反应制氢气,采取下列措施:
①升高温度 ②改用100mL 3mol•L-1盐酸 ③再加300mL 1mol•L-1盐酸 ④用等量铁粉代替铁片 ⑤改用100mL 98%的硫酸
其中能使反应速率加快的是( )
A. ①②④ B. ①③④ C. ①②③④ D. ①②③⑤
7. t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓
度如下表:
物质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
2 min末浓度/(mol·L-1)
0.08
a
b
平衡浓度/(mol·L-1)
0.05
0.05
0.1
下列说法正确的是( )
A. 平衡时,X的转化率为20%
B. 2 min时Y的物质的量为0.14 mol
C. 增大平衡后的体系压强,v(正)增大,v(逆)减小
D. 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L―1·min―1
8.下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH的浓度增大
B.使用催化剂可加快SO2转化为SO3的速率
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨工业中不断从反应混合物中液化分离出氨气
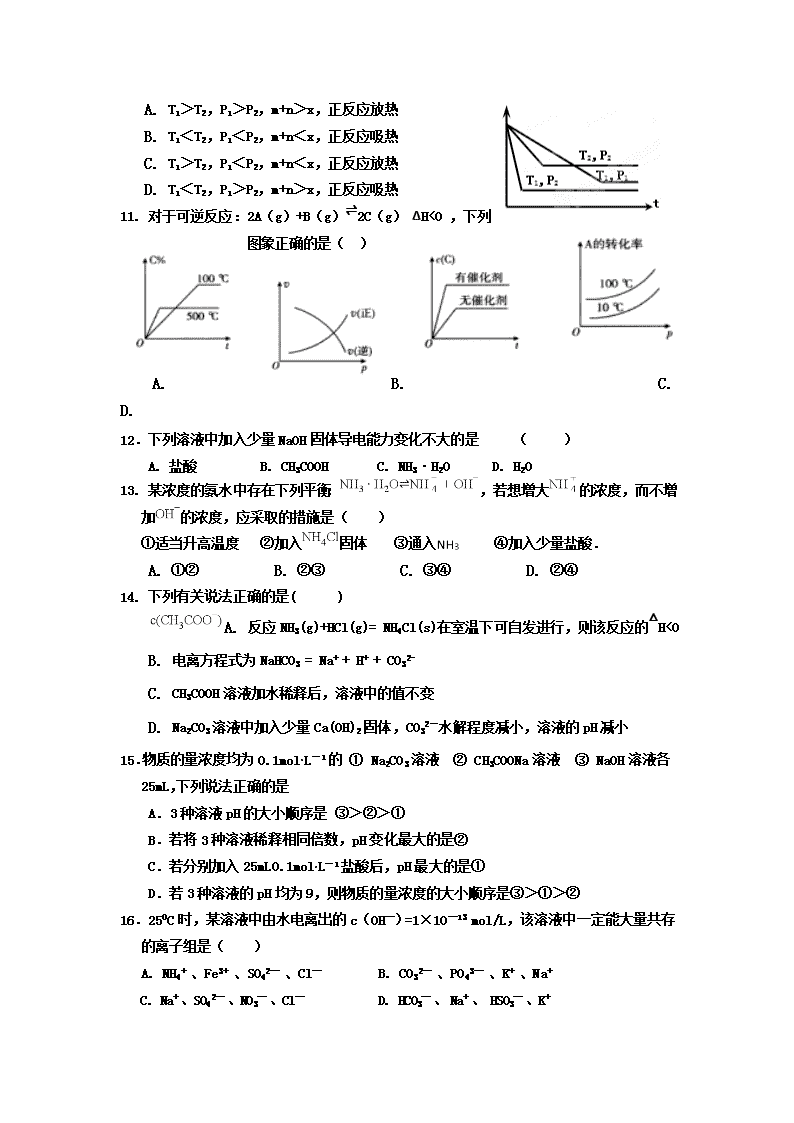
9.反应:xA(气)+yB(气) zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A.x+y
”“=”或“<”,下同)。
22. (13分)
在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:
N2O4 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s
n/mol
0
20
40
60
80
100
n(N2O4)
0.40
0.28
0.20
0.14
0.10
0.10
n(NO2)
0.00
0.24
b
0.52
0.60
0.60
(1 ) 计算20~40 s内用N2O4表示的平均反应速率为______________________。
(2)40s时,NO2的的浓度b= __ mol/L,反应最迟到 s到达平衡状态
(3) 反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4) 要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A . 2 v(N2O4 ) =v(NO2 ) B . 容器内压强保持不变
C . 容器内密度保持不变 D. NO2的体积分数保持不变
(6) 如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线。
23.(10
分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1) 配制100mL 0.1000mol/L NaOH标准溶液。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号
NaOH溶液的浓度
(mol/L)
滴定完成时,NaOH溶液滴入的体积(mL)
待测盐酸溶液的体积
(mL)
1
0.1000
30.05
20.00
2
0.1000
29.95
20.00
3
0.1000
28.20
20.00
①滴定达到终点的判断是
此时锥形瓶内溶液的pH为 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留四位有效数字)
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液
甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有
A、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
B、锥形瓶水洗后未干燥
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、配制NaOH标准溶液时,移液后未洗涤烧杯和玻璃棒
E、碱式滴定管尖嘴部分有气泡,滴定后消失
24、(14分)
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号
HA物质的量浓度(mol·L-1)
NaOH物质的量浓度(mol·L-1)
混合溶液的pH
甲
0.2
0.2
pH=a
乙
c
0.2
pH=7
丙
0.2
0.1
pH>7
丁
0.1
0.1
pH=9
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2________ (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
混合溶液中c(OH-)-c(HA)=________mol·L
25. (12分)
碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) CO(g) +H2(g) ΔH = +131.3 kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+ CO2(g) 2CO(g) △H = +172.5kJ•mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g) 的△H = 。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
t / min
2
4
7
9
n(H2O)/mol
0.12
0.11
0.10
0.10
① 其它条件不变,降低温度,达到新平衡前v(逆)____v(正)(填“>”、“<”或“=”) 。
② 该温度下,此反应的平衡常数K=______ _____;
(4)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
Ⅰ:CO(g)+2H2(g) CH3OH(g)ΔH1
Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
Ⅲ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
则ΔH1_____ΔH3(填“>”、“<”、“=”),
理由是:_____________________________________________________________________________。
2018-2019学年三水实验中学高二第二次月考
化学理科试题答案
一、单选题(20小题,共40分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
A
C
A
C
A
D
B
D
C
题号
11
12
13
14
15
16
17
18
19
20
答案
A
A
D
A
C
C
D
D
B
D
二、填空题(5小题,共60分)
21.(11分)
(1)⑥<①<⑧<⑤<⑦<④<③<②
(2) ① 酸, Fe3++3H2O Fe(OH)3+3H+,
② 将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,
③ Fe2O3 (3)<
22. (13分)
(1) 0.0020 mol·L-1·s-1 (2) 0.20 mol·L-1 80s
(3) 变浅 (4)D (5)BD
(6) 如下图:
23.(10分)
(2) ①滴入最后一滴NaOH标准溶液,锥形瓶中溶液由无色变成浅红色,且30S不褪色。
8.2~10.0
② 0.1500 mol·L-1 ③ 丙 ④ CD
24、(14分)
(1)若a=7,则HA是强酸;若a>7, 则HA是弱酸 (2)否 c(A-)=c(Na+)
(3)弱 c(Na+) >c(A-) > c(OH-) > c(H+) (4)10-5 10-9
25. (12分)
(1)BC (2)- 41.2 kJ•mol-1 (3)① < ; ② K= 0.36
(4)<;由图可知,随着温度升高,K2增大,则ΔH2>0,根据盖斯定律又得ΔH3=ΔH1+ΔH2,
所以ΔH1<ΔH3