- 2021-08-06 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河北省邯郸大名一中高二6月月考化学试题 Word版
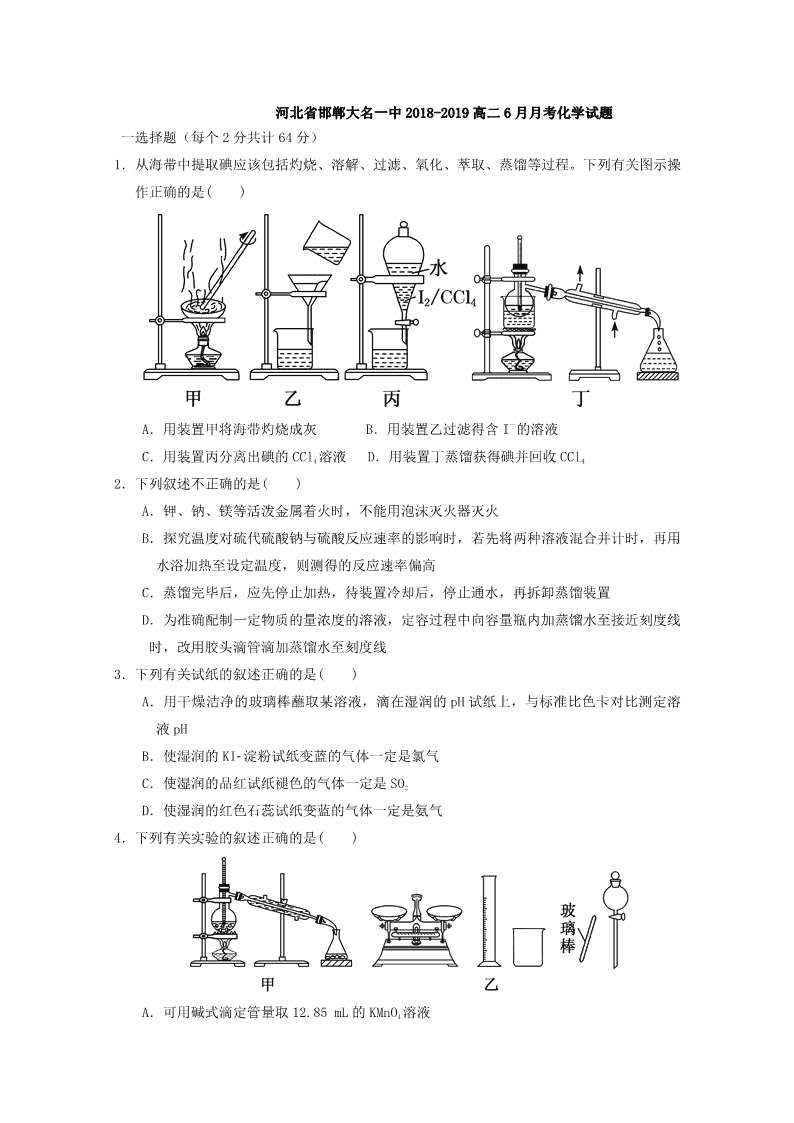
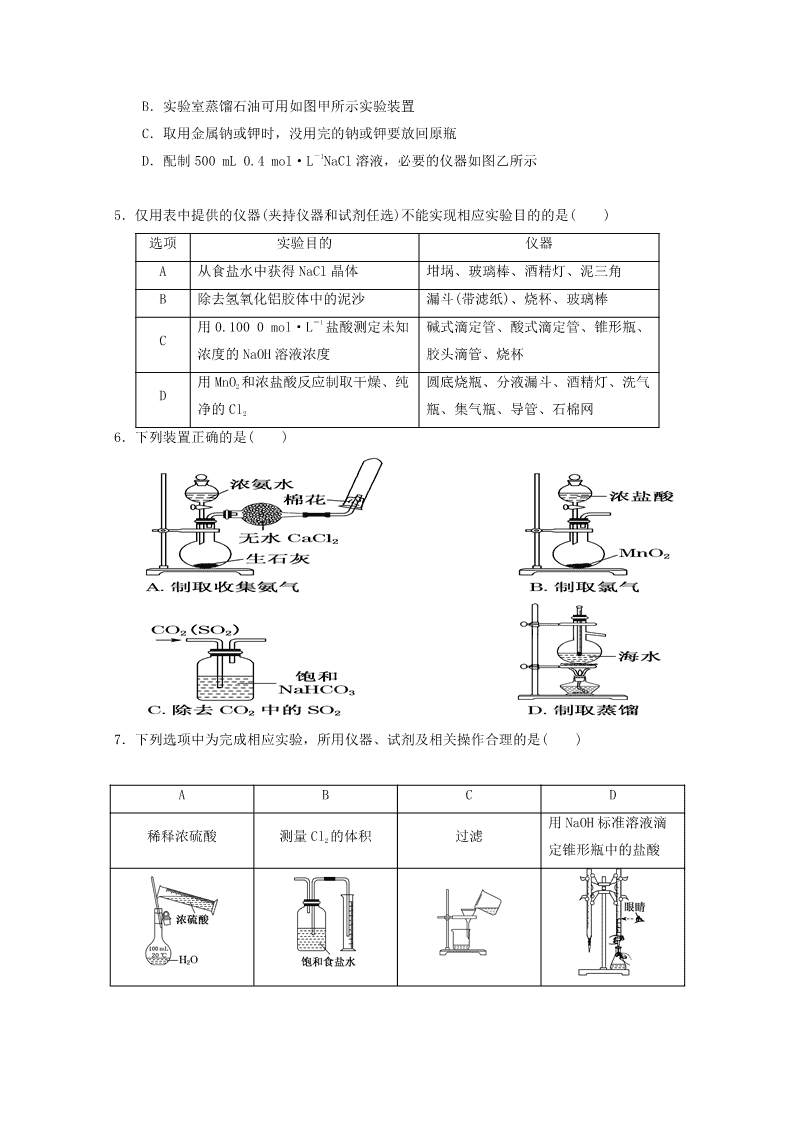
河北省邯郸大名一中 2018-2019 高二 6 月月考化学试题 一选择题(每个 2 分共计 64 分) 1.从海带中提取碘应该包括灼烧、溶解、过滤、氧化、萃取、蒸馏等过程。下列有关图示操 作正确的是( ) A.用装置甲将海带灼烧成灰 B.用装置乙过滤得含 I-的溶液 C.用装置丙分离出碘的 CCl4 溶液 D.用装置丁蒸馏获得碘并回收 CCl4 2.下列叙述不正确的是( ) A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用 水浴加热至设定温度,则测得的反应速率偏高 C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线 时,改用胶头滴管滴加蒸馏水至刻度线 3.下列有关试纸的叙述正确的是( ) A.用干燥洁净的玻璃棒蘸取某溶液,滴在湿润的 pH 试纸上,与标准比色卡对比测定溶 液 pH B.使湿润的 KI淀粉试纸变蓝的气体一定是氯气 C.使湿润的品红试纸褪色的气体一定是 SO2 D.使湿润的红色石蕊试纸变蓝的气体一定是氨气 4.下列有关实验的叙述正确的是( ) A.可用碱式滴定管量取 12.85 mL 的 KMnO4 溶液 B.实验室蒸馏石油可用如图甲所示实验装置 C.取用金属钠或钾时,没用完的钠或钾要放回原瓶 D.配制 500 mL 0.4 mol·L-1NaCl 溶液,必要的仪器如图乙所示 5.仅用表中提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的的是( ) 选项 实验目的 仪器 A 从食盐水中获得 NaCl 晶体 坩埚、玻璃棒、酒精灯、泥三角 B 除去氢氧化铝胶体中的泥沙 漏斗(带滤纸)、烧杯、玻璃棒 C 用 0.100 0 mol·L-1 盐酸测定未知 浓度的 NaOH 溶液浓度 碱式滴定管、酸式滴定管、锥形瓶、 胶头滴管、烧杯 D 用 MnO2 和浓盐酸反应制取干燥、纯 净的 Cl2 圆底烧瓶、分液漏斗、酒精灯、洗气 瓶、集气瓶、导管、石棉网 6.下列装置正确的是( ) 7.下列选项中为完成相应实验,所用仪器、试剂及相关操作合理的是( ) A B C D 稀释浓硫酸 测量 Cl2 的体积 过滤 用 NaOH 标准溶液滴 定锥形瓶中的盐酸 8.下是 Fe2+、Fe3+、Zn2+被 OH-完全沉淀时溶液的 pH。某硫酸锌酸性溶液中含有少量 Fe2+、 Fe3+杂质,为制得纯净的 ZnSO4,应加入的试剂是( ) 金属离子 Fe2+ Fe3+ Zn2+ 完全沉淀时的 pH 7.7 4.5 6.5 A.H2O2、Zn B.氨水 C.KMnO4、ZnCO3 D.NaOH 溶液 9.仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置能达到相应实验目的的是( ) 选项 A B C D 实验目的 除去 KCl 中少量 MnO2 用 10 mol·L-1 盐酸配制 100 mL 0.1 mol·L-1 盐 酸 用 NaCl 溶液制 备 NaCl 晶体 除去乙烯中少量 SO2 实验仪器或装置 烧杯、玻璃棒、 分液漏斗 100 mL 容量瓶、 玻璃棒、烧杯 10.下列实验中,所采取的分离方法与对应原理都正确的是( ) 选项 实验目的 分离方法 原理 A 除去 CO2 中的 HCl 通入饱和 Na2CO3 溶液 洗气 HCl 与 Na2CO3 溶液反应生成 CO2 B 除去乙醇中少量的乙酸 加入足量生石灰蒸馏 乙醇和乙酸钙的沸点相差较大 C 除去 KNO3 固体中的 NaCl 冷却热饱和溶液重结 晶 NaCl 在水中的溶解度很大 D 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同 11.下列各组混合物的分离和提纯方法正确的是( ) A.用萃取法分离汽油和水的混合液 B.用结晶法提纯 NaCl 和 KNO3 混合物中的 KNO3 C.直接蒸馏酒精溶液得到无水乙醇 D.除去 FeCl3 溶液中少量的 FeCl2,加入足量的铁屑,充分反应后,过滤 12 下列实验方案不能达到实验目的的是( ) A.图甲装置用 Cu 和浓硝酸可制取 NO B.图乙装置可用于实验室制备 Cl2 C.图丙装置可用于实验室制取乙酸乙酯 D.图丁装置可用于实验室分离 CO 和 CO2 13.下列指定反应的离子方程式正确的是( ) A.将铜插入稀硝酸中:Cu+4H++2NO3 -=Cu2++2NO2↑+H2O B.向 Fe2(SO4)3 溶液中加入过量铁粉:Fe3++Fe=2Fe3+ C.向 Al2(SO4)3 溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4 + D.向 Na2SiO3 溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+ 14.制备(NH4)2Fe(SO4)2·6H2O 的实验中,需对过滤出产品的母液(pH<1)进行处理。常 温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的 是( ) A.通入过量 Cl2:Fe2+、H+、NH4 +、Cl-、SO4 2- B.加入少量 NaClO 溶液:NH4 +、Fe2+、H+、SO4 2-、ClO- C.加入过量 NaOH 溶液:Na+、Fe2+、NH4 +、SO4 2-、OH- D.加入过量 NaClO 和 NaOH 的混合溶液:Na+、SO4 2-、Cl-、ClO-、OH- 15 下列关于离子共存或离子反应的说法正确的是( ) A.某无色溶液中可能大量存在 H+、Cl-、MnO4 - B.pH=2 的溶液中可能大量存在 Na+、NH4 +、SiO3 2- C.Fe2+与 H2O2 在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O D.稀硫酸和氢氧化钡溶液反应:H++SO4 2-+Ba2++OH-=BaSO4↓+H2O 16.下列实验的反应原理用离子方程式表示正确的是( ) A.室温下,测的氯化铵溶液 pH<7,证明一水合氨的是弱碱:NH4 ++2H2O=NH3·H2O+H3O+ B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2 -+3H2↑ C.用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3 -→ +2H2O+2CO2↑ D.用高锰酸钾标准溶液滴定草酸:2MnO4 -+16H++5C2O4 2-=2Mn2++10CO2↑+8H2O 17.水溶液中能大量共存的一组离子是( ) A.NH4 + 、Ba2+、Br-、CO3 2- B.Cl-、SO3 2-、Fe2+、H+ C.K+、Na+、SO4 2-、MnO4 - D.Na+、H+、NO3 -、HCO3 - 18.常温下,下列各组离子一定能在指定溶液中大量共存的是( ) A.使酚酞变红色的溶液中:Na+、Al3+、SO4 2-、Cl- B. =1×10-13mol·L-1 的溶液中:NH4 +、Ca2+、Cl-、NO3 - C.与 Al 反应能放出 H2 的溶液中:Fe2+、K+、NO3 -、SO4 2- D.水电离的 c(H+)=1×10-13mol·L-1 的溶液中:K+、Na+、AlO2 -、CO3 2- 19.水溶液中能大量共存的一组离子是( ) A.Na+、Ca2+、Cl-、SO4 2- B.Fe2+、H+ 、SO3 2-、ClO- C.Mg2+、NH4 +、Cl- 、SO4 2-D.K+、Fe3+、NO3 -、SCN- 20 25℃时,下列各组离子在指定溶液中一定能大量共存的是( ) A.pH=1 的溶液中:Na+、K+、MnO4 -、CO3 2- B.c(H+)=1×10-13mol/L 的溶液中:Mg2+、Cu2+、SO4 2-、NO3 - C.0.1mol/LNH4HCO3 溶液中:K+、Na+、NO3 -、Cl- D.0.1mol/LFeCl3 溶液中:Fe2+、NH4 +、SCN-、SO4 2- 21.下列有关溶液组成的描述合理的是( ) A.无色溶液中可能大量存在 Al3+、NH4 +、Cl‾、S2‾ B.酸性溶液中可能大量存在 Na+、ClO‾、SO4 2‾、I‾ C.弱碱性溶液中可能大量存在 Na+、K+、Cl‾、HCO3‾ D.中性溶液中可能大量存在 Fe3+、K+、Cl‾、SO4 2‾ 22.下列有关 CuSO4 溶液的叙述正确的是( ) A.该溶液中 Na+、NH4 +、NO3 -、Mg2+可以大量共存 B.通入 CO2 气体产生蓝色沉淀 C.与 H2S 反应的离子方程式:Cu2++ S2-=CuS↓ D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4 + 23.下列表示对应化学反应的离子方程式正确的是( ) A.向稀 HNO3 中滴加 Na2SO3 溶液:SO3 2—+2H+=SO2↑+H2O B.向 Na2SiO3 溶液中通入过量 SO2:SiO3 2—+ SO2+ H2O=H2SiO3↓+SO3 2— C.向 Al2(SO4)3 溶液中加入过量的 NH3·H2O:Al3 ++4 NH3·H2O=[Al(OH)4]—+4NH4 + D.向 CuSO4 溶液中加入 Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ 24.某消毒液的主要成分为 NaClO,还含有一定量的 NaOH,下列用来解释事实的方程式中不. 合理..的是(已知:饱和 NaClO 溶液的 pH 约为 11)( ) A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O B.该消毒液的 pH 约为 12:ClO-+ H2O HClO+ OH- C.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O D.该消毒液加白醋生成 HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO— 25.下列有关 NaClO 和 NaCl 混合溶液的叙述正确的是( ) A.该溶液中,H+、NH4 +、SO4 2-、Br-可以大量共存 B.该溶液中,Ag+、K+、NO3 -、CH3CHO 可以大量共存 C.向该溶液中滴入少量 FeSO4 溶液,反应的离子方程式为: 2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O D.向该溶液中加入浓盐酸,每产生 1molCl2,转移电子约为 6.02×1023 个 26 下列指定反应的离子方程式正确的是( ) A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- B.Na2CO3 溶液中 CO3 2-的水解:CO3 2-+H2O=HCO3 -+OH- C.酸性溶液中 KIO3 与 KI 反应生成 I2:IO3 -+I-+6H+=I2+3H2O D.NaHCO3 溶液中加足量 Ba(OH)2 溶液:HCO3 -+Ba2++OH-=BaCO3↓+H2O 27.下列反应可用离子方程式“H++OH−=H2O” 表示的是( ) A.NaHSO4 溶液与 Ba(OH)2 溶液混合 B.NH4Cl 溶液与 Ca(OH) 2 溶液混合 C.HNO3 溶液与 KOH 溶液混合 D.Na2HPO4 溶液与 NaOH 溶液混合 28.下列有关 Fe2(SO4)3 溶液的叙述正确的是( ) A.该溶液中 K+、Fe2+、C6H5OH、Br-可以大量共存 B.和 KI 溶液反应的离子方程式:Fe3++2I-=Fe2++I2 C.和 Ba(OH)2 溶液反应的离子方程式:Fe3++SO4 2—+Ba2++3OH-=Fe(OH)3↓+Ba SO4↓ D.1 L0.1 mol·L—1 该溶液和足量的 Zn 充分反应,生成 11.2 g Fe 29 下列解释事实的方程式不正确...的是( ) A.测 0.1mol/L 氨水的 pH 为 11:NH3·H2O NH4 ++OH- B.将 Na 块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑ C.用 CuCl2 溶液做导电实验,灯泡发光:CuCl2 =======通电 Cu2++2Cl- D.Al 片溶于 NaOH 溶液中,产生气体:2Al+2OH-+2H2O=2AlO2 -+3H2↑ 30.下列指定反应的离子方程式正确的是( ) A.Cu 溶于稀硝酸 HNO3:Cu+2H++NO3 -=Cu2++NO2↑+H2O B.(NH4)2Fe(SO4)2 溶液与过量 NaOH 溶液反应制 Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ C.用 CH3COOH 溶解 CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ D.向 NaAlO2 溶液中通入过量 CO2 制 Al(OH)3:CO2+AlO2 -+2H2O=Al(OH)3↓+HCO3 - 31.下列离子方程式错误的是( ) A.向 Ba(OH)2 溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO4 2 - =BaS04↓+2H2O B.酸性介质中 KMnO4 氧化 H2O2:2MnO4 - +5H2O2+6H+ = 2Mn2++5O2↑+ 8H2O C.等物质的量的 MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e- = PbO2+4H++SO4 2 - 32.能正确表示下列反应的离子方程式是( ) A.Cl2 通入 NaOH 溶液:Cl2+OH-=Cl-+ClO-+H2O B.NaHCO3 溶液中加入稀 HCl:CO3 2-+2H+=CO2↑+H2O C.AlCl3 溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2 -+4NH4 ++2H2O D.Cu 溶于稀 HNO3:3Cu+8H++2NO3 -=3Cu2++2NO↑+4H2O 二填空试题(每空 2 分共计 36 分) 33.如图所示是一个制取氯气并以氯气为原料进行特定反应的装置。请回答下列问题: (1)装置 A 分液漏斗与烧瓶中分别盛装浓盐酸、MnO2,反应的化学方程式为_________ A 中 g 管的作用是_____________________。 (2)装置 D 可以实现用纯净的氯气和铁粉反应制取少量氯化铁固体,已知氯化铁熔、沸点 较低,易水解。 ①装置 B 内盛装的试剂为________,作用是___________________。 ②装置 F 内盛装的试剂为________,作用是___________________。 ③该实验设计存在一个明显的缺陷,改进的措施是_____________________。 (3)若装置 B、C、D、E、F 内分别盛有氢硫酸、水、炭粉、紫色石蕊试液、氢氧化钠溶液。 已知 B 中有黄色固体生成,D 中发生氧化还原反应,其产物为二氧化碳和氯化氢。 ①写出装置 B 中反应的离子方程式___________________________________________, D 中反应的化学方程式_________________________。 ②在装置 E 处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__________ 34.高氯酸铵可用于火箭推进剂,实验室可由 NaClO3 等原料制取(部分物质溶解度如下图), 其实验流程如下: (1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为__________________。 (2)80 ℃时浸取液冷却至 0 ℃过滤,滤渣的主要成分为________(写化学式)。 (3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为__________________。 (4)已知:2NH4ClO4=====△ N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂: a.饱和食盐水 b.浓 H2SO4 c.NaOH 溶液 d.Mg e.Cu f.Fe 利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。 ①E 中收集到的气体可能是________(填化学式)。 ②A、B、C 中盛放的药品依次是________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。 Ⅰ.a、b、d Ⅱ.c、b、e Ⅲ.b、c、f 35.三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33 ℃,沸点:73 ℃。实验室 可用如图装置制取 ICl3。 (1)仪器 a 的名称是____________。 (2)制备氯气选用的药品为漂白精固体[主要成分为 Ca(ClO)2]和浓盐酸,相关反应的化学 方程式为______________________。 (3)装置 B 可用于除杂,也是安全瓶,能监测实验进行时装置 C 中是否发生堵塞,请写出 发生堵塞时装置 B 中的现象:__________________。 答案 一选择 1 C 2B 3D 4C 5 A 6C 7B 8A 9C 10B 11B 12 C 13 C 14D 15C 16B 17C 18B 19C 20C 21 C 22 A 23 D 24 B 25 D 26 D 27 C 28 D 29 C 30 D 31 C 32 D 二填空 33 (1)MnO2+4HCl(浓)=====△ MnCl2+Cl2↑+2H2O 平衡分液漏斗与烧瓶内的气体压强,利于向 烧瓶中加入浓盐酸 (2)①饱和食盐水 除去 Cl2 中含有的 HCl ②浓 H2SO4 防止空气中的水蒸气进入装置 E ③在装置 F 后面添加一个盛 NaOH 溶液的洗气瓶 (3)①Cl2+H2S===2H++2Cl-+S↓ 2Cl2+2H2O+C=====△ 4HCl+CO2 ②D 中产生的 HCl、CO2 等能使紫色石蕊试液变为红色,过 量的 Cl2 与 H2O 反应产生的 HClO 能使石蕊试液褪色 34 (1)4NaClO3=====高温3NaClO4+NaCl (2)NaClO4 (3)NH+ 4 +ClO- 4 ===NH4ClO4↓ (4)①N2 ②Ⅱ 35 (1)蒸馏烧瓶 (2)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O (3)吸滤瓶中液面下降,长颈漏斗中液面上升查看更多