2018-2019学年吉林省乾安县第七中学高二上学期期末考试化学试题 Word版
乾安七中2018—2019学年度(上)高二期末考试
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,考试时间为90分钟。
第Ⅰ卷(选择题,共60分)
一、选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1.下列事实不能用化学平衡移动原理解释的是 ( )
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于H2转化为NH3
C.蒸干AlCl3溶液无法得到无水AlCl3
D.滴加少量CuSO4溶液可以加快Zn与稀H2SO4反应的速率
2.某酸式盐溶液NaHR的电离方程式为NaHR = Na+ + HR-下列有关说法不正确的是( )
A. Na2R溶液的PH值一定大于7
B. NaHR溶液中:c( OH-)+2c( R2-)+ c( HR-)= c(H+)+ c( Na+)
C. NaHR溶液中c( Na+)>c( HR-)>c( R2-)>c( OH-)>c( H+)
D. 0.1mol·L-1NaHR溶液中:c(HR -) < 0.1mol·L-1
3.25℃时,水的电离达到平衡:H2OH++OH−(ΔH>0),下列叙述正确的是 ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH−)减小
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.向水中加入少量金属钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,pH不变
4.一定温度下,下列溶液的离子浓度关系正确的是 ( )
A.pH=a的HF溶液,稀释10倍后,其pH=b,则b=a+1
B.pH=3的H2SO3溶液中,c(H+)=c()=1×10-3 mol·L-1
C.0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+ c(c(HCO3_)
D.pH相同的①CH3COONa、②NaClO的两种溶液的c(Na+):①>②
5.下列有关盐类水解的叙述中正确的是( )
A.溶液呈中性的盐一定是强酸、强碱生成的盐
B.含有弱酸根盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
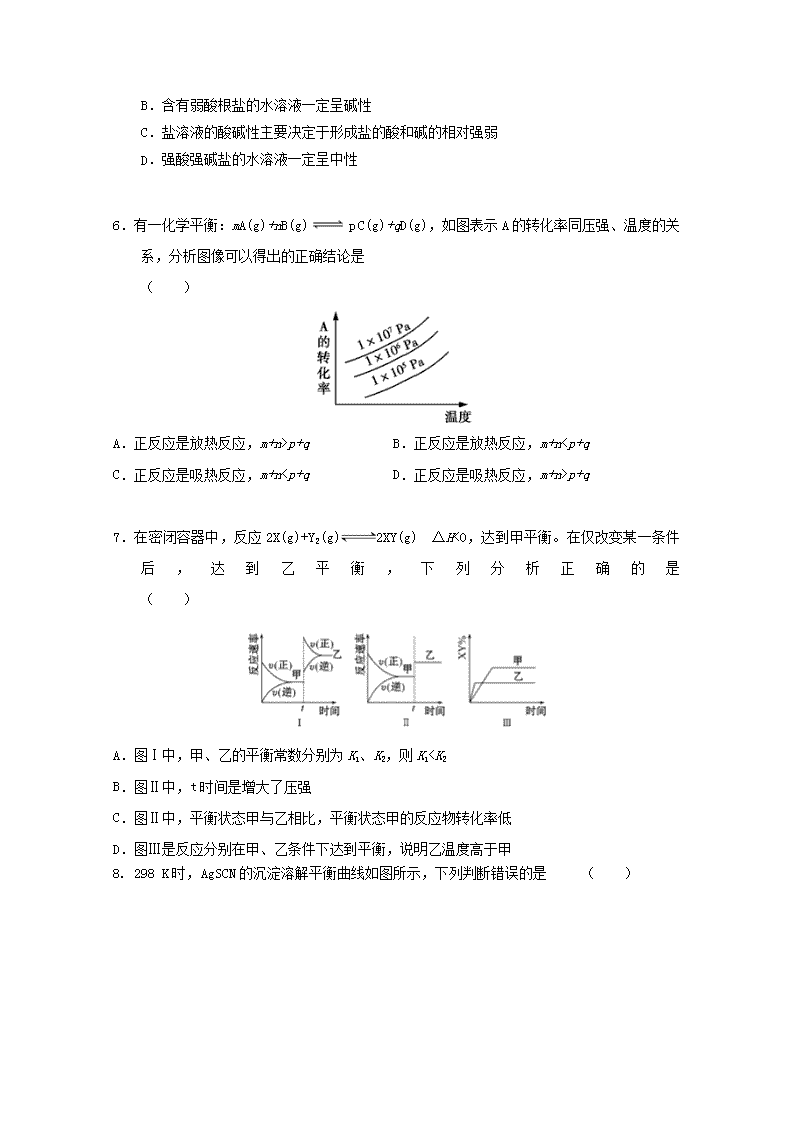
6.有一化学平衡:mA(g)+nB(g) p C(g)+qD(g),如图表示A的转化率同压强、温度的关系,分析图像可以得出的正确结论是 ( )
A.正反应是放热反应,m+n>p+q B.正反应是放热反应,m+n
p+q
7.在密闭容器中,反应2X(g)+Y2(g)2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是 ( )
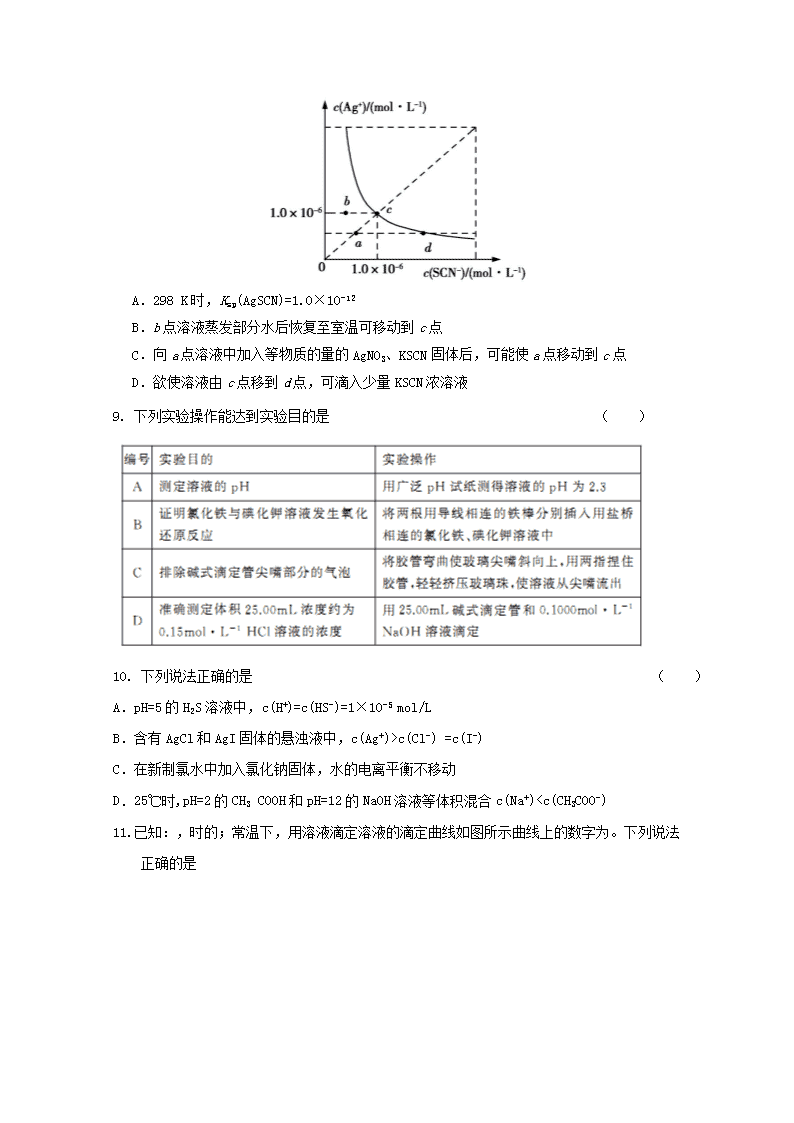
A.图Ⅰ中,甲、乙的平衡常数分别为K1、K2,则K1c(Cl-) =c(I-)
C.在新制氯水中加入氯化钠固体,水的电离平衡不移动
D.25℃时,pH=2的CH3 COOH和pH=12的NaOH溶液等体积混合c(Na+)3 c(HA-)
12.下列各能级的中电子所具有的能量最高的是 ( )
A.3s2 B.4p4 C.5d1 D.6s2
13.下列有关原子核外电子排布规律,说法正确的是 ( )
A. 原子核外电子都是先排内层后排外层
B. Fe2+的价层电子排布式为3d54s1
C. 各原子轨道的伸展方向数按p、d、f的顺序分别为1、3、5
D. 同一原子中,1s、2s、3s能级最多容纳的电子数相同
14.下下列原子的电子跃迁能释放光能形成发射光谱的是 ( )
A. 1s22s22p63s2→1s22s22p63p2
B. 1s22s22p33s1→1s22s22p4
C. 1s22s2→1s22s12p1
D. 1s22s22p1→1s22s22p1
15.下列各项叙述中,正确的是 ( )
A. Si、P、S的第一电离能随原子序数的增大而增大
B. 价电子排布为3d64s2的元素位于第四周期第ⅧB族,是d区元素
C. 2p和3p轨道形状均为哑铃形,能量不相等
D. 氮原子的最外层电子排布图:
16.有机锗具有抗肿瘤活性,锗元素的部分信息如图。则下列说法不正确的是( )
A.x=2
B.锗元素与碳元素位于同一族,属于ⅣA族
C.锗位于元素周期表第4周期,原子半径大于碳的原子半径
D.距离锗原子核较远区城内运动的电子能量较低
17.已知某元素原子的L电子层上有6个电子,则该元素在周期表中位于( )
A.第3周期IVA族 B.第2周期VIA族
C.第2周期IVA族 D.第3周期VIA族
18.X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化关系如图所示。已知X的原子半径在所有原子中最小;Y的一种核素的质量数为15,中子数为8;W的最高价氧化物的水化物在含氧酸中酸性最强。下列说法不正确的是 ( )
A. X元素有多种核素
B. X与Y可形成YX3型共价化合物
C. Y元素的电负性一定小于Z元素
D. W元素的单质有强氧化性,它不可能与水发生氧化还原反应
19.以下有关元素性质的说法不正确的是 ( )
A. ①Na,K,Rb;②N,P,As;③O,S, Se;④Na,P,Cl 元素的电负性随原子序数增大而递增的是④
B. 下列原子中,①1s22s22p63s23p1;②1s22s22p63s23p2;③1s22s22p63s23p3;④1s22s22p63s23p4对应的第一电离能最大的是④
C.某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,该元素可能在第三周期第ⅡA族
D. 以下原子,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4半径最大的是①
20.香花石由前20号主族元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍。T无正价,X与R原子序数之和是W的2倍。下列说法中错误的是 ( )
A. 原子半径:Y>Z>R>T
B. XR2、WR2两化合物中R的化合价相同
C. 最高价氧化物对应的水化物碱性:X>Z
D. 气态氢化物的稳定性:W”“<”或“=”)。
(4)将25 ℃时pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a∶b=______________。
(5)有物质的量浓度相同的盐酸、硫酸、醋酸三种溶液:若三种溶液c(H+)依次为C1、C2、C3,则它们的大小关系为______________
(6)常温下,已知Ksp[M(OH)3] =1.0×10−38,要使溶液中的M3+降至10−5mol/L,则应调节溶液pH=________。
22.(18分)A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D同主族,A原子M层电子数是L层的一半,B是同周期第一电离能最小的元素,C在同周期中未成对电子数最多,E的M层有4个未成对电子。回答下列问题:
(1)A的一种氧化物可溶于一种弱酸,写出反应方程式________________________。
(2)元素D的原子核外共有_____种形状不同的电子云。
(3)和B、C同周期且第一电离能介于B和C之间的元素是___________(填元素符号)。
(4)含有元素B的盐的焰色反应为________________色,许多金属盐都可以发生焰色反应,其原因是_________________________。
(5)E元素处于周期表分区中的______区,E的稳定离子的电子排布式______。
(6)画出D的核外电子排布图_____________________。
(7)用电子式表示B的硫化物的形成过程:______________________________。
23.(5分)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是________________________ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)________(填“>”“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。
(3)求出混合液中下列算式的精确计算结果(填具体数值):c(Na+)-c(A-)=________mol·L-1。
(4)已知NH4A溶液是中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________(选填“>”“<”或“=”)7。
(5)将相同温度下浓度相同的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列为________(填序号)。
24.(5分)恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mo1·L—1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________________。
(2)x =________。
(3)A的转化率与B的转化率之比为___________。
(4)下列各项可作为该反应达到平衡状态的标志的是_________。
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
(5)欲使反应达到平衡时,C的物质的量分数与上述平衡相等,起始加入A、B的物质的量n(A)和n(B)之间应满足的关系为 ________________________。
乾安七中2018—2019学年度(上)高二期末考试
高二化学答案
一、选择题(每个3分,共60分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
D
C
B
D
C
D
D
B
C
D
D
C
D
B
C
D
B
D
B
B
21.(12分,每空2分)
(1)稀盐酸
(2).Al3++3H2O⇌Al(OH)3+3H+
(3)<
(4)10:1
(5)C2> C1> C3
(6)3
22.(18分,每空2分)
(1)4HF+SiO2=SiF4↑+2H2O
(2) 2
(3) Mg 、Al 、Si 、S
(4) 黄;激发态的电子从能量高的轨道跃迁到能量低的轨道时,以一定的波长(可见光区域)光的形式释放能量
(5)d ; [Ar]3d5
(6)
(7)
23.(5分,每空1分)
(1) A﹣+H2O⇌HA+OH﹣
(2) >
(3) 9.9×10-7
(4) >
(5)ABDC
24.(5分,每空1分)
(1)0.6mo1·L—1·min—1
(2) 3
(3) 2:1
(4) BC
(5) n(A) = n(B)或n(A):n(B)=1:1