化学卷·2018届河北省唐山市开滦二中高二12月月考(2016
开滦二中2016~2017学年度高二年级第一学期12月月考
化学试卷
说明:
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷 第1页至第4页,第Ⅱ卷第5页至第8页。满分100分,时间90分钟。
相对原子质量:H:1 Na:23 O:16 C:12 Cl:35.5 Cu:64 Fe:56 Zn:65
第Ⅰ卷(选择题,共54分)
一、选择题:(本题包括18小题,每小题3分,共54分,每小题有一个选项符合题意)
1.下列物质属于强电解质且能导电的是
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸
A.⑤ B.①②⑥
C.②⑤⑥⑦ D.①③④⑤⑥
2.水是最宝贵的资源之一。下列表述正确的是
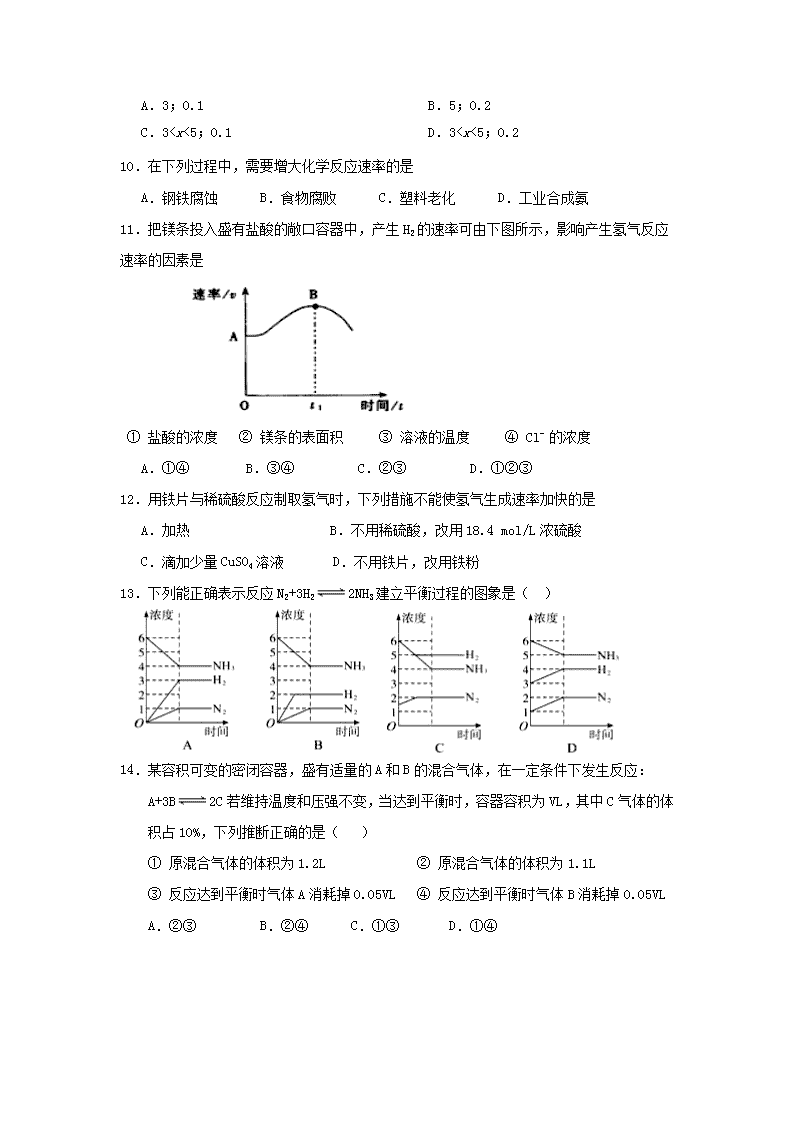
A.100 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
3.下列事实能说明亚硝酸是弱电解质的是
①25 ℃时0.1mol/L亚硝酸钠溶液的电离度为7% ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1
A.①②③ B.②③④ C.①④ D.①②④
4.把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经过一段时间后,首先观察到溶液变红的区域是
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近 C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
5. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.某无色溶液中:Al3+、Cu2+、SO、Cl-
B. 由水电离的c(H+)=1×10-12 mol·L-1的溶液中:Fe 2+、K+、Cl-、NO
C. c(H+) / c(OH-)=1012的溶液中:Na+、Mg2+、NO、Cl-
D. 含有大量OH-的溶液中: NH、Al3+、Ca2+、Cl-
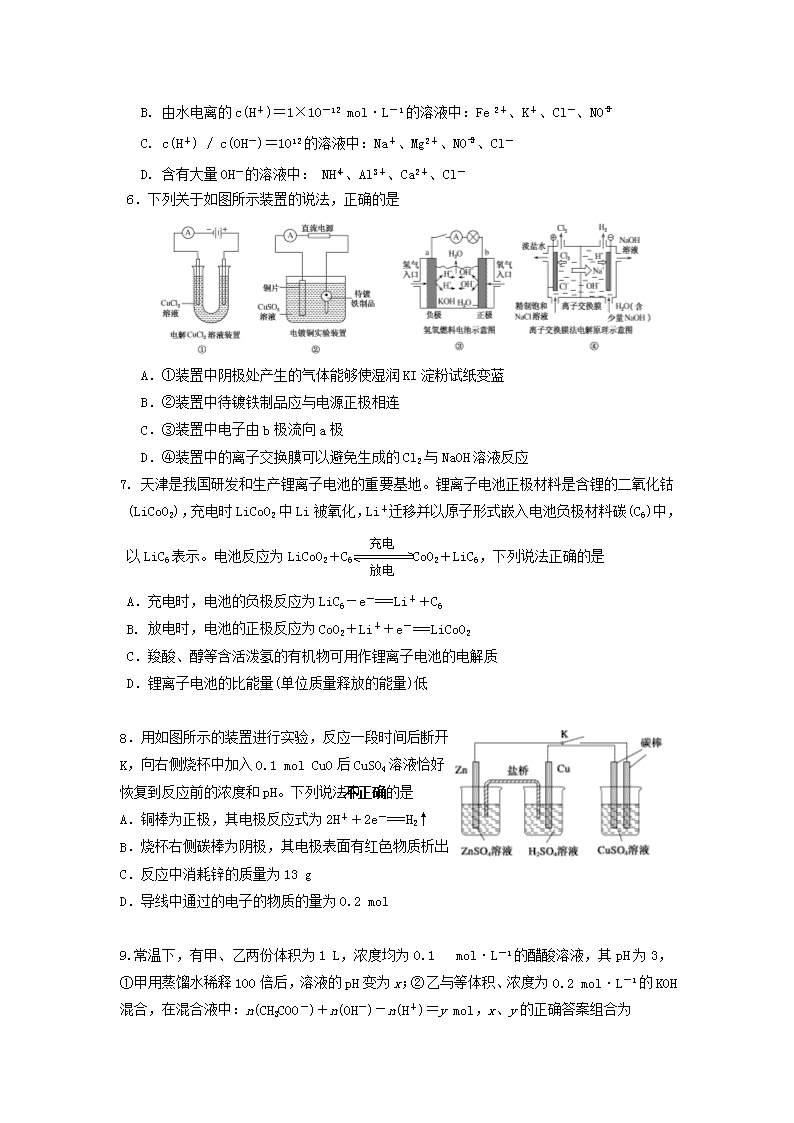
6.下列关于如图所示装置的说法,正确的是
A.①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
7. 天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6充电
放电
CoO2+LiC6,下列说法正确的是
A.充电时,电池的负极反应为LiC6-e-===Li++C6
B. 放电时,电池的正极反应为CoO2+Li++e-===LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
8.用如图所示的装置进行实验,反应一段时间后断开 K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是
A.铜棒为正极,其电极反应式为2H++2e-===H2↑
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.反应中消耗锌的质量为13 g
D.导线中通过的电子的物质的量为0.2 mol
9.常温下,有甲、乙两份体积为1 L,浓度均为0.1 mol·L-1的醋酸溶液,其pH为3,
①甲用蒸馏水稀释100倍后,溶液的pH变为x;②乙与等体积、浓度为0.2 mol·L-1的KOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol,x、y的正确答案组合为[]
A.3;0.1 B.5;0.2
C.3
”、“=”或“<”,下同)
②若Zn过量, 产生H2的量a______b;
③若Zn不足量,产生H2的量a______b;
(2)将等质量的Zn粉分别投入pH=1,体积均为10 mL的a:盐酸和b:醋酸中。
①若Zn都不足量,则起始反应速率a______b;(填“>”“=”或“<”,下同)
②若Zn都过量, 则产生H2的量a______b;
③若Zn都不足量,产生H2的量a______b;
21.(10分)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H= a kJ/mol
(1)己知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1= + 489.0kJ/mol
② C(石墨)+CO2(g)=2CO(g) △H2= + 172.5kJ/mol
则a=______kJ/mol。
(2)冶炼铁反应的平衡常数表达式K=_______,温度升高后,K 值______(填“增大”、“不变”或“减小”)。[]
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3
CO
Fe
CO2[]
甲/mol
1.0
1.0
1.0
1.0
乙/mol
1.0
2.0
1.0[]
1.0
① 甲容器中CO 的平衡转化率为___________。
② 下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO 的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
22.(14分)
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
实验编号
温度
时间/min
0
10
20
40
50[Z#X#X#K]
1
130 ℃
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
2
180 ℃
n(CH4)/mol
0.50
0.30
0.18[]
0.15
(1)开展实验1和实验2的目的是____________________________________。
(2)180℃时,反应到40min,体系_____(填“是”或“否”)达到平衡状态,理由是
___________________________________________________________。
(3)已知130℃时该反应的化学平衡常数为6.4 ,计算a=
(4)根据已知求算:△H2 = ___________________。
CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) △H2
(5)一定条件下,反应时间t与转化率α( NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。
23. (8分)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数Kw=______________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=______________。
① 若所得混合液为中性,且a+b=12,则Va∶Vb=_________________。
选择题(1—18每题3分,共54分)
题目
1
2
3
4
5
6
7
8
9
10
答案
A
C
C
B
C
D
B
C
D
D
题目
11
12
13
14
15
16
17
18
答案
D
B
A
A
C
C
C
D
19.(10分) ⑴酸 ⑵锥形瓶内溶液颜色的变化 ⑶ ①⑤③④②⑥ ⑷0.2000 ⑸偏低 (每空2分)
20.(每空1分,共6分)
(1)① > ② = ③ = (2) ① = ② < ③ =
21. (10分) (1)-28.5 ; (2); 减小;(3)①60%; ② a c;
22. (14分)
(1)探究温度对反应速率和化学平衡的影响;
(2)是;
温度升高反应速率加快,高温下比低温下更快达到平衡状态,对比实验1可确定40min时反应已经达到平衡状态;
(3)1.2(无单位);
(4);
(5)-1160kJ/mol
23. (2,3,3分,共8分)
(1)10-13 (2)①1∶10 ②10∶1