- 2021-08-06 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【推荐】专题3-1+弱电解质的电离-试题君之K三关2017-2018学年高二化学人教版
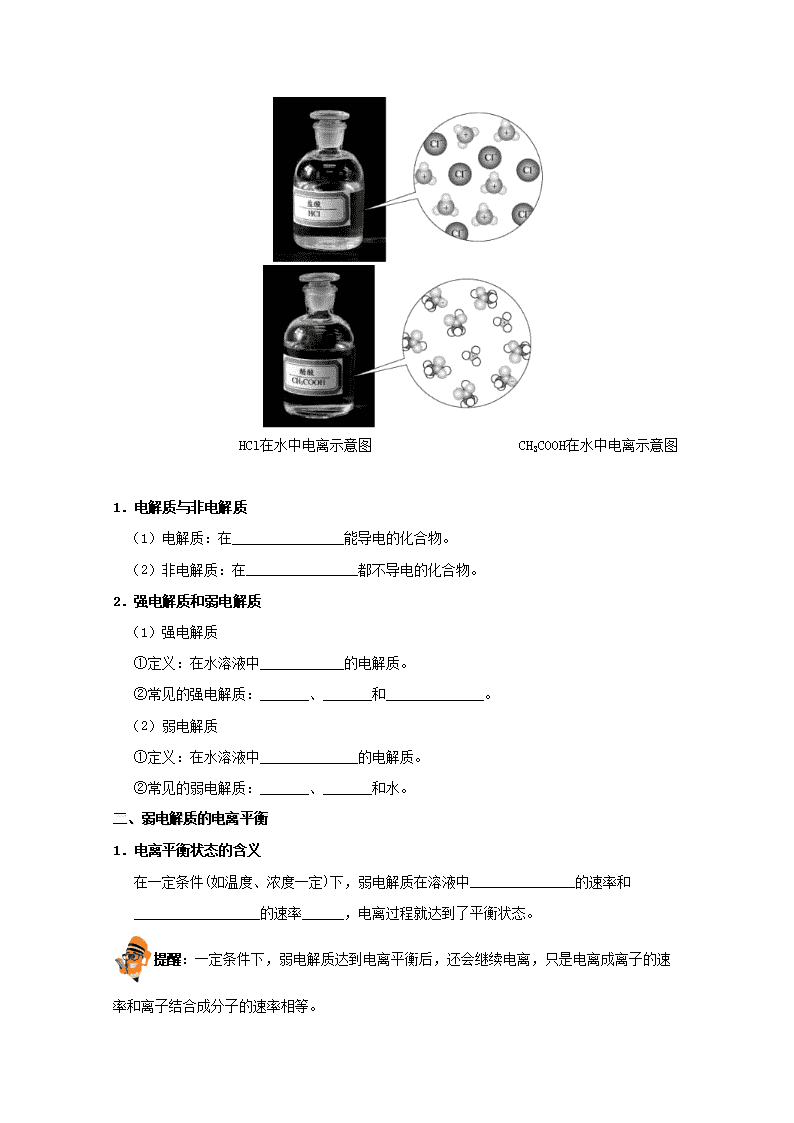
蚊虫、蚂蚁等昆虫叮咬人时常向人体血液内注入一种称之为蚁酸(主要成分为HCOOH)的有机酸。当人受到蚊蚁叮咬时,皮肤上常起小疱,这是因为人体血液中的酸碱平衡被破坏所致,若不治疗,过一段时间小疱也会自行痊愈,这是由于血液中又恢复了原先的酸碱平衡,你能用平衡移动的原理解释上述事实吗? 一、强弱电解质 实验名称 等浓度的盐酸、醋酸溶液酸性的比较 实验装置 —— 实验原理 Mg+2H+=Mg2++H2↑,Mg+2CH3COOH=Mg2++2CH3COO-+H2↑ 实验用品 1.0 mol/L盐酸溶液、1.0 mol/L醋酸溶液;pH试纸、试管、胶头滴管。 实验步骤 分别取等体积的1.0 mol/L盐酸溶液和1.0 mol/L醋酸溶液与等量的镁条反应,观察实验现象,并测定这两种酸的pH。 实验现象 盐酸溶液中剧烈反应,产生大量气泡,醋酸溶液中缓慢反应,产生少量气泡。1.0 mol/L盐酸溶液的pH为0,1.0 mol/L醋酸溶液的pH为2。 实验结论 ①反应的剧烈程度和pH都有差别,说明两溶液中的H+浓度是不同的。 ②盐酸溶液中的现象更为剧烈,说明盐酸中H+浓度比醋酸中H+浓度大,即HCl的电离程度大于CH3COOH的电离程度。 HCl在水中电离示意图 CH3COOH在水中电离示意图 1.电解质与非电解质 (1)电解质:在________________能导电的化合物。 (2)非电解质:在________________都不导电的化合物。 2.强电解质和弱电解质 (1)强电解质 ①定义:在水溶液中____________的电解质。 ②常见的强电解质:_______、_______和______________。 (2)弱电解质 ①定义:在水溶液中______________的电解质。 ②常见的弱电解质:_______、_______和水。 二、弱电解质的电离平衡 1.电离平衡状态的含义 在一定条件(如温度、浓度一定)下,弱电解质在溶液中_______________的速率和__________________的速率______,电离过程就达到了平衡状态。 提醒:一定条件下,弱电解质达到电离平衡后,还会继续电离,只是电离成离子的速率和离子结合成分子的速率相等。 2.强、弱电解质电离方程式的书写规则 (1)强电解质完全电离,在写电离方程式时,用“”。 H2SO4:_______________________________________。 Ba(OH)2:_______________________________________。 NH4Cl:_______________________________________。 (2)弱电解质部分电离,在写电离方程式时,用“”。 ①一元弱酸、弱碱一步电离。 CH3COOH:____________________。NH3·H2O:____________________。 ②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。 H2CO3:____________________(主),_______________________________(次)。 ③多元弱碱分步电离(较复杂),在中学阶段要求一步写出。 Fe(OH)3:_______________________。Cu(OH)2:_______________________。 三、电离常数 1.表示方法 对于ABA++B−,K=____________________。 2.K的意义 表征了弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度__________。多元弱酸只考虑__________。 3.影响因素 K只与电解质的性质和温度有关,对同一弱电解质,温度一定,电离常数一定。 实验名称 醋酸与饱和硼酸溶液酸性比较 实验装置 实验原理 Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑ 实验用品 0.1 mol/L醋酸、饱和硼酸溶液、1 mol/L碳酸钠溶液;铁架台、试管、胶头滴管。 实验步骤 向两支洁净的试管中分别加入0.1 mol/L醋酸、饱和硼酸溶液,然后分别向两支试管中加入1 mol/L的碳酸钠溶液,观察实验现象。 实验现象 醋酸溶液中产生气泡,硼酸溶液中无气泡产生。 实验结论 ①醋酸能与碳酸钠溶液反应,放出CO2气体,而硼酸不能。 ②酸性强弱:CH3COOH>H2CO3>H3BO3。 实验说明 为使实验现象更加明显,易于观察,滴加顺序必须为向酸溶液中滴加碳酸钠。 【答案】一、1.(1)水溶液中或熔融状态下 (2)水溶液中和熔融状态下 2.(1)能够全部电离 硫酸 氢氧化钠 氯化钠(或其他合理答案) (2)不能全部电离 醋酸 一水合氨(或其他合理答案) 二、1.电离成离子 离子结合成弱电解质分子 相等 2.(1)H2SO42H++ Ba(OH)2Ba2++2OH− NH4Cl+Cl− (2)①CH3COOHCH3COO−+H+ NH3·H2O+OH− ②H2CO3H++ H++ ③Fe(OH)3Fe3++3OH− Cu(OH)2Cu2++2OH− 三、1. 2.越大 第一步电离 一、强电解质和弱电解质的比较 1.电解质的电离程度是由物质内部结构决定的。强、弱电解质的主要区别是在水溶液中能否完全电离。 2.电解质的电离程度与溶液的导电能力没有必然联系。溶液的导电能力取决于溶液中自由移动的离子的浓度以及离子所带的电荷数。强电解质溶液中自由移动的离子浓度不一定大,弱电解质溶液中自由移动的离子浓度不一定小,故强电解质溶液的导电能力不一定比弱电解质溶液的强。 3.电解质的电离程度与化学键没有必然联系。一般强电解质含有离子键或强极性键,但含有强极性键的化合物不一定是强电解质,如HF是弱电解质。 4.电解质的电离程度与溶解度无关。某些难溶于水的盐,虽然溶解度很小,但溶于水的部分是完全电离的,它们仍属于强电解质。有少数盐尽管能溶于水,但只有部分电离,仍属于弱电解质。如醋酸铅。 下列物质的分类组合全部正确的是 编号 强电解质 弱电解质 非电解质 A NaCl HF Cl2 B NaHCO3 NH3 · H2O CCl4 C Ba(OH)2 HCl Cu D AgCl H2S CH3COOH 【点拨】电解质和非电解质的范畴都是化合物,所以单质既不是电解质,也不是非电解质。划分电解质和非电解质的标准是在水溶液中或熔融状态下能否导电。划分强电解质和弱电解质的标准是看在水溶液里是否完全电离。 【答案】B 二、影响弱电解质电离平衡的因素 内因 弱电解质本身的性质,是决定因素 外因 温度 电离是吸热过程。温度升高,电离程度增大;反之,电离程度减小 浓度 增大弱电解质的浓度,电离平衡向电离方向移动 加水稀释,电离平衡向电离方向移动 同离子效应 在弱电解质溶液中加入与弱电解质电离出相同离子的强电解质,电离平衡向生成弱电解质分子 的方向移动 化学反应 若外加物质能与弱电解质电离出的离子发生反应,电离平衡向电离方向移动 1.电离平衡属于化学平衡,当外界条件改变时,弱电解质的电离平衡也会发生移动,平衡移动也遵循勒夏特列原理。加入参与平衡建立的某种微粒,其浓度一定增大;减少参与平衡建立的某种微粒,其浓度一定减小,即“加谁谁大”、“减谁谁小”。 2.由于弱电解质是部分电离的,故溶液中的离子浓度小于弱电解质分子的浓度。 3.相同条件下,温度越高,弱电解质的电离程度越大,电离产生的离子浓度越大。相同条件下,浓度越大,弱电解质的电离程度越小,但电离产生的离子浓度越大。 4.加水稀释或增大弱电解质的浓度,都使电离平衡向电离方向移动,但加水稀释时弱电解质的电离程度增大,而增大浓度时弱电解质的电离程度减小。 已知相同条件下,HClO的电离常数小于H2CO3的第一级电离常数。为了提高氯水中HClO的浓度,可加入 A.HCl B.CaCO3(s) C.H2O D.NaOH(s) 【答案】B 三、电离常数的计算及应用 1.根据电离平衡常数判断弱酸或弱碱的相对强弱 在相同温度下,电离平衡常数越大,表明弱电解质越易电离,对应的酸性或碱性越强。对于多元弱酸,酸性的强弱主要取决于第一步电离,故应根据Ka1进行判断。 2.利用电离平衡常数计算某离子浓度 若已知c(HX)和电离平衡常数K,求c(X−)。 因弱酸电离程度很小,c(HX)−c(X−)≈c(HX)。则c(X−)=,代入数值求解即可。 (1)在运用电离平衡常数表达式进行计算时,浓度必须是平衡时的浓度。 (2)当涉及的浓度数值相差百倍以上时,可以忽略数值小的一方。但相差不大时,不能忽略数值小的一方。 下列关于电离平衡常数(K)的说法中正确的是 A.组成相似时电离平衡常数(K)越小,表示弱电解质电离能力越弱 B.电离平衡常数(K)与温度无关 C.不同浓度的同一弱电解质,其电离平衡常数(K)不同 D.多元弱酸各步电离平衡常数相互关系为K1查看更多
- 当前文档收益归属上传用户