湖北省随州市第二高级中学2018-2019学年高二9月起点考试化学试题(B-2bC班)
随州二中2017级高二化学9月月考试卷
命题人: 考试时间:90分钟 试卷满分:100分
一、选择题(共16小题,48分)
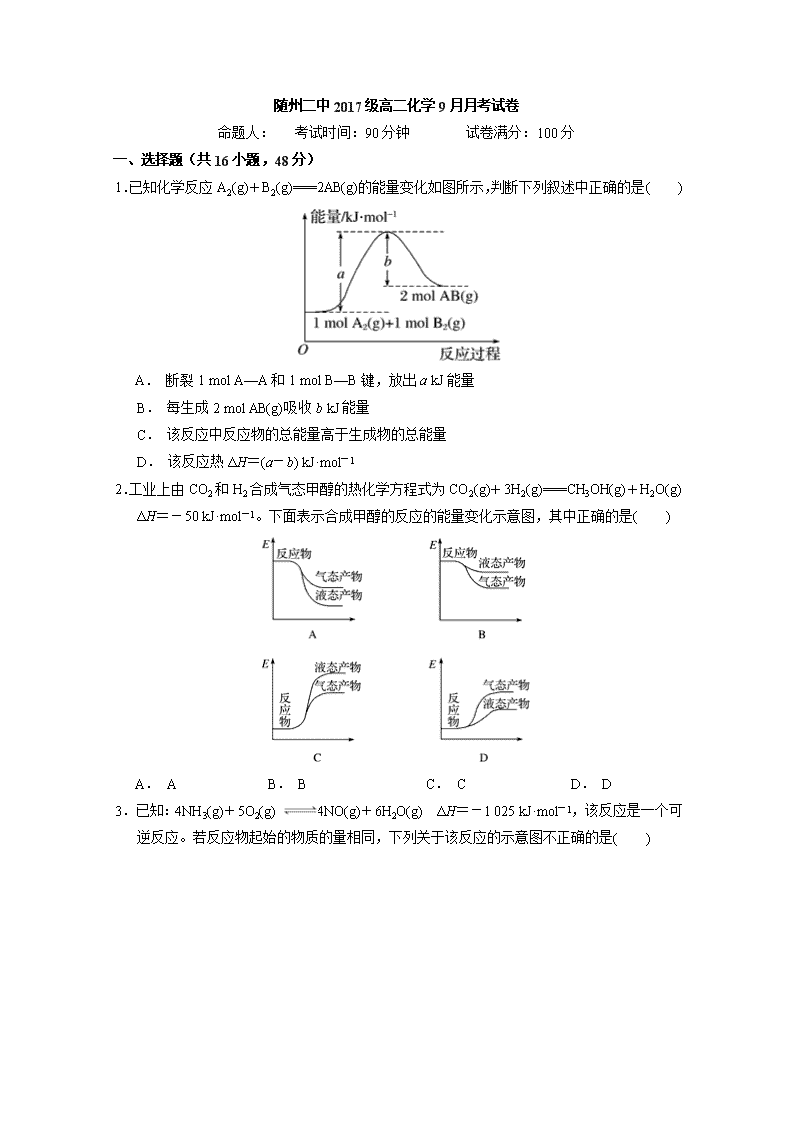
1.已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
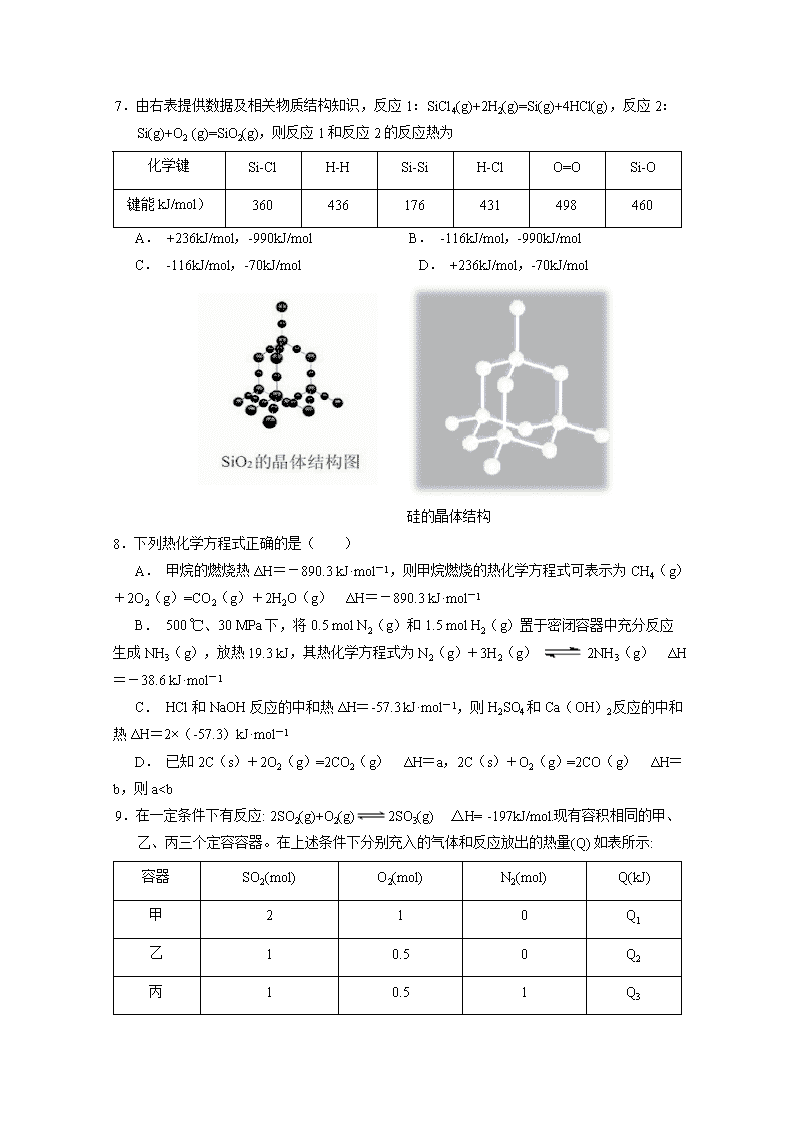
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
2.工业上由CO2和H2合成气态甲醇的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-50 kJ·mol-1。下面表示合成甲醇的反应的能量变化示意图,其中正确的是( )
A. A B. B C. C D. D
3.已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1,该反应是一个可逆反应。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
A. A B. B C. C D. D
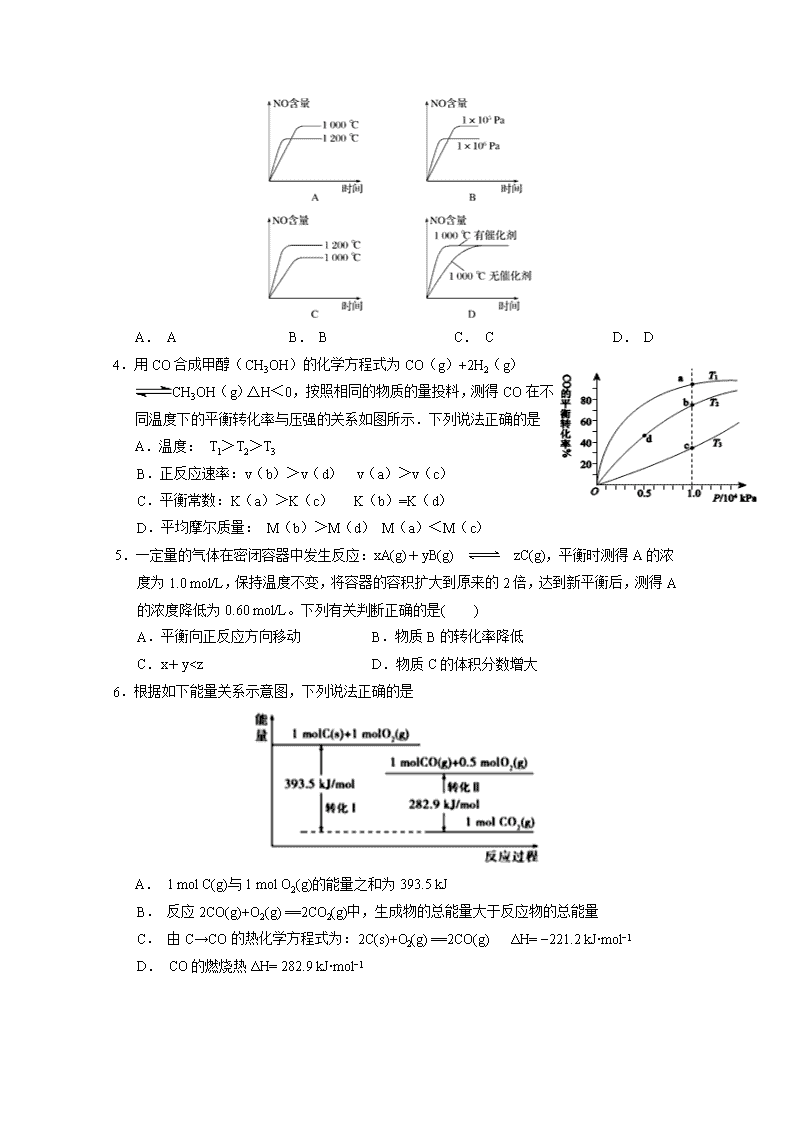
4.用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是
A.温度: T1>T2>T3
B.正反应速率:v(b)>v(d) v(a)>v(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量: M(b)>M(d) M(a)<M(c)
5.一定量的气体在密闭容器中发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是( )
A.平衡向正反应方向移动 B.物质B的转化率降低
C.x+y
”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
18.利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)搅拌棒为何不用铜质的��_____________.
(4)实验数据如下表:
①请填写下表中的空白:________。
温度
实验次数
起始温度℃
终止温度
/℃
温度差平均值/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
29.5
2
27.0
27.4
27.2
32.3
3
25.9
25.9
25.9
29.2
4
26.4
26.2
26.3
29.8
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是(______)。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度
19 化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)Cr2O7在溶液中与CrO存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是( );反应离子方程式_________________________________.
Na2S2O3溶液
稀H2SO4
H2O
温度/℃
c/mol · L
V/mL
c/mol · L
V/mL
V/mL
A
0.1
5
0.5
5
10
10
B
0.2
5
0.1
5
10
10
C
0.1
5
0.1
5
10
30
D
0.2
5
0.1
5
10
30
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验内容及记录】
实验编号
室温下,试管中所加试剂及其用量/mL
室温下溶液颜色褪至无色所需时间/min
0.6 mol/L
H2C2O4溶液
H2O
0.2 mol/L
KMnO4溶液
3 mol/L
稀硫酸
1
3.0
V
3.0
2.0
4.0
2
3.0
3.0
2.0
2.0
5.2
3
3.0
4.0
1.0
2.0
6.4
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
20.亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为__________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号
c(NOCl)/(mol·L-1)
v正/(mol·L-1·s-1)
①
0.30
3.60×10-9
②
0.60
1.44×10-8
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号
热化学方程式
平衡常数
①
2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) ΔH1=a kJ/mol
K1
②
4NO2(g)+2NaCl(s)2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol
K2
③
2NO(g)+Cl2(g)2NOCl(g) ΔH3
K3
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中
通入0.08 mol NO和0.04 molCl2发生上述反应③,
若反应开始与结束时温度相同,数字压强仪显示反
应过程中压强(p)随时间(t)的变化如图曲线a所示,
则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。
21.某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
(1)装置甲中发生反应的化学方程式为________________________。
(2) 装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加NH4SCN溶液,用离子方程式表示检验原理——————————————————————。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
9月月考化学参考答案
1—5 DACCB 6---10 CADDC 11—16 BBDADC
17 、 2CO(g)+2NO(g)N2(g)+2CO2(g) △H=-747 kJ/mol // ad //
0.042mol·L-1·min-1 // // > // 正向// 60%
18、 C // D //
铜具有良好的传热性能,易使热量扩散,导致热量损失。
3.4 // -56.8kJ/mol // B
19、 (1)橙色//Cr2O+2H2O2CrO+2H+
(2)I2或碘 4I+O2+4H+=I2+2H2O
(3) D S2O+2H+=S↓+SO2↑+H2O
(4)①5H2C2O4+2MnO+6H+=2Mn2++10CO2↑+8H2O
②2m L 确保每次实验c(H2C2O4) c(H2SO4)不变
③1.5 mol·L·min
20、 // 2 // 4×10-8 L/(mol·s)// 2a-b// // < // 加入催化剂 // 28.8 // 增大
21 、 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O // 3NO2+H2O===2H++2NO+NO
// 氧气 // 红(或“血红”) // Fe3++3SCNFe(SCN)3
CH4(g)+2NO2(g)===N2(g)+2H2O(g)+CO2(g) ΔH=-957.3 kJ·mol-1