- 2021-08-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
宁夏银川一中2016-2017学年高一上学期期中考试 化学
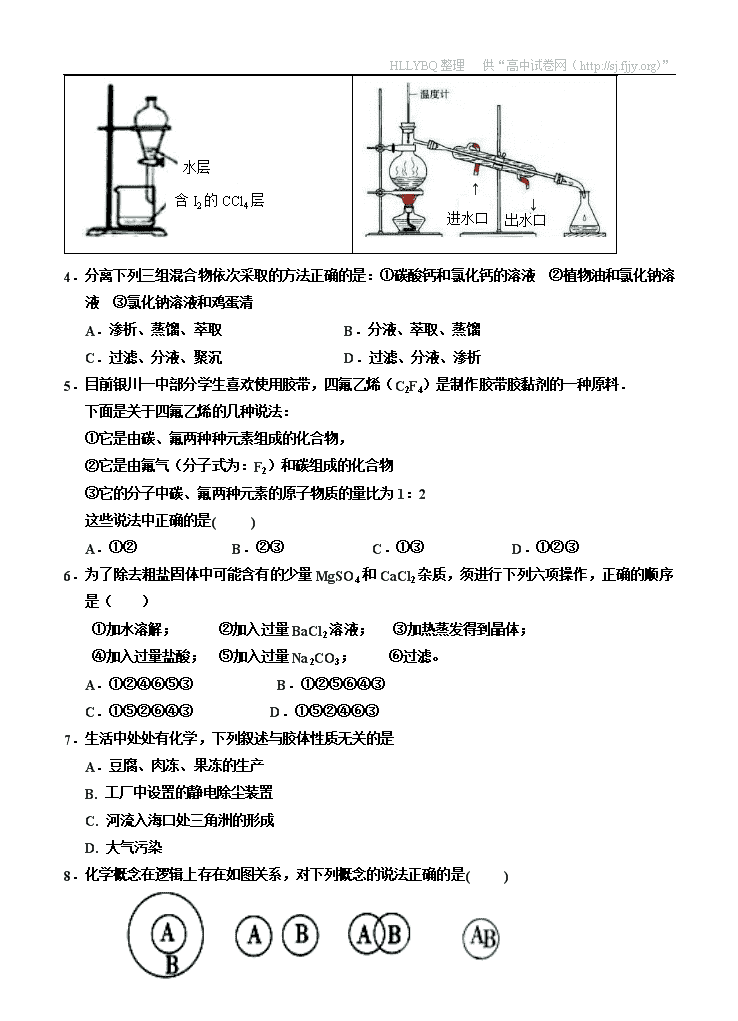
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)” 银川一中2016/2017学年度(上)高一期中考试 化 学 试 卷 命题人:武健超 常用到的元素的相对原子质量:H=1,N=14,O=16,Na=23,P=31,K=39,I=127,S=32 请各位认真认真、认真读题(重要的事情说三遍) 一、单项选择题(每题3分,共60分),将选择题的选项最终回答到最后的答题卡内, 否则按零分处理 1.生活环境逐渐恶化,人们日益重视环境问题,下列做法或说法正确的是( ) A.推广使用无磷洗衣粉,以减少水体富营养化 B.PM2.5是指大气中直径接近于2.5μm(1m=106μm =109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 C.为提高农作物产量大量使用农药和化肥 D.对农作物秸秆进行焚烧还田,以增加土壤肥力 2.下列有关化学实验安全问题的叙述中不正确的是( ) A.少量的浓硫酸或浓NaOH沾到皮肤上,应用大量的水反复冲洗,再涂抹相应的药品 B.氢气还原氧化铜,一般先预热氧化铜,然后再通入氢气 C.浓硝酸需用细口棕色试剂瓶密封保存 D.实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理。 3.下列有关实验操作正确的是: A. 配制0.1 mol/L NaOH 溶液 B. 蒸发NaCl溶液得到NaCl晶体 C. CCl4萃取碘水中的碘振荡后的分液操作 D. 蒸馏分离酒精溶液中的酒精操作 ·7· HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)” 含I2的CCl4层 水层 ↓ 出水口 ↑ 进水口 4.分离下列三组混合物依次采取的方法正确的是:①碳酸钙和氯化钙的溶液 ②植物油和氯化钠溶液 ③氯化钠溶液和鸡蛋清 A.渗析、蒸馏、萃取 B.分液、萃取、蒸馏 C.过滤、分液、聚沉 D.过滤、分液、渗析 5.目前银川一中部分学生喜欢使用胶带,四氟乙烯(C2F4)是制作胶带胶黏剂的一种原料. 下面是关于四氟乙烯的几种说法: ①它是由碳、氟两种种元素组成的化合物, ②它是由氟气(分子式为:F2)和碳组成的化合物 ③它的分子中碳、氟两种元素的原子物质的量比为1:2 这些说法中正确的是( ) A.①② B.②③ C.①③ D.①②③ 6.为了除去粗盐固体中可能含有的少量MgSO4和CaCl2杂质,须进行下列六项操作,正确的顺序是( ) ①加水溶解; ②加入过量BaCl2溶液; ③加热蒸发得到晶体; ④加入过量盐酸; ⑤加入过量Na2CO3; ⑥过滤。 A.①②④⑥⑤③ B.①②⑤⑥④③ C.①⑤②⑥④③ D.①⑤②④⑥③ 7.生活中处处有化学,下列叙述与胶体性质无关的是 A.豆腐、肉冻、果冻的生产 B. 工厂中设置的静电除尘装置 C. 河流入海口处三角洲的形成 D. 大气污染 8.化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( ) ·7· HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)” 包含关系 并列关系 交叉关系 重叠关系 A.化合物与氧化物属于交叉关系 B.单质与非电解质属于包含关系 C.溶液与分散系属于并列关系 D.化合物与电解质属于包含关系 9.等质量的CO和N2,下列叙述不正确的是( ) A.密度一定相同 B.分子数一定相同 C.原子数一定相同 D.物质的量一定相同 10.设NA为阿佛加德罗常数的数值,下列说法不正确的是 A.常温常压下,1.7g NH3含有NA个电子 B.标准状况下,22. 4L水中含H2O分子NA个 C.1mol Na完全反应生成NaOH时,失去NA个电子 D.常温常压下,22.4L CO2中含有的CO2分子数小于NA个 11.用NA表示阿伏伽德罗常数的值.下列判断正确的是( ) A.2g H2含有的氢原子数目为NA B.1L 1mol•L﹣1 KOH溶液中含有的钾离子数目为NA C.1mol Zn完全变为Zn2+失去的电子数目为NA D.常温常压下,22.4L O2含有的分子数目为NA 12.在含NaCl、MgCl2、MgSO4的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl﹣)=0.2mol/L,则c(SO42﹣)为( ) A.0.20 mol/L B.0.10 mol/L C.0.25 mol/L D.0.15 mol/L 13.下列离子方程式书写正确的是( ) A.向澄清石灰水中通入足量二氧化碳:2OH‾+CO2=CO32‾+H2O B.氧化钠投入水中发生反应:O2‾+H2O=2OH‾ C.醋酸溶液滴入到NaOH溶液中:CH3COOH+ OH‾= CH3COO‾+H2O D.铁和稀盐酸反应制氢气:2Fe+6H+=2Fe3++3H2↑ 14.将30mL0.5mol/L 的NaOH溶液加水稀释到500mL,所得溶液的物质的量浓度为( ) A.0.05mol/L B.0.03mol/L C.0.3mol/L D.0.04mol/L ·7· HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)” 15.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH2K2FeO4+6KCl+8H2O.下列有关该反应说法正确的是( ) A.钾元素化合价降低 B.Fe(OH)3发生氧化反应 C.该反应是置换反应 D.Cl2是还原剂 16.某无色透明溶液中,能大量共存的离子组是( ) A.Cu2+、Na+、SO42-、Cl- B.Ba2+、Na+、OH-、SO42- C.OH-、HCO3-、Fe3+、Na+ D.K+、Na+、OH-、NO3- 17.将BaCl2溶液加入某无色溶液后,生成白色沉淀,再加入稀HNO3 ,则沉淀不溶解。下列说法正确的是( ) A.一定存在Ag+ B.一定存在CO32- C.一定存在SO42- D.以上说法都不对 18.以下说法正确的是( ) A.还原剂中必定有元素化合价升高被氧化 B.通电后,氢氧化铁胶体向阴极运动 C.物质所含元素化合价升高的反应叫还原反应 D.胶体与其他分散系的本质区别是可以发生丁达尔效应 19.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:SO2+2Fe3++2H2O===SO42-+4H++2Fe2+, Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。 下列说法正确的是( ) A.Cr2O72-不能将SO2氧化 B.还原性:Cr3+>Fe2+>SO2 C.氧化性:Cr2O72->Fe3+>SO2 D.两个反应中Fe3+均表现还原性 20.对于反应3Br2+6NaOH═5NaBr+NaBrO3+3H2O,以下叙述正确的是( ) A.Br2是氧化剂,NaOH是还原剂 B.Br2既是氧化剂又是还原剂 C.被氧化的Br原子和被还原的Br原子的物质的量的比为5:1 D.每生成1mol的NaBrO3转移10mol的电子 姓名__________ 班级__________ 学号________ 一、选择题答题卡 题号 1 2 3 4 5 6 7 8 9 10 答案 ·7· HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)” 题号 11 12 13 14 15 16 17 18 19 20 答案 二、非选择题(共20分)(送分题,细心踏实拿满分) 21.(6分) 下列物质:①Fe ②CO2 ③NaCl溶液 ④Cu(OH)2 ⑤熔融的MgCl2 ⑥NH4Cl溶液 ⑦盐酸 ⑧C2H5OH(酒精)(用序号作答)。 其中属于电解质的有 ,属于非电解质的有 ,能导电的有___________________________。 22.(8分) (1)4.5 g水与 g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是 。 (2)3.01×1023个OH— 的物质的量为 mol,含有电子的物质的量为 mol,这些OH— 和 g Na+ 含有的电子数相同。 (3)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为______mol/L。从中取出10mL,其物质的量浓度为 mol/L,稀释成100mL后,溶液的浓度为_____________mol/L 23.(6分) 实验室里常用浓盐酸跟高锰酸钾反应来制取少量氯气,反应的化学方程式为: 2KMnO4 + 16HCl(浓)== 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O 。 (1)将上述方程式改写为离子方程式:________________________________。 (2)反应中体现了浓盐酸的____________、_________________。(填性质) (3) 若反应中产生了的Cl2气体的体积(标准状况下)为4.48L,则该反应中转移电子的物质的量是_____mol,作氧化剂的浓盐酸是______mol. 三、实验题(10分) 24.碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4 (1)改写成离子反应方程式后,并用双线桥表示该反应中电子转移的方向和数目: 该反应中氧化产物与还原产物的质量比是______________,21.4 g KIO3参加反应时转移电子_________mol ·7· HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)” (2)实验结束后分离I2和K2SO4溶液所用的试剂是____________ A.Na2SO4溶液 B.酒精 C. CCl4 D.食盐水 所用的分离方法是 ,所用的玻璃仪器有 ,出现什么现象可以确定该食盐中含碘 . (3)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的稀硫酸溶液450mL,需用98%的浓硫酸(其密度为1.84g/cm3) mL,配制中需要用到的主要玻璃仪器是(填序号) . A.100mL量筒 B.托盘天平 C.玻璃棒 D.100 mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶 (4)下面操作造成所配稀硫酸溶液浓度偏高的是_____________ A.溶解的时候溶液没有冷却到室温就转移 B.转移时没有洗涤烧杯、玻璃棒 C.向容量瓶加水定容时眼睛俯视液面 D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶 E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线 25.(10分) 为了能观察到丁达尔效应,一中鼹鼠科学社的同学在实验室制备Fe(OH)3胶体。 (1)胶体与其它分散系的本质区别是:_________________________________。 (2)制备时,将_________________逐滴滴加至_________________中,待液体呈____________后,停止加热;反应方程式为_______________________________________。 (3)有一种橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,这叫____________现象,证明Sb2S3胶粒带_________电荷。 (4)如何设计实验验证制得的氢氧化铁是胶体:_______________________________。 ·7· HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)” 欢迎访问“高中试卷网”——http://sj.fjjy.org ·7·查看更多