2019-2020学年河南省郑州市第一中学高二上学期入学测试化学试题 (Word版)
河南省郑州市第一中学2019-2020学年高二上学期入学测试化学试卷
一、选择题(共 16 小题,每题 3 分,共 48 分)
1. X、Y、Z、M、W 为五种短周期元素。X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15,X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状况下的密度为
0.76 g/L;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是A.原子半径:W>Z>Y>X>M
B. XZ2、X2M2、W2Z2 均为直线型的共价化合物
C. 由 X 元素形成的单质在自然条件下有多种同素异形体存在
D. 由 X、Y、Z、M 四种元素形成的化合物一定既有离子键,又有共价键
2. W、X、Y、Z 均为的短周期主族元素,原子序数依次增加且原子核外 L 电子层的电子数分别为 0、5、8、8,它们的最外层电子数之和为 18。下列说法正确的是
A. 单质的沸点:W>X B.阴离子的还原性:W>Z
C.氧化物对应水化物的酸性:Y
ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
7. 下列关于如图所示转化关系(X 代表卤素)的说法错误的是( ) A.ΔH3<0
B. ΔH1=ΔH2+ΔH3
C. 按 Cl、Br、I 的顺序,ΔH2 依次增大
D. ΔH1 越小,HX 越稳定
)
)
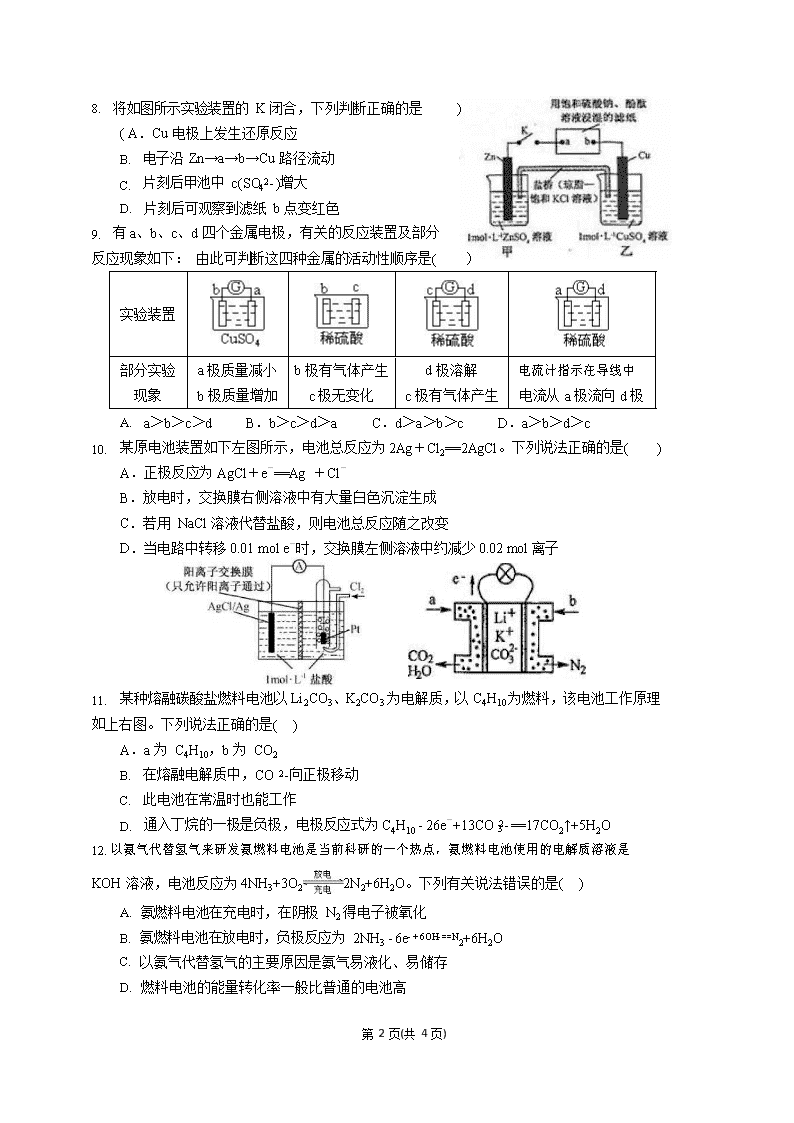
4. 将如图所示实验装置的 K 闭合,下列判断正确的是( A.Cu 电极上发生还原反应
B. 电子沿 Zn→a→b→Cu 路径流动
C. 片刻后甲池中 c(SO42- )增大
D. 片刻后可观察到滤纸 b 点变红色
实验装置
部分实验
现象
a 极质量减小
b 极质量增加
b 极有气体产生
c 极无变化
d 极溶解
c 极有气体产生
电流计指示在导线中
电流从 a 极流向 d 极
5. 有 a、b、c、d 四个金属电极,有关的反应装置及部分反应现象如下: 由此可判断这四种金属的活动性顺序是(
A. a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
6. 某原电池装置如下左图所示,电池总反应为 2Ag+Cl2==2AgCl。下列说法正确的是( ) A.正极反应为 AgCl+e-==Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变
D.当电路中转移 0.01 mol e-时,交换膜左侧溶液中约减少 0.02 mol 离子
7. 某种熔融碳酸盐燃料电池以 Li2CO3、K2CO3 为电解质,以 C4H10 为燃料,该电池工作原理如上右图。下列说法正确的是( )
A.a 为 C4H10,b 为 CO2
B. 在熔融电解质中,CO 2-向正极移动
C. 此电池在常温时也能工作
3
D. 通入丁烷的一极是负极,电极反应式为 C4H10 - 26e-+13CO 2- ==17CO2↑+5H2O
8. 以氨气代替氢气来研发氨燃料电池是当前科研的一个热点,氨燃料电池使用的电解质溶液是KOH 溶液,电池反应为 4NH3+3O22N2+6H2O。下列有关说法错误的是( )
A. 氨燃料电池在充电时,在阴极 N2 得电子被氧化
B. 氨燃料电池在放电时,负极反应为 2NH3 - 6e- + 6OH- ==N2+6H2O
C. 以氨气代替氢气的主要原因是氨气易液化、易储存
D. 燃料电池的能量转化率一般比普通的电池高
第 2 页(共 4 页)
4. Cu2O 是一种半导体材料,基于绿色化学理念设计的制取 Cu2O 的电解池示意图如下图所示, 电解总反应为:2Cu+H2O Cu2O+H2↑。下列说法正确的是 ( )
A. 铜电极发生还原反应 B.石墨电极上产生氢气 C.铜电极接直流电源的负极
D.当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成
5. 如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况),图①中 a、b 为惰性电极。则下列说法正确的是( )
A. 电解过程中,b 电极表面先有红色物质析出,后有气泡产生
B.a 电极上发生的反应方程式为 2H+ +2e- =H2 和 4OH- - 4e- == 2H2Ο+O2
C.曲线 OP 段表示 H2 和 O2 混合气体的体积变化,曲线 PQ 段表示 O2 的体积变化
D.从开始到 Q 点时收集到的混合气体的平均摩尔质量为 l7 g·mol-1
15.如图所示,甲池的总反应式为:N2H4+O2 == N2+2H2O,下列说法正确的是( ) A.该装置工作时,Ag 电极上有气体生成
B.甲池中负极反应为 N2H4 - 4e- == N2+4H+ C.甲池和乙池中的溶液的 pH 均减小
D.当甲池中消耗 0.1 mol N2H4 时,乙池中理论上最多产生 6.4g 固体
)
16. 控制适合的条件,将反应 Fe3++Ag Ag+ + Fe2+设计成如下图所示的原电池,盐桥中电解质为 KCl,开始时电流计指针向右偏转。下列判断正确的是(
A.在外电路中,电子由石墨电极经导线流向银电极B.盐桥中的 K+移向乙烧杯
C.一段时间后,电流计指针反向偏转,越过 0 刻度, 向左边偏转
D.电流计指针居中后,在甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 二、填空题(每空 2 分,共 52 分)
17.(18 分)A、B、C 为短周期元素,在周期表中所处的位置如图所示.A、C 两元素的原子核外
电子数之和等于 B 原子的质子数。
(1) 写出 A、B、C 三种元素的元素符号: 、 、 。
(2) B 元素位于元素周期表中的 周期 族
(3) C 的原子结构示意图是 ,C 的单质与水反应的化学反应方程式为 。
(4) 比较 B、C 的原子半径 B C,写出过量 A 的简单气态氢化物与 B 的最高价氧化物对应的水化物反应的化学反应方程式 。
18.(12 分)氯碱工业中电解饱和食盐水流程及原理示意图如下图所示。
(1) 为了有效除去粗盐中混有的 Ca2+、Mg2+、SO 2-,下列选项中所加试剂(均为溶液)及加入顺序均合理的是 (填选项字母,每步操作后都接有过滤过程)。
A. 先加足量 Ba(OH)2,再加足量 Na2CO3,最后加入适量稀盐酸
B. 先加足量 NaOH,再加足量 Na2CO3,然后加足量 BaCl2,最后加入适量稀盐酸
C. 先加足量 Na2CO3,再加足量 BaCl2,然后加足量 NaOH,最后加入适量稀盐酸
D. 先加足量 Ba(NO3)2,再加足量 NaOH,然后加足量 Na2CO3,最后加入适量稀盐酸(2)生成 H2 的电极反应式是 。
(3) 通过交换膜的离子主要是 ,向 (填“E”或“F”)方向移动,溶液 A 的浓度变化为 (填“增大”、“减小”或“不变”)。
(4) 电解饱和食盐水总反应的离子方程式是 。 19.(8 分)请参考题中图表,已知 E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1) 图Ⅰ是 1mol NO2 (g)和 1mol CO (g)反应生成 CO2 (g)和 NO (g)过程中的能量变化示意图, 若在反应体系中加入催化剂,反应速率增大,E1 的变化是 (填“增大”、“减小”或“不变”, 下同),△H 的变化是 请写出 NO2 和 CO 反应的热化学方
程式: 。
(2) 将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)═=CO2(g)+3H2(g) △H = +49.0 kJ·mol-1
②CH3OH(g)+0.5O2(g)═CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
又知③H2O(g) ═ H2O(l) △H = -44 kJ·mol-1,写出表示甲醇蒸
汽燃烧热的热化学方程式为: 。
20.(14 分)如图为相互串联的甲、乙两电解池.试回答:
(1) 若甲电解池利用电解原理在铁上镀银,则 A 是 、 (填电极材料和电极名称), 电极反应方程式为 ;应选用的电解质溶液是 。
(2) 乙池中滴入少量酚酞试液,电解一段时间后,铁极附近呈
色。C 极生成的物质为 色。
(3) 一段时间后若甲池阴极增重 4.32g,则乙槽中放出的气体在标准状况下的体积是 mL。
21 届高二上期入学测试化学参考答案
一、选择题
1
2
3
4
5
6
7
8
C
B
D
B
D
B
C
A
9
10
11
12
13
14
15
16
C
D
D
A
B
D
C
D
二、填空题
17.(1) N;S;F;
(2) 三;VIA;
(3) ;2F2 +2H2O=4HF+O2;
(4) >;2NH3+H2SO4=(NH4)2SO4
18.(1) A
(2) 2H2O+2e-==2OH-+H2↑;
(3) Na+;F;增大;
(4) 2Cl- +2H2O2OH- +H2↑+Cl2↑
19.(1)减小;不变;NO2(g)+CO(g) == CO2(g)+NO(g) △H= -234 kJ·mol-1 (2) CH3OH(g)+3/2O2(g) == CO2(g)+2H2O(l) △H= -764.7 kJ·mol-1
20.(1) 铁;阴极;Ag+ + e- == Ag;AgNO3 溶液;
(2) 红;浅黄绿色;
(3) 896