- 2021-07-09 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
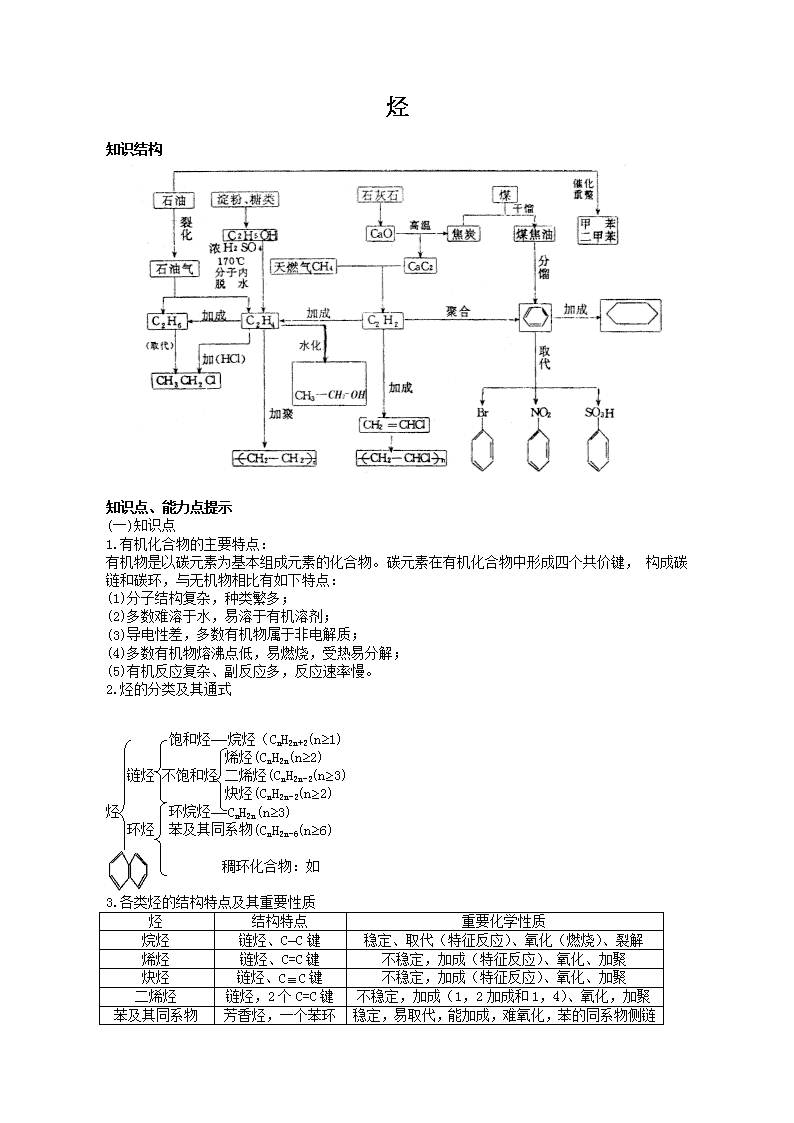
2019届高考化学一轮复习常见的有机化合物学案
烃 知识结构 知识点、能力点提示 (一)知识点 1.有机化合物的主要特点: 有机物是以碳元素为基本组成元素的化合物。碳元素在有机化合物中形成四个共价键, 构成碳链和碳环,与无机物相比有如下特点: (1)分子结构复杂,种类繁多; (2)多数难溶于水,易溶于有机溶剂; (3)导电性差,多数有机物属于非电解质; (4)多数有机物熔沸点低,易燃烧,受热易分解; (5)有机反应复杂、副反应多,反应速率慢。 2.烃的分类及其通式 饱和烃——烷烃(CnH2n+2(n≥1) 烯烃(CnH2n(n≥2) 链烃 不饱和烃 二烯烃(CnH2n-2(n≥3) 炔烃(CnH2n-2(n≥2) 烃 环烷烃——CnH2n(n≥3) 环烃 苯及其同系物(CnH2n-6(n≥6) 稠环化合物:如 3.各类烃的结构特点及其重要性质 烃 结构特点 重要化学性质 烷烃 链烃、C—C键 稳定、取代(特征反应)、氧化(燃烧)、裂解 烯烃 链烃、C=C键 不稳定,加成(特征反应)、氧化、加聚 炔烃 链烃、CC键 不稳定,加成(特征反应)、氧化、加聚 二烯烃 链烃,2个C=C键 不稳定,加成(1,2加成和1,4)、氧化,加聚 苯及其同系物 芳香烃,一个苯环 稳定,易取代,能加成,难氧化,苯的同系物侧链易被酸性KmnO4溶液氧化 4.同系物与同分异构体 (1)同系物:结构相似,在分子组成上相差一个或几个CH2原子团的物质互称为同系物。注意烷烃和环烷烃、烯烃和二烯烃不互为同系物。 (2)同分异构体:组成(分子式)相同,结构不同的化合物互称为同分异构体。因此碳原子数相同的烯烃和环烷烃、炔烃和二烯烃互为同分异构体。 5.烃的系统命名法 (1)烷烃:以含碳原子数最多的碳链为主链,称某烷;若碳链上有取代基则作为支链,距支链较近的一端为起点对碳原子编号命名。若有多个取代基时,按由小到大顺序命名。 (2)烯烃和炔烃:以含碳碳双键或碳碳叁键的最长碳链为主链命名为某烯或某炔;从距C=C 或C≡C较近的一端为起点对主链碳原子编号;取代基名称写在前面,取代基和双键、叁键的个数用中文二、三等标出,并用阿拉伯数字1,2等标明C=C或C≡C所在位置。如: CH3—CCH—CH3 名称:2—甲基 —2—丁烯. CH3 (3)苯及其同系物:以苯环为母体,先命取代基,再命名苯环,如: —CH3 甲 苯 —CH2CH3乙苯 6.煤和石油 (1)石油是由各种烷烃、环烷烃和芳香烃组成的复杂混合物; (2)石油的分馏原理; (3)石油裂化和裂解的目的; (4)煤的干馏和干馏产物. 7.有关计算 (1)通过计算判断或确定烃的分子组成和结构; (2)通过烃的燃烧反应,计算烃、耗氧量和产物之间的数量关系。 8.甲烷、乙烯、乙炔的实验室制法及注意事项。 (二)能力点提示: 1.几种气态烃的实验室制法: (1)制甲烷 COONa+NaO CH3 H CH4↑+Na2CO3 要注意断键部位,这也正是要在无水环境中进行的原因;该反应是减少一个碳原子的反应, 如: 制乙烷 CH3CH2COONa+NaOHC2H6↑+Na2CO3 制苯 C5H5COONa+NaOHC6H6+Na2CO3 (2)制乙烯 要注意温度控制在170℃左右;该反应是单键变双键的一种反应,如用异丙醇制丙烯: H—C C C—H OH H H (3)制乙炔 电石与水反应制乙炔时,常伴有特殊难闻的气味,是因为发生以下反应所至: CaS+2H2OCa(OH)2+H2S Ca3P2+6H2O3Ca(OH)2+2PH3 Ca3As2+6H2O3Ca(OH)2+2AsH3↑ 2.取代反应的特征 在与卤素单质发生取代反应的过程中,烷烃分子每去掉一个氢原子换上一个卤素原子要消耗 1个卤素分子,另外一个卤素原子则与换下来的氢原子结合生成卤化氢(这一点与加成反应是 不同的)。因此烷烃与卤素单质发生取代反应的最大物质的量之比为:CnH2n+2~(2 n+2)X2(卤素单质) 3.加聚反应的书写及高聚物单体的判断 (1)加聚反应的写法: ①单烯烃的加聚反应为: n CHCH CH—CH R1 R2 R1 R2 ②共轭二烯烃的加聚反应为: n CH CH—CCH2 CH—CHC—CH2 A B A B (R1、R2、A、B可以是-H、-CH3、-C2H5或其它基团) ③不同单体加聚时还要考虑可能有不同的连接方式。例如苯乙烯与乙烯间的加聚反应: n —CH CH2+nCH2CH2 CH—CH2—CH2—CH2 或 CH2—CH—CH2—CH2 (2)高聚物单体的判断 ①聚乙烯型 链节为两个碳原子的,则其单体看作乙烯型,如: CH2—CH 单体为CH2 CH—CH3 CH3 CH2—CH 单体为CH2 CH— CH—CH 单体为 R1—CH CH—R2 R1 R2 ②1,3—丁二烯型 链节为四个碳原子,且2,3碳原子间有C=C,则应对应1,3—丁二烯找单体,如: CH2—CH C—CH2 CH3 单体为CH2 CH—C CH2 CH3 CH—C CH—CH 单体为 CH C—CH CH R1 R2 R3 R1 R2 R3 ③混合型 (ⅰ)当链节有四个碳原子,且C、C间无C=C时,应视为含有2个乙烯型单体,如: CN CH2—CH2—CH—CH2 单体为CH2 CH2 CH2 CH—CN (ⅱ)当链节更长时,首先看有无C C ,若有,则与C C相边的左 右各一个C原子,共同看作1,3—丁二烯型,其余C原子每两个看作一个乙烯型结构。如: R1 R2 CH2—CH—CH2—CH CH—CH2—CH—CH2 单体为:CH2 CH—R1 CH2 CH—CH CH2 CH2 CH—R2 4.同分异构体的书写 (1)同分异构体书写通常是按碳链异构 位置异构 官能团异构的顺序书写,也可 按官能团异构 碳链异构 位置异构的顺序书写。例如写出分子式为C4H8的同分异构体时,首先按碳链异构写出:①CH2=CH—CH2—CH3 1—丁烯 ②CH2 =C —CH3 乙—甲基—1—丙烯,再按位置异 构写有:③CH3—CH=CH—CH3 2—丁烯 CH3 ④CH3—C=CH2 与②式相同排除,最后按官能团异构写有:④ CH3 CH2 —CH2 CH2 CH2 CH2环丁烷 ⑤CH2 ——CH—CH3甲基环丙烷。注意,烷烃没有官能团异构和位置异构,只有碳链异构,因此,碳原子数相同烷烃 和不饱和烃相比,其同分异构体数目要少。 (2)苯环上同分异构体的书写 ①苯和甲苯都没有同分异构体,乙苯等其他苯的同系物,由于取代基在苯环上的相对位置不同因此存在同分异构体。 分子式为C8H10的同分异构体有四种: —C2H5 乙苯 邻二甲苯 CH3 CH3 间二甲苯 CH3—CH3 对二甲苯 分已式这C9H12 的同分异构体有8种:+ 分子式为C9H12的同分异构体有8种: ②苯的同系物被一个原子团取代,如: 对二甲苯的一氯代物: 判断因取代基位置不同而形成的同分异构体时可采用“对称轴”法。即在被取代的主体结构中,划对称轴,取代茎只能在对称轴的一侧,或是在对称轴上而不能越过对称轴(针对一元取代物而言)。如二甲苯的对称轴如下(虚线表示): 邻二甲苯 间二甲苯 (小圆圈表示能被取代的位置) 对二甲苯 因此,邻、间、对二甲苯苯环上的一元取代物分别有2、3、1种。 5.计算并推断烃的分子式及其结构简式 注: (1)气体摩尔质量=22.4L/mol ×dg/L(d为标准状况下气体密度). (2)某气体对A气体的相对密度为DA,则该气体式量M=MADA. (3)由烃的分子量求分子式的方法: ①M/14,能除尽,可推知为烯烃或环烷烃,其商为碳原子数; ②M/14,余2能除尽,可推知为烷烃,其商为碳原子数; ③M/14,差2能除尽,推知为炔烃或二烯烃或环烯烃,其商为碳原子数。 ④M/14,差6能除尽,推知为苯或苯的同系物。 6.烃完全燃烧的有关规律 (1)等物质的量的烃(CnHm)完全燃烧时,耗氧量的多少决定于n+的值,n+的值越大,耗氧量越多,反之越少。 (2)等质量的烃(CnHm)完全燃烧时,耗氧量的多少决定于氢的质量分数,即的值,越大,耗氧量越多,反之越少。 (3)等质量的烃(CnHm)完全燃烧时,碳的质量分数越大,生成的CO2越多,氢的质量分数越大,生成的H2O越多。 (4)最简式相同的烃无论以何种比例混合,都有:①混合物中碳氢元素的质量比及质量分数 不变;②一定质量的混合烃完全燃烧时消耗O2的质量不变,生成的CO2的质量均不变。 (5)对于分子式为CnHm的烃: ①当m=4时,完全燃烧前后物质的量不变; ②当m<4时,完全燃烧后物质的量减少; ③当m>4时,完全燃烧后物质的量增加. 7.各类烃与H2加成的物质的量之比: 不饱和烃 与H2加成的最大物质的量之比 烯烃 1∶1 二烯烃 1∶2 炔烃 1∶2 苯及其同系物 1∶3 苯乙烯 —CH CH2 1∶4 8.二烯烃1,4加成的规律: 9.根据烃的分子式推断其可能具有的结构 从烷烃通式CnH2n+2出发,分子中每形成一个C=C键或形成一个环,则减少2个氢原 子;分子中每形成一个C≡C键,则减少4个氢原子。依此规律可由烃的分子式推测其可能具有的结构,再由其性质可确定其结构简式。例如分子式为C5H8的烃可与等物质的量Br2加成,试推测其可能的结构并写出其结构简式.先根据其分子组成可知其分子比对应的C5H12少4个氢原子,可能是二烯烃、炔烃或环烯烃,再根据其与Br2的加成比例可知 其为环烯烃,结构简式为 查看更多