- 2021-07-08 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
选修4第三章第一节:弱电解质的电离1
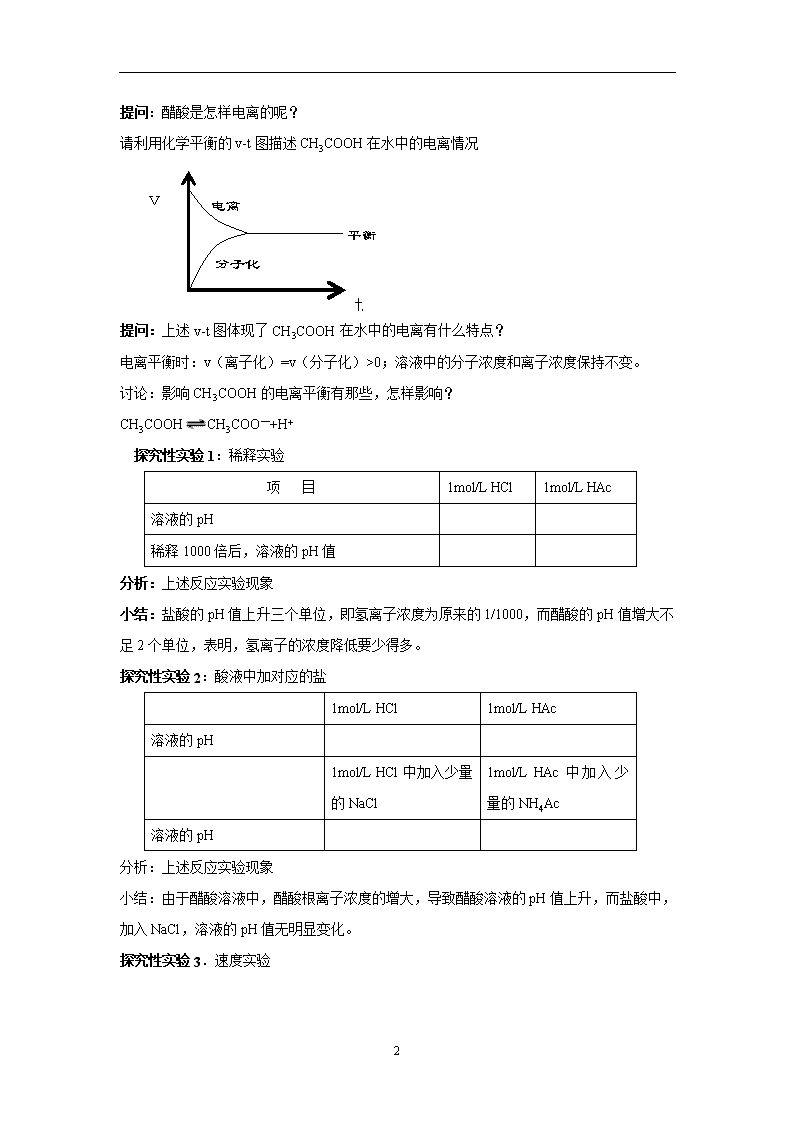
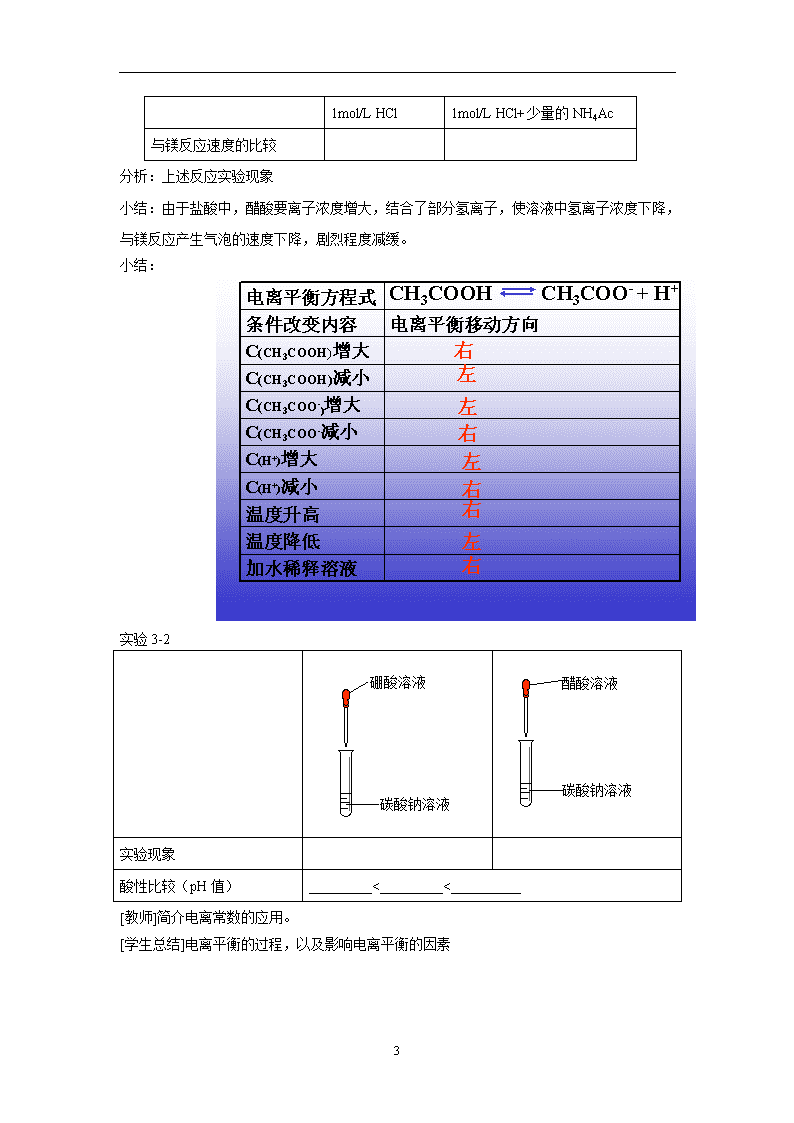
1 第一节 弱电解质的电离 教学目标: 1、了解强电解质和弱电解质与结构的关系。 2、能描述弱电解质在水溶液中的电离平衡,了解酸碱电离理论。 3、认识浓度等条件对电离平衡的影响。 教学重点: 强、弱电解质的概念和弱电解质的电离平衡 教学难点: 弱电解质的电离平衡 教学过程: 复习: 1、请写出盐酸、硫酸的电离方程式。 2、化学平衡建立的条件是什么? 3、化学反应的限度决定于什么?受那些条件影响? 引入: 酸、碱、盐都是电解质,在水中都能电离出离子。不同的电解质的电离程度是否有区别? 实验: 1)实验中先测反应前溶液的 pH 值,再进行与镁条的反应。 2)用锥形瓶进行实验,瓶中先放酸液,后同时投放等量镁片,然后迅速套上汽球,观察现 象。 3)分两部分讨论,从定性角度分析强弱电解质的区别与表现。 项 目 1mol/L HCl 1mol/L HAc 溶液的 pH 与足量镁条反应产生气泡的速度比较 与足量镁条反应产生氢气的物质的量的比较 小结: 1、强的电解质:能全部电离的电解质。 如强酸、强碱和盐。 HCl == H+ + Cl- Na2SO4 ==2 Na+ + SO42- 2、弱的电解质:能部分电离的电解质。 如弱酸、弱碱。 CH3COOH CH3COO- +H+ 2 提问:醋酸是怎样电离的呢? 请利用化学平衡的 v-t 图描述 CH3COOH 在水中的电离情况 提问:上述 v-t 图体现了 CH3COOH 在水中的电离有什么特点? 电离平衡时:v(离子化)=v(分子化)>0;溶液中的分子浓度和离子浓度保持不变。 讨论:影响 CH3COOH 的电离平衡有那些,怎样影响? CH3COOH CH3COO—+H+ 探究性实验 1:稀释实验 项 目 1mol/L HCl 1mol/L HAc 溶液的 pH 稀释 1000 倍后,溶液的 pH 值 分析:上述反应实验现象 小结:盐酸的 pH 值上升三个单位,即氢离子浓度为原来的 1/1000,而醋酸的 pH 值增大不 足 2 个单位,表明,氢离子的浓度降低要少得多。 探究性实验 2:酸液中加对应的盐 1mol/L HCl 1mol/L HAc 溶液的 pH 1mol/L HCl 中加入少量 的 NaCl 1mol/L HAc 中 加 入 少 量的 NH4Ac 溶液的 pH 分析:上述反应实验现象 小结:由于醋酸溶液中,醋酸根离子浓度的增大,导致醋酸溶液的 pH 值上升,而盐酸中, 加入 NaCl,溶液的 pH 值无明显变化。 探究性实验 3.速度实验 v t 电离 分子化 平衡 3 1mol/L HCl 1mol/L HCl+少量的 NH4Ac 与镁反应速度的比较 分析:上述反应实验现象 小结:由于盐酸中,醋酸要离子浓度增大,结合了部分氢离子,使溶液中氢离子浓度下降, 与镁反应产生气泡的速度下降,剧烈程度减缓。 小结: 实验 3-2 实验现象 酸性比较(pH 值) _________<_________<__________ [教师]简介电离常数的应用。 [学生总结]电离平衡的过程,以及影响电离平衡的因素 加水稀释溶液 温度降低 温度升高 C(H+)减小 C(H+)增大 C(CH3COO-减小 C(CH3COO- )增大 C(CH3COOH)减小 C(CH3COOH)增大 电离平衡移动方向条件改变内容 电离平衡方程式 CH3COOH CH3COO- + H+ 右 左 左 左 左 右 右 右 右 硼酸溶液 碳酸钠溶液 碳酸钠溶液 醋酸溶液查看更多