- 2021-07-08 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省 2013 高考化学 冲刺训练 2.3 化学反应速率和化学平衡
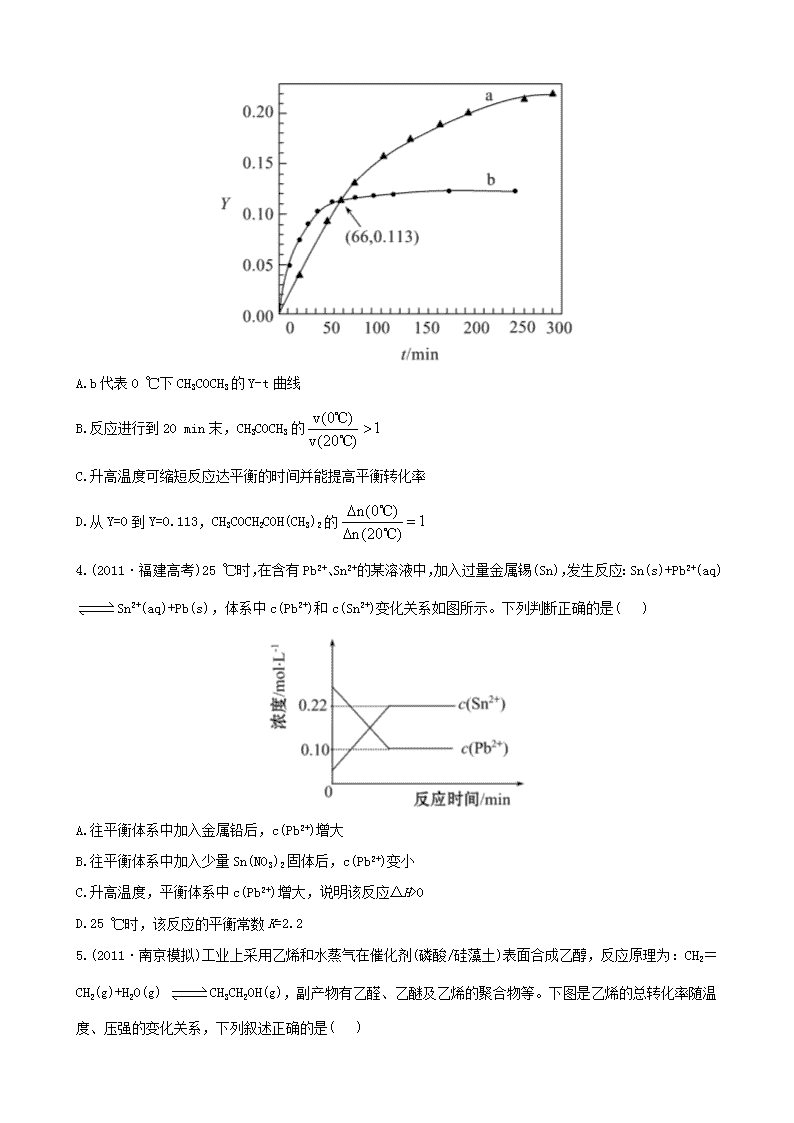
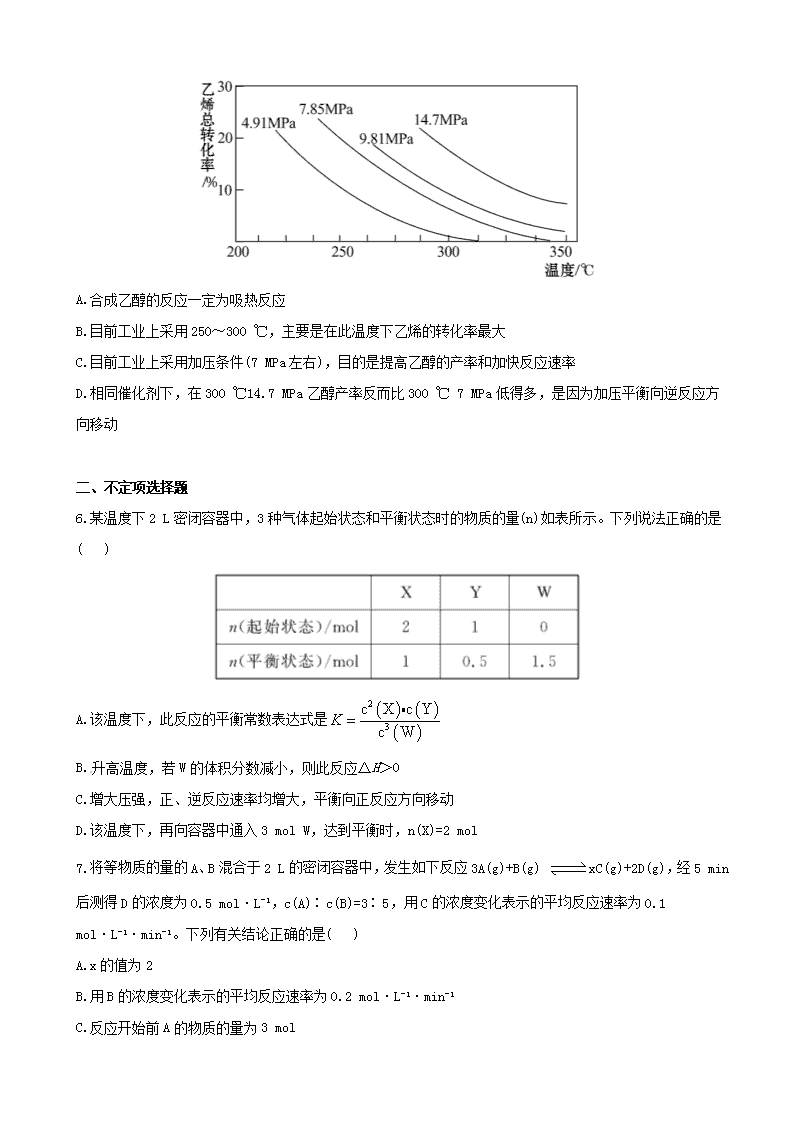
江苏省 2013 高考化学 冲刺训练 2.3 化学反应速率和化学平衡 一、单项选择题 1.把在空气中久置的铝片 5.0 g 投入盛有 500 mL 0.5 mol·L-1 硫酸溶液的烧杯中,该铝片与硫酸反应产生 氢气的速率 v 与反应时间 t 可用如图的坐标曲线来表示:下列推论错误的是( ) A.t 由 O→a 段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 B.t 由 b→c 段产生氢气的速率增加较快的主要原因之一是温度升高 C.t>c 产生氢气的速率降低主要是因为溶液中 c(H+)降低 D.t=c 时反应处于平衡状态 2.在恒温、恒压下,a mol A 和 b mol B 在一个容积可变的容器中发生反应:A(g)+2B(g) 2C(g), 一段时间后达到平衡,生成 n mol C。则下列说法中正确的是( ) A.物质 A、B 的转化率之比为 1∶2 B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-n/2) C.当 2v 正(A)=v 逆(B)时,反应一定达到平衡状态 D.充入惰性气体(如 Ar),平衡向正反应方向移动 3.(2011·北京高考)已知反应:2CH3COCH3(l) 催化剂 CH3COCH2COH(CH3)2(l)。取等量 CH3COCH3 分别在 0 ℃和 20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是( ) A.b 代表 0 ℃下 CH3COCH3 的 Y-t 曲线 B.反应进行到 20 min 末,CH3COCH3 的 v(0 ) 1v(20 ) ℃ ℃ C.升高温度可缩短反应达平衡的时间并能提高平衡转化率 D.从 Y=0 到 Y=0.113,CH3COCH2COH(CH3)2 的 n(0 ) 1n(20 ) ℃ ℃ 4.(2011·福建高考)25 ℃时,在含有 Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中 c(Pb2+)和 c(Sn2+)变化关系如图所示。下列判断正确的是( ) A.往平衡体系中加入金属铅后,c(Pb2+)增大 B.往平衡体系中加入少量 Sn(NO3)2 固体后,c(Pb2+)变小 C.升高温度,平衡体系中 c(Pb2+)增大,说明该反应ΔH>0 D.25 ℃时,该反应的平衡常数 K=2.2 5.(2011·南京模拟)工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:CH2= CH2(g)+H2O(g) CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温 度、压强的变化关系,下列叙述正确的是( ) A.合成乙醇的反应一定为吸热反应 B.目前工业上采用 250~300 ℃,主要是在此温度下乙烯的转化率最大 C.目前工业上采用加压条件(7 MPa 左右),目的是提高乙醇的产率和加快反应速率 D.相同催化剂下,在 300 ℃14.7 MPa 乙醇产率反而比 300 ℃ 7 MPa 低得多,是因为加压平衡向逆反应方 向移动 二、不定项选择题 6.某温度下 2 L 密闭容器中,3 种气体起始状态和平衡状态时的物质的量(n)如表所示。下列说法正确的是 ( ) A.该温度下,此反应的平衡常数表达式是 2 3 c X c Y c W K B.升高温度,若 W 的体积分数减小,则此反应ΔH>0 C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动 D.该温度下,再向容器中通入 3 mol W,达到平衡时,n(X)=2 mol 7.将等物质的量的 A、B 混合于 2 L 的密闭容器中,发生如下反应 3A(g)+B(g) xC(g)+2D(g),经 5 min 后测得 D 的浓度为 0.5 mol·L-1,c(A)∶c(B)=3∶5,用 C 的浓度变化表示的平均反应速率为 0.1 mol·L-1·min-1。 下列有关结论正确的是( ) A.x 的值为 2 B.用 B 的浓度变化表示的平均反应速率为 0.2 mol·L-1·min-1 C.反应开始前 A 的物质的量为 3 mol D.5 min 时 A 的浓度为 0.2 mol·L-1 8.(2010·江苏高考)在温度、容积相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测 得反应达到平衡时的有关数据如下(已知 N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1): 下列说法正确的是( ) A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3<1 三、非选择题 9.(2011·无锡模拟)醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在的条 件下,分别以等量乙醇在不同温度下进行脱水实验获得的部分数据,每次实验反应时间均相同。 已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为 78.4 ℃和 34.6 ℃。试分析: (1)乙醇脱水制乙烯的反应是_______(填“放热”或“吸热”)反应,若增大压强,平衡_______(填“正向”、 “逆向”或“不”)移动。 (2)写出乙醇脱水制乙醚的反应的平衡常数表达式__________。当乙醇起始浓度相同时,平衡常数 K 值越 大,表明________(填序号)。 a.乙醇的转化率越高 b.反应进行得越完全 c.达到平衡时乙醇的浓度越大 d.化学反应速率越快 (3)根据表中数据分析,150 ℃时乙醇催化脱水制取的乙醚产量________(填“大于”、“小于”或“等于”)125 ℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是_________。 10.环境问题备受世界关注。化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体已 成为大气污染的主要因素。 (1)CO 中毒是由于 CO 与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为: CO+Hb·O2 O2+Hb·CO 实验表明,c(Hb·CO)即使只有 c(Hb·O2)的 1/50,也可造成人的智力损伤。 已知 t ℃时上述反应的平衡常数 K=200,吸入肺部 O2 的浓度约为 1.0× 10-2 mol·L-1,若使 c(Hb·CO)小于 c(Hb·O2)的 1/50,则吸入肺部的 CO 浓度不能超过________mol·L-1。 (2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”。 已知反应 2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113 kJ·mol-1 ①为了模拟催化转化器的工作原理,在 t ℃时,将 2 mol NO 与 1 mol CO 充入 1 L 反应容器中,反应过程 中 NO(g)、CO(g)、N2(g)物质的量浓度变化如图所示。反应进行到 15 min 时,NO 的平均反应速率为_______。 ②观察在 20~30 min 内 N2(g)发生变化的曲线图,判断引起该变化的条件可能是_______; a.加入催化剂 b.降低体系温度 c.缩小容器体积为 0.5 L d.增加 CO2 的物质的量 (3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。 已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如表: 试回答下列问题: ①上述正向反应是_______反应(填“放热”或“吸热”)。 ②某温度下上述反应平衡时,恒容、升高温度,正反应速率_______(填“增大”、“减小”或“不变”), 容器内混合气体的压强_______(填“增大”、“减小”或“不变”)。 ③在 830 ℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有_______(填 A、B、C、D)。 11.(2011·徐州模拟)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中 CO2 的含量及有效 地利用 CO2,引起了各国的普遍重视。 (1)目前,用超临界 CO2(其状态介于气态和液态之间)代替氟利昂作制冷剂已成为一种趋势,这一做法对环 境的积极意义在于__________________________。 (2)将 CO2 转化成有机物可有效实现碳循环。CO2 转化成有机物的例子很多,如: a.6CO2+6H2O 光合 作用 C6H12O6+6O2 b.CO2+3H2 催化剂 CH3OH+H2O c.CO2+CH4 催化剂 CH3COOH d.2CO2+6H2 催化剂 CH2=CH2+4H2O 以上反应中,最低碳环保的是_________,原子利用率最高的是________。 (3)为探究用 CO2 来生产燃料甲醇的反应原理,现进行如下实验:在体积为 1 L 的密闭容器中,充入 1 mol CO2 和 3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol 测得 CO2 和 CH3OH(g)的浓度随时间变化如图所示。 ①从反应开始到平衡,氢气的平均反应速率 v(H2)=_______。 ②该反应的平衡常数表达式为________________,升高温度,平衡常数的数值将_________(填“增大”、“减 小”或“不变”)。 ③下列措施中能使 n(CH3OH)/n(CO2)增大的是_________。 A.升高温度 B.充入 He(g),使体系压强增大 C.将 H2O(g)从体系中分离 D.再充入 1 mol CO2 和 3 mol H2 高考创新预测 1.在密闭容器中,有下列反应: N2(g)+3H2(g) 催化剂 高温高压 2NH3(g) ΔH=-93.4 kJ/mol 有关该反应的叙述正确的是( ) A.若混合气体中各成分的浓度不再变化,则该反应已达平衡状态 B.将 1 mol N2 和 3 mol H2 充分反应达到平衡时,放出的热量等于 93.4 kJ C.催化剂能缩短该反应达到平衡所需的时间,从而提高 N2 的转化率 D.缩小容器的体积,v(正)增大、v(逆)减小,平衡向右移动 2.将水煤气转化成合成气,然后通过一碳化工路线合成各种油品和石化产品具有广阔的前景,在未来相当 一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含 55%~59%的 H2,15%~18%的 CO,11%~13% 的 CO2,少量的 H2S、CH4,除去 H2S 后,可采用催化或非催化转化技术,将 CH4 转化成 CO,得到 CO、CO2 和 H2 的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。 水煤气法制甲醇工艺流程框图如下 (1)制水煤气的主要化学反应方程式为: C(s)+H2O(g) 高温 CO(g)+H2(g),此反应是吸热反应。 ①此反应的化学平衡常数表达式为__________________; ②下列能增大碳的转化率的措施是_______; A.加入 C(s) B.加入 H2O(g) C.升高温度 D.增大压强 (2)将 CH4 转化成 CO,工业上常采用催化转化技术,其反应原理为: CH4(g)+3/2O2(g) CO(g)+2H2O(g) ΔH=-519 kJ/mol。 工业上要选择合适的催化剂,分别对 X、Y、Z 三种催化剂进行如下实验(其他条件相同) ①X 在 T1 ℃时催化效率最高,能使正反应速率加快约 3×105 倍; ②Y 在 T2 ℃时催化效率最高,能使正反应速率加快约 3×105 倍; ③Z 在 T3 ℃时催化效率最高,能使逆反应速率加快约 1×106 倍; 已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是_______(填“X”、“Y”或“Z”), 选择的理由是_________________________; (3)合成气经压缩升温后进入 10 m3 甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g)+CO(g) CH3OH(g) ΔH=-90.8 kJ·mol-1,T4 ℃下此反应的平衡常数为 160。此温度下,在密 闭容器中加入 CO、H2,反应到某时刻测得各组分的浓度如下: ①比较此时正、逆反应速率的大小:v(正)______v(逆)(填“>”、“<”或“=”)。 ②若加入 CO、H2 后,在 T5 ℃反应 10 min 达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率 v(CH3OH)=_______mol·(L·min)-1。 (4)生产过程中,合成气要进行循环,其目的是____________________________。 答案解析 1.【解析】选 D。铝与硫酸的反应不是可逆反应,不存在化学平衡。 2.【解析】选 C。由于 a、b 数值之比不一定为 1∶2,故虽然转化的 A、B 物质的量之比为 1∶2,二者转化 率之比不一定为 1∶2,A 项错误;该容器为恒温、恒压,故 B 项错误;在恒温、恒压下,充入惰性气体(如 Ar),容器的容积变大,平衡向左移动,D 项错误。 3.【解析】选 D。 4.【解析】选 D。金属铅的浓度是定值,加入金属铅,平衡不移动,c(Pb2+)不变,A 选项错误;加入 Sn(NO3)2 固体后,增大了 c(Sn2+),平衡逆向移动,c(Pb2+)增大,B 选项错误;升高温度,c(Pb2+)增大,说明平衡逆 向移动,即逆反应吸热,则正反应放热,ΔH<0,C 选项错误;由图可知,平衡时 c(Sn2+)=0.22 mol·L-1, c(Pb2+)=0.10 mol·L-1,所以平衡常数 2 2 c Sn 2.2 c Pb = =K ,D 选项正确。 5.【解析】选 C。随温度升高乙烯的转化率减小,说明该反应为放热反应,故 A 项不正确;采用适当的温 度(250~300 ℃)是为了加快反应速率,而不是提高乙烯的转化率,故 B 项不正确;适当的加压既加快反 应速率,又使平衡向正向移动,提高乙醇的产率,故 C 项正确;300 ℃时高压比低压时乙醇产率反而低不 能从平衡移动角度解释,可能是副反应导致的,故 D 项不正确。 6.【解析】选 D。由表中数据可知化学反应方程式为 2X+Y 3W,平衡常数表达式为 3 2 c W c X c Y K , 故 A 项不正确;升高温度,若 W 的体积分数减小,说明该反应为放热反应,ΔH<0,故 B 项不正确;因为 反应前后气体分子数不变,增大压强平衡不移动,故 C 项不正确;该温度下,再向容器中通入 3 mol W, 可建立等效平衡,故在重新达到平衡时,n(X)=2 mol,D 项正确。 7.【解析】选 A、C。设起始 n(A)=n(B)=a mol 3A(g) + B(g) xC(g) + 2D(g) 起始(mol) a a 0 0 转化(mol) 1.5 0.5 1 1 5 min 时(mol) a-1.5 a-0.5 1 1 则 x 1 2 1 ,x=2 由 c(A)∶c(B)=3∶5 知 a 1.5 3 a 0.5 5 解得 a=3 5 min 时 13 1.5c A mol L2 =0.75 mol·L-1 v(B)= 0.5 2 5 mol·L-1·min-1 =0.05 mol·L-1·min-1 故选 A、C。 8.【解析】选 B、D。甲、乙达到的平衡是同一种化学平衡,所以 a+b=92.4, α1+α2=1,α3<α2,故α1+α3<1,丙可以看作是 2 个乙分别达到化学平衡后又加压形成的,由于加压后平 衡向气体体积减小的方向移动,所以 2c1<c3,2p2>p3;A、C 错。 9.【解析】(1)随温度的升高乙烯的平衡含量增大,说明生成乙烯的反应为吸热反应,由 CH3CH2OH(g) CH2 =CH2(g)+H2O(g)知,加压平衡逆向移动。 (2)由 2CH3CH2OH(g) CH3CH2OCH2CH3(g)+H2O(g)得平衡常数表达式 2 5 2 5 2 2 2 5 c C H OC H c H O c C H OH K ,平衡常数 K 值越大,表明乙醇的转化率越高、反应进行得越完全。 (3)若有 1 mol 乙醇,150℃时反应生成乙醚物质的量为 1 mol×68%×82.2%= 0.56 mol,125 ℃时反应生成乙醚物质的量为 1 mol×20%×90.2%=0.18 mol,可见 150 ℃时乙醇催化脱水 制取的乙醚产量大于 125℃时的乙醚产量。当温度更高时乙醚的产量反而减小,故合适的温度范围是 150~ 175℃ 答案:(1)吸热 逆向 (2) 2 5 2 5 2 2 2 5 c C H OC H c H O c C H OH K a、b (3)大于 150~175℃ 10.【解析】(1)根据已知条件 CO + Hb·O2 O2 + Hb·CO 平衡 c(CO) c(Hb·O2) 1.0×10-2 mol·L-1 c(Hb·CO) 2 2 c O c(Hb CO) 200c CO c(Hb O ) K 代入 2 c(Hb CO) 1 c(Hb O ) 50 和 c(O2)=1.0× 10-2 mol·L-1 得 c(CO)<1.0×10-6 mol·L-1。 (2)①v(NO)= 1 1 1 12 mol L 1.6 mol L 0.4 mol L min15 min 15 。 ②改变条件 c(N2)逐渐增大,说明平衡向正反应方向移动,且又不会引发 c(N2)的突变,只能是降低温度。 (3)①随温度升高平衡常数减小,说明该反应的正反应为放热反应。 ②升高温度加快正、逆反应速率,虽然平衡移动没有改变气体分子数,但在恒容条件下,容器内压强增大。 ③根据 Qc 与 K 之间的关系判断 A 中 c 3 2 V V 11 5 V V Q ,反应向逆反应方向进行;B 中 c 1 1 1V V 12 2 4 V V Q , 反应向正反应方向进行;C 中 Qc=0<1,反应向正反应方向进行;D 中 c 1 1 V V 10.5 2 V V Q ,已达平衡反应不移 动。 答案:(1)1.0×10-6 (2)①0.4/15 mol·L-1·min-1(或 0.027 mol·L-1·min-1) ②b (3)①放热 ②增大 增大 ③B、C 11.【解析】(1)减少氟利昂的使用,可减轻对臭氧层的破坏。 (2)利用天然原料及光能进行化工生产最低碳环保;化合反应原子利用率可看作 100%。 (3)① 1 1 2 2 0.75 mol / Lv H 3v CO 3 0.225 mol L min10 min ② 2 3 3 2 2 c H O c CH OH c CO c H K ,因该反应放热,升高温度 K 减小。 ③分离出 H2O(g),平衡右移,n(CH3OH)增大, 3 2 n CH OH n CO 增大;再充入 1 mol CO2 和 3 mol H2,相当于加 压,平衡向右移动, 3 2 n CH OH n CO 增大。 答案:(1)保护臭氧层 (2)a c (3)①0.225 mol·L-1·min-1 ② 2 3 3 2 2 c H O c CH OH c H c CO K 减小 ③C、D 高考创新预测 1.【解析】选 A。若混合气体中各成分的浓度不再变化,说明反应已达平衡状态,故 A 项正确;将 1 mol N2 和 3 mol H2 充分反应达到平衡时,实际反应的 N2 和 H2 少于 1 mol 和 3 mol,放出热量也小于 93.4 kJ,故 B 项不正确;催化剂能加快反应速率,缩短该反应达到平衡所需的时间,但不能影响化学平衡,故 C 项不 正确;缩小容器的体积,v(正)、v(逆)均增大,只是前者增大的倍数更大,v(正)>v(逆),平衡正向移动, 故 D 项不正确。 2.【解析】(1)①根据平衡常数的定义,此反应的化学平衡常数表达式为 2 2 c H c CO c H O K ; ②由于碳是固体,加入 C(s)不影响化学平衡;加入 H2O(g)可使平衡向右移动,碳的转化率增大;此反应为 吸热反应,升高温度,碳的转化率增大;增大压强平衡逆向移动,碳的转化率降低。 (2)Z 的催化效率高且活性温度低,当然首选。 (3)① 3 c 2 2 c CH OH c CO c H Q 1 2 2 1 1 2 0.4 mol L 100 L mol0.1 mol L (0.2 mol L ) , 小于平衡常数 160,此时正反应速率大于逆反应速率。 ②原有氢气 1 mol·L-1,v(CH3OH)=1/2v(H2)=0.03 mol·L-1·min-1。 (4)原料气循环操作的目的是增大其转化率。 答案:(1)① 2 2 c H c CO c H O K ②B、C (2)Z 催化效率高且活性温度低 (3)①> ②0.03 (4)提高原料利用率(或提高产量、产率亦可)查看更多