- 2021-07-08 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习物质制备类综合实验作业
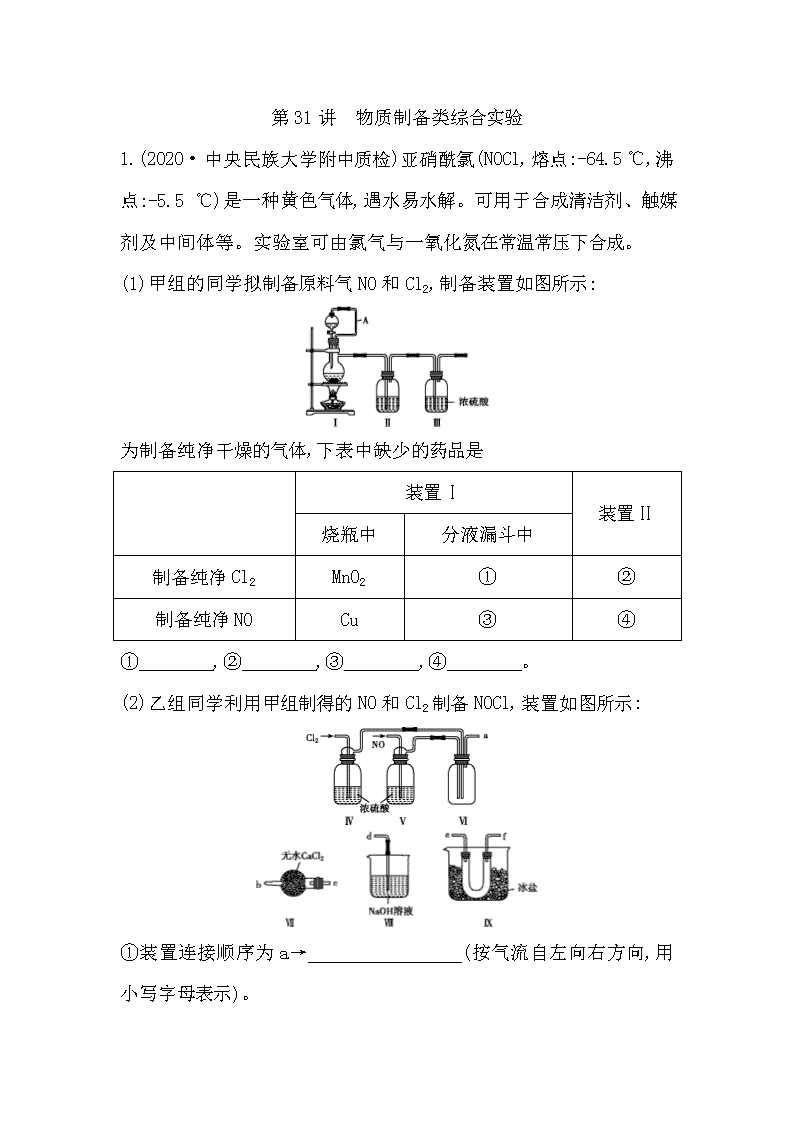
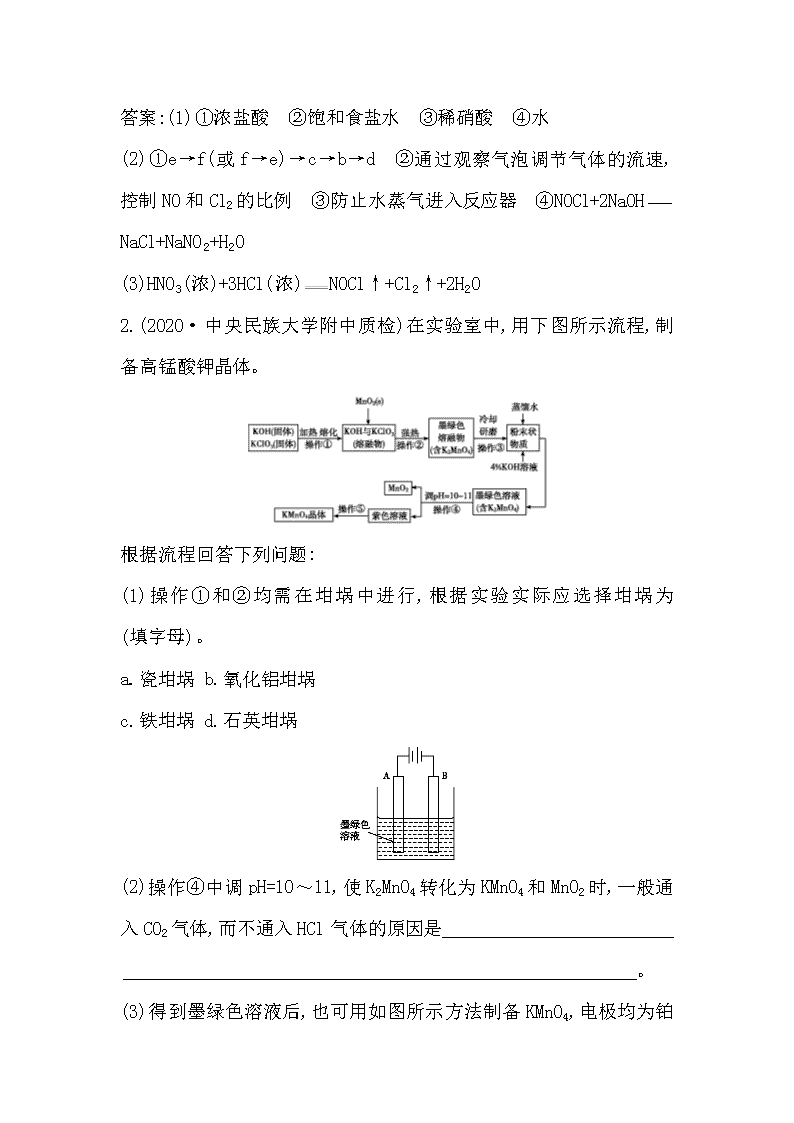
第31讲 物质制备类综合实验 1.(2020·中央民族大学附中质检)亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。 (1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示: 为制备纯净干燥的气体,下表中缺少的药品是 装置Ⅰ 装置Ⅱ 烧瓶中 分液漏斗中 制备纯净Cl2 MnO2 ① ② 制备纯净NO Cu ③ ④ ① ,② ,③ ,④ 。 (2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示: ①装置连接顺序为a→ (按气流自左向右方向,用小写字母表示)。 ②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是 。 ③装置Ⅶ的作用是 。 ④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为 。 (3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为 。 解析:(1)实验室通常用浓盐酸与MnO2混合加热制氯气,因浓盐酸有挥发性,氯气中混有的HCl气体需要用饱和食盐水除去,最后再用浓硫酸干燥即可得纯净Cl2;用铜与稀硝酸反应制NO气体,因装置中混有的氧气与NO反应生成少量NO2,因此需要通过水除去可能混有的NO2,最后再用浓硫酸干燥即可得纯净NO。(2)亚硝酰氯熔点、沸点较低,遇水易水解,故需要保持装置内干燥和反应混合气体干燥,同时需要考虑Cl2和NO尾气对环境的污染,需要用NaOH溶液除尾气,则装置连接顺序为a→e→f(或f→e)→c→b→d。②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,还可以通过观察气泡调节气体的流速,控制NO和Cl2的比例。③亚硝酰氯遇水易水解,装置Ⅶ的作用是防止水蒸气进入反应器。④装置Ⅷ中NaOH溶液能吸收NO、Cl2及NOCl的尾气,其中NOCl与NaOH发生反应的化学方程式为NOCl+2NaOHNaCl+NaNO2+H2O。(3)浓硝酸与浓盐酸在一定条件下生成亚硝酰氯和氯气,发生反应的化学方程式为HNO3(浓)+3HCl(浓)NOCl↑+Cl2↑+2H2O。 答案:(1)①浓盐酸 ②饱和食盐水 ③稀硝酸 ④水 (2)①e→f(或f→e)→c→b→d ②通过观察气泡调节气体的流速,控制NO和Cl2的比例 ③防止水蒸气进入反应器 ④NOCl+2NaOH NaCl+NaNO2+H2O (3)HNO3(浓)+3HCl(浓)NOCl↑+Cl2↑+2H2O 2.(2020·中央民族大学附中质检)在实验室中,用下图所示流程,制备高锰酸钾晶体。 根据流程回答下列问题: (1)操作①和②均需在坩埚中进行,根据实验实际应选择坩埚为 (填字母)。 a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚 (2)操作④中调pH=10~11,使K2MnO4转化为KMnO4和MnO2时,一般通入CO2气体,而不通入HCl气体的原因是 。 (3)得到墨绿色溶液后,也可用如图所示方法制备KMnO4 ,电极均为铂电极。 ①A极上的电极反应式为 。 ②这种方法与上面的方法相比,其优点是 。 (4)实验室中,可用草酸作标准溶液,利用下述反应,测定所得KMnO4晶体的纯度。5H2C2O4+2KMnO4+3H2SO410CO2↑+2MnSO4+K2SO4+8H2O ①除0.10 mol·L-1草酸标准溶液,样品溶液和稀硫酸外,下列提供的实验用品中,还需要的有 (填用品代号字母)。 ②滴定终点的判断方法是(滴定管内为草酸溶液) 。 ③取a g KMnO4晶体配制成100 mL溶液,每次取20.00 mL于锥形瓶中进行滴定实验两次。两次实验所用草酸标准溶液的体积分别为22.15 mL和22.17 mL,由此求得KMnO4晶体的纯度为 。 解析:(1)操作①和②中均有强碱性物质加热,瓷坩埚和石英坩埚中含有二氧化硅,氧化铝坩埚中含有氧化铝,高温下均与强碱KOH发生反应,故应选用铁坩埚,故选c项。(2)HCl具有还原性,易被KMnO4氧化,不能用来调节pH。(3)A电极为阳极,发生氧化反应,电极反应式为Mn-e-Mn,该方法无副产品,产率高,工艺简便。(4)①滴定实验中还需要的仪器有酸式滴定管、锥形瓶和铁架台(带滴定管夹);②在滴定过程中,当滴入最后一滴草酸溶液,溶液红色褪去,并在半分钟内不再变红,说明达到滴定终点。③ 两次实验所用草酸标准溶液的平均体积为=22.16 mL,由反应方程式5H2C2O4+2KMnO4+3H2SO410CO2↑+2MnSO4+K2SO4+8H2O知n(KMnO4)=n(H2C2O4)=×0.10 mol·L-1×0.022 16 L=0.000 886 4 mol,KMnO4晶体的纯度为×100%≈×100%=%。 答案:(1)c (2)高锰酸钾与盐酸发生反应 (3)①Mn-e-Mn ②无副产品,产率高,工艺简便 (4)①acg ②滴入最后一滴草酸溶液,溶液红色褪去,并在半分钟内不再变红 ③(或%) 3.无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下: 步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。 步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。 步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0 ℃,析出晶体,再过滤得三乙醚合溴化镁粗品。 步骤4 室温下用苯溶解粗品,冷却至0 ℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。 已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性。 ②MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5 请回答: (1)仪器A的名称是 。 实验中不能用干燥空气代替干燥N2,原因是 。 (2)如将装置B改为装置C(图2),可能会导致的后果是 。 (3)步骤3中,第一次过滤除去的物质是 。 (4)有关步骤4的说法,正确的是 。 A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0 ℃的苯 C.加热至160 ℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴 (5)为测定产品的纯度,可用EDTA(简写为Y4- )标准溶液滴定,反应的离子方程式:Mg2++Y4-MgY2- ①滴定前润洗滴定管的操作方法是 。 ②测定时,先称取0.250 0 g无水MgBr2产品,溶解后,用0.050 0 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是 (以质量分数表示)。 解析:(1)仪器A为球形干燥管。本实验要用镁屑与液溴反应生成无水溴化镁,所以装置中不应有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气。 (2)将装置B改为装置C,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患。而装置B是利用干燥的氮气将溴蒸气带入三颈瓶中,可以控制反应的快慢。(3)步骤3第一次过滤去的是不溶于水的镁屑。(4)A.95%的乙醇中含有水,溴化镁有强烈的吸水性,错误;B.加入苯的目的是除去乙醚和溴,洗涤晶体用0 ℃的苯,可以减少产品的溶解,正确;C.加热至160 ℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,错误;D.该步骤是为了除去乙醚和溴,正确。(5)①滴定前润洗滴定管需要从滴定管上口加入少量待测液,倾斜着转动滴 定管,使液体润湿内壁,然后从下部放出,重复2~3次。②据题意知:MgBr2~Y4-,n(MgBr2)=n(Y4-)= 0.050 0 mol·L-1×0.026 5 L=1.325×10-3mol,m(MgBr2)=1.325×10-3mol×184 g·mol-1=0.243 8 g,无水溴化镁产品的纯度为×100%≈97.5%。 答案:(1)球形干燥管 防止镁屑与氧气反应生成MgO阻碍Mg与Br2的反应 (2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 (3)镁屑 (4)BD (5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次 ②97.5% 4.硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下: ①配制混酸,组装如图反应装置。 取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合酸,加入恒压滴液漏斗中。把18 mL苯加入三颈烧瓶中。 ②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。 ③在50~60 ℃下发生反应,直至反应结束。 ④除去混合酸后,依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。 已知:Ⅰ.+HNO3(浓)+H2O +HNO3(浓)+++H2O Ⅱ.可能用到的有关数据列表如下: 物质 熔点 /℃ 沸点 /℃ 密度(20 ℃) /(g·cm-3) 溶解性 苯 5.5 80 0.88 微溶于水 硝基苯 5.7 210.9 1.205 难溶于水 1,3-二硝基苯 89 301 1.57 微溶于水 浓硝酸 83 1.4 易溶于水 浓硫酸 338 1.84 易溶于水 请回答下列问题: (1)配制混酸应在烧杯中先加入 。 (2)恒压滴液漏斗的优点是 。 (3)实验装置中长玻璃导管可用 (填仪器名称)代替。 (4)反应结束后产品在液体的 (填“上”或者“下”)层,分离混酸和产品的操作方法为 。 (5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。 (6)为了得到更纯净的硝基苯,还须先向液体中加入 除去水,然后蒸馏,最终得到17.5 g硝基苯。则硝基苯的产率为 (保留两位有效数字)。若加热后,发现未加沸石,应采取的操作是 。 解析:(1)由于浓硫酸的密度比浓硝酸的大,当浓硫酸遇水时放出大量的热,所以配制混酸应将浓硫酸加入浓硝酸中,也就是在烧杯中先加入浓硝酸。(2)由于在反应的过程中不断加热,会产生大量的气体,这对于液体的加入很不利。若采用恒压滴液漏斗滴加,可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下。(3)在实验的过程中苯、硝酸会因为加热而汽化,导致物质的浪费与环境污染,所以在装置中长玻璃管可以起到冷凝、降温使物质回流的作用。因此可用冷凝管等冷凝装置代替。(4)反应结束后产生的硝基苯、1,3-二硝基苯都是不溶于水的液体,密度比酸的混合溶液小。所以反应结束后产品在液体的上层,分离互不相溶的两层液体的方法是分液。(5)对于得到的粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤。如果洗涤干净,则洗涤液中不含有C,所以检验液体已洗净的方法是取最后一次洗涤液,向溶液中加入氯化钙,若无沉淀生成,说明已洗净。(6)可加入CaO除去水,根据表中数据,计算可知HNO3过量,根据苯的物质的量计算生成的硝基苯的理论产量为×123 g·mol-1≈24.98 g,故产率为×100%≈70%。如果忘记加沸石,只能停止加热,冷却后补加。 答案:(1)浓硝酸 (2)可以保持恒压滴液漏斗与三颈烧瓶内压强一致,使漏斗内液体能顺利流下 (3)冷凝管(或球形、蛇形、直形冷凝管) (4)上 分液 (5)取最后一次洗涤液少许于试管中,滴加氯化钙溶液,无沉淀生成,则说明已洗净(其他合理答案均可) (6)氧化钙 70% 停止加热,冷却后补加 【教师用书备用】 (2019·高考押题卷) 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入。 已知:①I2+Na2CO3NaI+NaIO+CO2↑ ΔH<0; 3I2+3Na2CO35NaI+NaIO3+3CO2↑ ΔH<0; ②I2(s)+I-(aq)(aq) ③水合肼(N2H4·H2O)具有强还原性,可分别将IO-、I和I2还原为I-,本身被氧化 为 N2(放热反应);100 ℃左右水 合肼分解为氮气和氨气等。 (1)常温常压时,I2与Na2CO3溶液反应很慢,下列措施能够加快反应速率的是 。 a.将碘块研成粉末 b.起始时加少量NaI c.将溶液适当加热 d.加大高纯水的用量 (2)I2与Na2CO3溶液反应适宜温度为40~70 ℃,温度不宜超过70 ℃,除防止反应速率过快,另一原因是 。 (3)加入稍过量水合肼发生反应的离子方程式为 (只写一个)。 (4)整个实验过程中都需要开动搅拌器,其目的是 。 (5)反应的后期I2与Na2CO3溶液反应难以进行,此阶段需对投料顺序作适当改进,改进的方法是 。 (6)所得溶液(偏黄,且含少量S,极少量的K+和Cl-)进行脱色、提纯并结晶,可制得高纯NaI晶体。实验方案为:在溶液中加入少量活性炭煮沸、 [实验中需使用的试剂有:HI溶液,Na2CO3溶液、Ba(OH)2溶液、高纯水及pH试纸;除常用仪器外须使用的仪器有:真空干燥箱]。 解析:(1)粉末状比块状的接触面积大,温度升高,均可以加快反应速率。开始时加入NaI,可以将固态I2转化成溶液,增大了I2的溶解量,反应加快。(2)温度升高,会使I2升华。(3)水合肼与IO-、I-可发生氧化还原反应,根据N和I的得失电子守恒配平反应。(4)搅拌的目的很多,可以使反应物充分接触,可以散热,可以将生成的气体及时排出,以免容器内产生的压强过大。(5)反应后期,、I-及碳酸钠等均被稀释,浓度低了,反应难进行,所以可以先发生:2I2+N2H4·H2O4HI+N2↑+H2O,再发生:2HI+Na2CO32NaI+CO2↑+H2O(药品加入顺序,一般是先固体,再液体)。(6)趁热过滤除去活性炭等不溶性杂质,NaI、S、K+和Cl-仍在溶液中,先加入Ba(OH)2除去S,再加入Na2CO3除去过量的B,最后加入HI,除去过量的C,用pH试纸测定,当溶液pH=6左右时,可知C被完全除去。再通过蒸发结晶析出NaI晶体,少量的K+和Cl-仍留在溶液中,过滤后,用纯水洗涤晶体,在真空干燥箱中干燥得纯NaI。 答案:(1)abc (2)防止碘升华 (3)2IO-+N2H4·H2O2I-+N2↑+3H2O或2I+3N2H4·H2O2I-+3N2↑+9H2O (4)使合成反应均匀进行,并使产生的CO2、N2等气体及时排出 (5)先加入碘、水合肼,最后加入碳酸钠 (6)趁热过滤;将过滤液在不断搅拌下依次加入稍过量的Ba(OH)2溶液、稍过量的Na2CO3溶液,过滤;滤液中在不断搅拌下加入HI溶液至用pH试纸测定溶液pH约为6;蒸发、冷却结晶,再次过滤;用高纯水洗涤晶体 2~3 次后,在真空干燥箱中干燥得纯NaI查看更多