- 2021-07-08 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
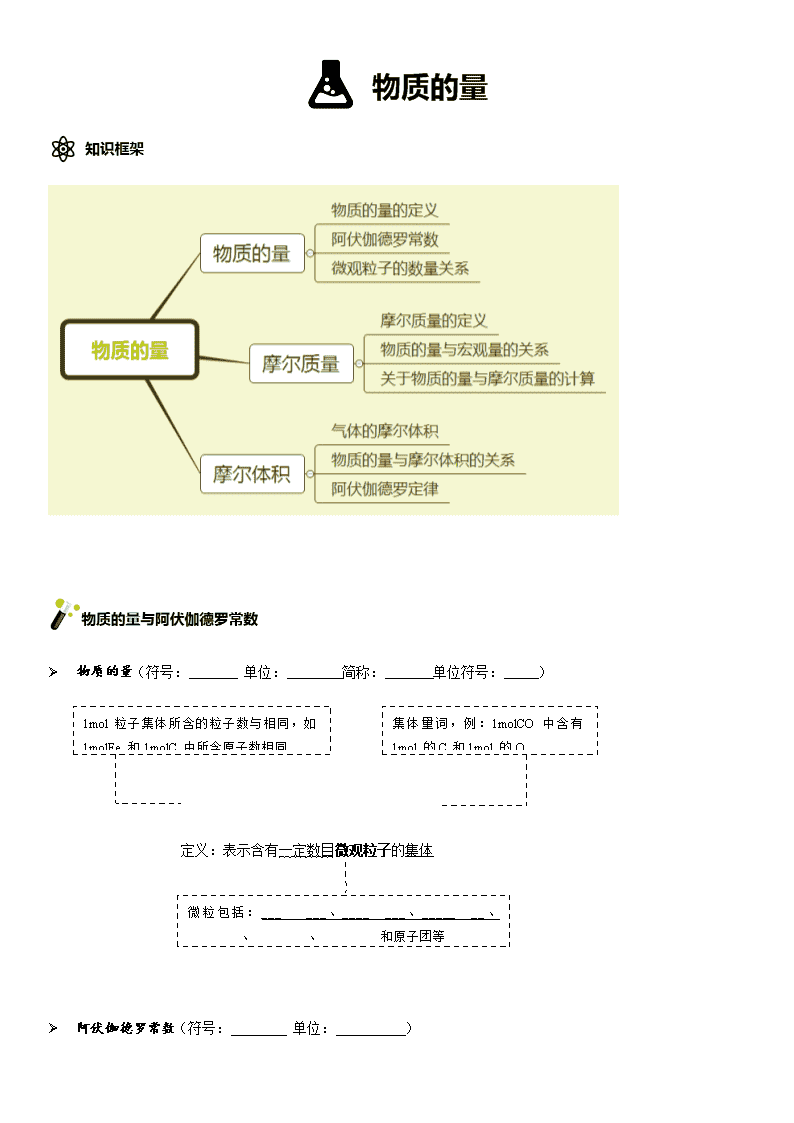
2020届高考化学一轮复习物质的量学案(1)
物质的量 Ø 物质的量(符号: 单位: 简称: 单位符号: ) 1mol粒子集体所含的粒子数与相同,如1molFe和1molC中所含原子数相同 集体量词,例:1molCO中含有1mol的C和1mol的O 定义:表示含有一定数目微观粒子的集体 微粒包括:___ ___、____ ___、_____ __、______ 、____ __、___ _____和原子团等 Ø 阿伏伽德罗常数(符号:________ 单位:__________) 定义:0.012kg12C中所含有的碳原子数(即:1mol)≈6.02×1023/mol(约数) Ø 物质的量与微观粒子的关系 →微粒的个数 →1mol含有的粒子数,即阿伏伽德罗常数 变式: 【1】下列对于“摩尔”的理解正确的是 ( ) A.摩尔是国际科学界建议采用的一种物理量 B.摩尔是物质的量的单位,简称摩,符号为mol C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来 D.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 【答案】B。解析:A.摩尔是单位;C.物质的量可以把物质的宏观数量与微观粒子的数量联系起来;D.碳原子应指明含有6个质子和6个中子。 【2】完成下列填空: 1) 0.3molNH3中含有______ 个氨气分子,含有_______个氮原子,共含有_______个原子; 2) 9molH2SO4中含有_______个硫酸分子,含有_______个氧原子,共含有______个原子; 3) 2molNa2SO4中含有______ 个Na+和_______ 个SO42-; 4) 1个H2O分子中含有 个电子, 个质子;则1molNH4+离子中有_____个电子,______个质子; 5) 0.1 mol的单质Ax和0.6 mol的B2完全反应生成0.4mol的AB3,则单质Ax的分子式为 。 【答案】 1) 0.3NA、0.3NA、1.2NA 2) 9NA、36NA、63NA 3) 4NA、2NA 4)10、 10 、10NA 、11NA 5)A4 Ø 摩尔质量(符号:_________ 单位:________) 定义:单位物质的量的物质所具有的质量叫做摩尔质量。 数值:1mol任何粒子或物质的 质量以g为单位时,数值上等于该粒子的相对原子质量或相对分子质量 Ø 物质的量与宏观质量的关系 →物质的质量 →该粒子的摩尔质量(数值上等于Ar或Mr) 变式: Ø 关于物质的量与摩尔质量的计算 【例】24g的碳与足量的氧气完全反应,生成二氧化碳的的物质的量是多少? 解法一: 设生成的二氧化碳的质量为x C + O2 == CO2 12 44 24g x 解出 x = 88g 由 n=m/M 求出x=2mol 解法二: 设生成二氧化碳的物质的量为x n = 24/12=2mol C + O2 == CO2 1 1 2mol x 解出 x = 2mol 【1】 下列说法正确的是 ( ) A.摩尔质量就等于物质的式量 B.摩尔质量就物质式量的6.02×1023倍 C.HNO3的摩尔质量是63g D.硫酸和磷酸的摩尔质量相等 【答案】D 【2】相对原子质量:Al-27 C-12 O-16 H-1 S-32 物质 摩尔质量 质量 物质的量 微粒数 Al 27g/mol 5.4g 0.2mol 0.2NA SO2 64g/mol 128g 2mol 2NA CaCO3 100g/mol 50g 0.5mol 0.5NA NH4+ 18g/mol 7.2g 0.4mol 0.4NA 【3】 1)等物质的量的SO2和SO3中硫元素的物质的量之比= ;氧元素的物质的量之比= ; 2)等质量的SO2和SO3中硫元素的物质的量之比= ;氧元素的物质的量之比= ; 3)等质量的O2和O3中氧原子的物质的量之比= 。 【答案】1)1:1 、 2:3 2)5:4 、5:6 3)1:1 【4】 等质量的Cl2、HCl、O2、H2、CO2,按其所含分子数目由多到少的顺序排列是______。 【答案】H2 O2 HCl CO2 Cl2 Ø 摩尔体积 (符号Vm,单位L/mol) 定义:单位物质的量的气体所占的体积。 状态:气体摩尔体积是指气态物质而言。所以,同温同压下,含有相同数目分子的气体的体积必然相等。气体摩尔体积与压强和温度有关;气体摩尔体积针对气体而言,可以是单一气体,也可以是混合气体。 标况:0℃,101kPa(标况状况)时,1mol任何气体的体积约为22.4L(即Vm≈22.4L/mol) Ø 物质的量与气体摩尔体积的关系 ※公式推导(气体摩尔体积Vm与ρ(密度)、m、N、M的关系) Ø 阿伏伽德罗定律 定义:在同温同压下,同体积的任何气体都含有相同数目的分子。 理想气体状态方程为:(R为常数)(此方程也称克拉柏龙方程) 【1】 下列有关气体摩尔体积的描述中正确的是 ( ) A.单位物质的量的气体所占的体积就是气体摩尔体积 B.通常状况下的气体摩尔体积约为22.4L C.标准状况下的气体摩尔体积约为22.4L D.相同物质的量的气体摩尔体积也相同 【答案】A 。解析:标况下,气体的摩尔体积为22.4L/mol,故BC 错误;气体摩尔体积只与温度压强有关,与物质的量无关。 【2】 标况下,2mol的氮气体积是________;标况下,672mL的氧气的物质的量是_________; 4.96L的氢气,在某温度压强下,物质的量是0.2mol,此时的气体摩尔体积是________。 【答案】44.8L 0.03mol 24.8L/mol 【3】 标况下,3.4g的NH3体积是_______;标况下,4.48L的O2,其质量是_______。 【答案】4.48L 6.4g 【4】 在273K和101 kPa的条件下,将2.00g氦气、1.40g氮气和1.60 g氧气混合,该混合气体的体积是( ) A.6.72 L B.7.84 L C.10.08 L D.13.44 L 【答案】D 物质的量、摩尔质量、质量三个物理量的比较 质量 物质的量 摩尔质量 摩尔体积 用途 描述物质的重量 描述微观粒子数目多少 质量与物质的量的转换桥梁 气体体积与物质的量的桥梁 单位 克(g)或千克(kg) 摩尔(mol) g•mol-1或kg•mol-1 L/mol 符号 m n M Vm 转换方法 Vm=V/n 1. 下列说法正确的是( ) A.摩尔是含有6.02×1023个微粒的集体 B.2g H2的体积为22.4L C.0.012kg12C所含的原子数值是6.02×1023 D.1molH2SO4的质量是98g 2. 下列对于“摩尔”的理解正确的是( ) A.摩尔是国际科学界建议采用的一种物理量 B.摩尔是物质的质量单位,简称摩,符号为mol C.含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 D.1mol O2含有6.02×1023个氧分子 3. 同温同压下,1molC2H4和1molN2具有不同的( ) A.原子数 B.分子数 C.体积 D.物质的量 4. 科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2具有相同的( ) A.原子数 B.分子数 C.质量 D.体积 5. 用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( ) A.44gCO2所含分子数为NA B.常温常压下,11.2L氧气所含原子数为NA C.NA个氢分子的质量为2g/mol D.标准状况下,22.4L水含有的分子数为NA 6. 同温同压下,甲、乙两容器分别盛有甲烷(CH4)和氨气(NH3),若它们所含的原子数相同,则甲、乙两容器的体积比是( ) A.4:3 B.5:4 C.4:5 D.1:1 7. 同温同压下,相同体积的下列气体质量最大的是( ) A.N2 B.CO2 C.SO2 D.CH4 8. 0.3mol氧气和 0.2mol臭氧比较正确的是( ) A.分子数比1:1 B.原子数比3:2 C.体积比3:2 D.质量比1:1 9. 标准状况下,1L某气体的质量为1.25g,则该气体可能是( ) A.H2 B.N2 C.CO D.CO2 10. 下列物质中质量最大的是( ) A.6.4g SO2 B.3.01×1023个N2分子 C.标况下3.36L氧气 D.4g NaOH 11. 下列有关阿佛加德罗常数(NA)的说法错误的是( ) A.32gO2所含的原子数目为NA B.0.5molH2O含有的原子数目为1.5NA C.1molH2O含有的H2O分子数目为NA D.0.5NA个氯气分子的物质的量是0.5mol 12. 标准状况下,一容器装满Cl2,其质量为76.4g,若改装满N2,其质量为67.8g,容器的体积为( ) A. 22.4L B . 44.8L C. 11.2 L D. 4.48L 13. 将氢气、氧气、二氧化碳4:1:1的体积比混合,点燃爆炸后,再与红热足量的炭充分反应,当恢复到原温度时,混合气体压强是原气体压强的( ) A. 3/4 B. 4/3 C. 2/3 D. 1/3 14. 由CO、H2和CO2组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中 CO2、H2和CO的体积比为( ) A. 29:8:13 B. 22:1:14 C . 13:8:29 D . 26:14:57 【答案】1-5 DDAAA 6-10 CCDBA 11-14 ADBC 15. 现有mg某气体,它由双原子分子构成,它的摩尔质量为M g.mol-1。若阿伏加德罗常数用NA表示,则: (1)该气体的物质的量为________mol。 (2)该气体所含原子总数为_______个。 (3)该气体在标准状况下的体积为____________L。 (4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为_______。 【答案】(1)m/M ; (2)2m/M*NA ; (3)22.4m/M; (4)m/(1000+m)*100% 16. 在标准状况下,将15LO2通入10LCO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。 (1)若剩余气体的体积是15L,则原CO和H2的混合气体中V(CO)=_______L,V(H2)=________L。 (2)若剩余气体的体积为a L,则原CO和H2的混合气中V(CO):V(H2)=___________________。 (3)若剩余气的体积为a L,则a 的取值范围是___________________________。 【答案】(1)5、5;(2)(a-10):(20-a);(3)10查看更多
相关文章
- 当前文档收益归属上传用户