- 2021-07-08 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习离子反应与氧化还原反应的综合应用学案
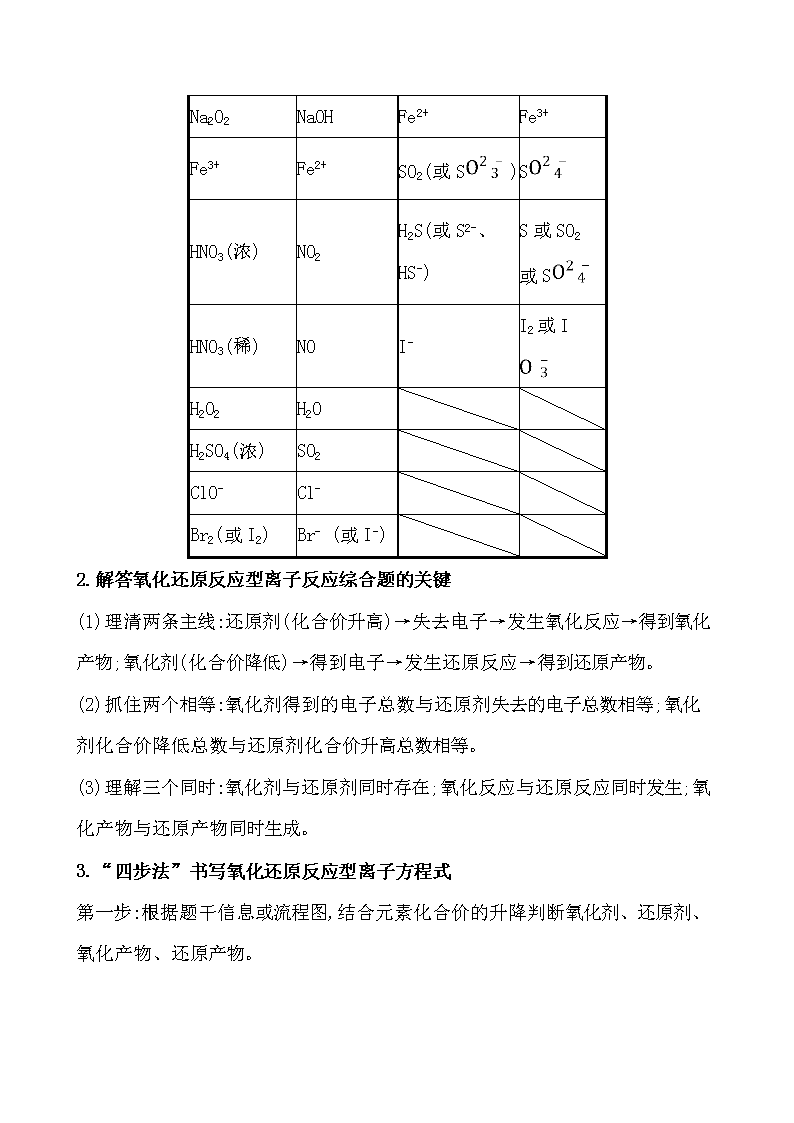
离子反应与氧化还原反应的综合应用 【典题】KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是 ______________________________。 【精析】第一步:依题意,锰元素的化合价降低,故KMnO4是氧化剂,Mn2+是还原产物;碳元素的化合价升高,故Na2C2O4(碳元素化合价为+3价)是还原剂,CO2是氧化产物。 第二步:按“氧化剂+还原剂——还原产物+氧化产物”把离子方程式初步写成: Mn+C2——Mn2++CO2↑。由Mn→Mn2+,锰元素降了5价;由C2→CO2,碳元素升了1价,1 mol C2共失去2 mol e-,故在C2前配5,在氧化产物CO2前配10;在Mn前配2,在还原产物Mn2+前配2,即2Mn+5C2——2Mn2++ 10CO2↑。 第三步:反应在硫酸中进行,故在左边补充H+,右边补充H2O,2Mn+5C2+ H+——2Mn2++10CO2↑+ H2O。 第四步:依据电荷守恒及H、O原子守恒配平如下: 2Mn+5C2+16H+2Mn2++10CO2↑+8H2O。 答案:2Mn+5C2+16H+2Mn2++10CO2↑+8H2O 1.掌握常见的相关转化关系 强氧化性 物质或离子 被还原后 的产物 强还原性 物质或离子 被氧化后 的产物 Na2O2 NaOH Fe2+ Fe3+ Fe3+ Fe2+ SO2(或S) S HNO3(浓) NO2 H2S(或S2-、 HS-) S或SO2 或S HNO3(稀) NO I- I2或I H2O2 H2O H2SO4(浓) SO2 ClO- Cl- Br2(或I2) Br- (或I-) 2.解答氧化还原反应型离子反应综合题的关键 (1)理清两条主线:还原剂(化合价升高)→失去电子→发生氧化反应→得到氧化产物;氧化剂(化合价降低)→得到电子→发生还原反应→得到还原产物。 (2)抓住两个相等:氧化剂得到的电子总数与还原剂失去的电子总数相等;氧化剂化合价降低总数与还原剂化合价升高总数相等。 (3)理解三个同时:氧化剂与还原剂同时存在;氧化反应与还原反应同时发生;氧化产物与还原产物同时生成。 3.“四步法”书写氧化还原反应型离子方程式 第一步:根据题干信息或流程图,结合元素化合价的升降判断氧化剂、还原剂、氧化产物、还原产物。 第二步:按“氧化剂+还原剂还原产物+氧化产物”写出方程式,根据得失电子守恒配平上述四种物质。注意:不属于“氧化剂、还原剂、氧化产物、还原产物”的物质这一步暂不写在方程式中。 第三步:根据电荷守恒或反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。补项原则为 条件 补项原则 酸性条 件下 缺氢或多氧补H+,少氧补H2O 碱性条 件下 缺氢或多氧补H2O,少氧补OH- 第四步:根据质量守恒配平反应方程式。 (2019·德阳模拟)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI2NO↑+I2+2NaI+2H2O。 (1)上述反应中氧化剂是________。 (2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾-淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。 (3)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________。 A.NaClB.NH4ClC.HNO3D.浓H2SO4 (4)请配平以下化学方程式: Al+ NaNO3+ NaOH NaAlO2+ N2↑+ H2O 若反应过程中转移5 mol电子,则生成标准状况下N2的体积为________L。 【解析】(1)NaNO2中N元素的化合价降低,作氧化剂。 (2)根据题中反应,NaNO2在酸性溶液中,能将I-氧化成I2,淀粉遇I2变蓝色,故必须选用的物质有②⑤。 (3)根据氧化还原知识,所选试剂应充当还原剂,题给选项中只有NH4Cl能与NaNO2反应转化为不引起二次污染的N2,故选B。 (4)根据化合价升降相等配平:10Al+6NaNO3+4NaOH10NaAlO2+3N2↑+2H2O。根据关系式N2~10 e-,若反应过程中转移5 mol e-,则生成标准状况下N2的体积为 11.2 L。 答案:(1)NaNO2 (2)②⑤ (3)B (4)10 6 4 10 3 2 11.2查看更多