- 2021-07-08 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版选修二第2单元单元综合检测
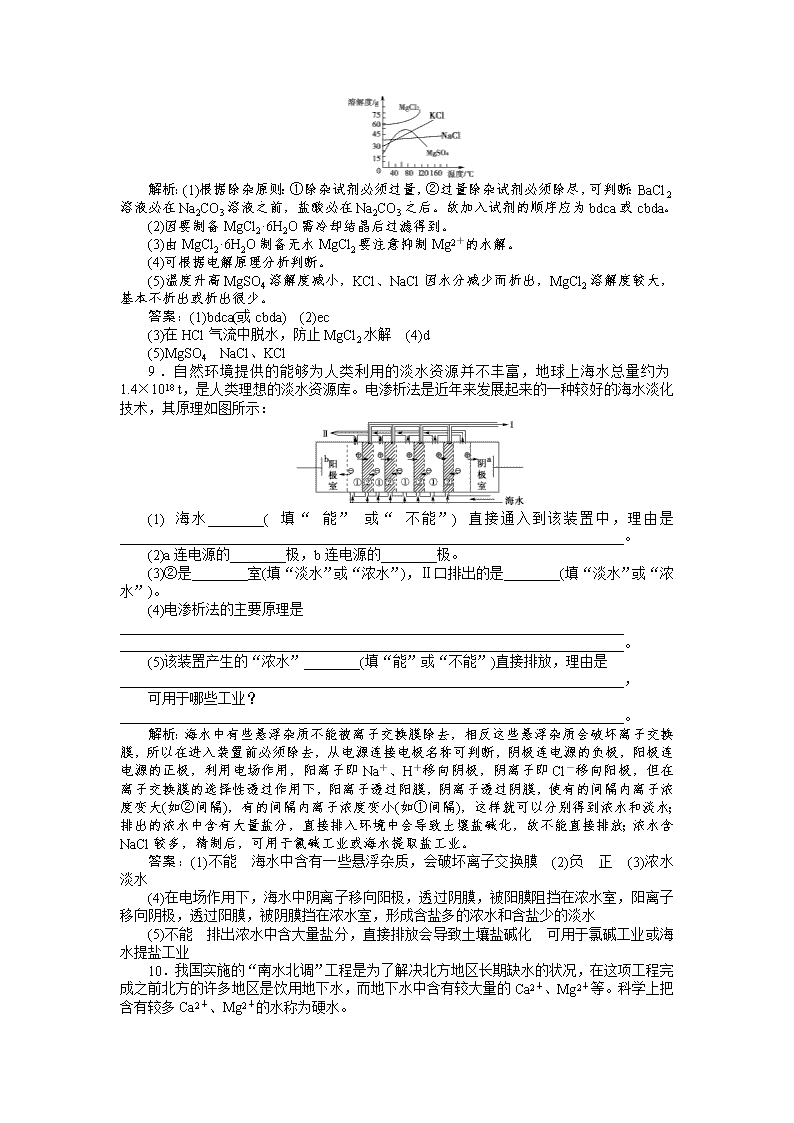
一、选择题 1.(2011年岳阳市一中检测)下列说法中,不正确的是( ) A.煮沸暂时硬水后,水的硬度一定降低 B.硬水中加入适量石灰水后,由于生成Mg(OH)2、CaCO3 沉淀,水就软化了 C.永久硬水主要是由含有Ca2+、Mg2+的硫酸盐和氯化物形成的,加热煮沸是不能软化的 D.如果用HR型离子交换树脂软化硬水,则发生的交换反应可以表示为Ca2++2HR===CaR2+2H+ 解析:选B。水的硬度由Ca(HCO3)2或Mg(HCO3)2引起的,称为暂时硬水,可通过加热煮沸方法进行软化。水的硬度由Ca2+、Mg2+的硫酸盐或氯化物引起的,称为永久硬水, 加热煮沸不能软化,可通过药剂法[加入Na2CO3、Ca(OH)2]及离子交换法(如Ca2++2HR===CaR2+2H+)进行软化,B项中加入Ca(OH)2,只能除去Mg2+,再加入Na2CO3才能除去Ca2+,故B项错。 2.工业上获得苯主要通过( ) A.煤的干馏 B.石油常压分馏 C.石油减压分馏 D.石油催化裂化 解析:选A。煤通过干馏得到煤焦油,在煤焦油中含有多种芳香族化合物,从中可以得到苯。石油分馏得到含碳原子数不一的烷烃混合物,得不到苯。石油催化裂化主要得到含不饱和烃的汽油。故选A。 3.(2011年大同一中月考)目前下列工艺过程没有直接使用离子交换技术的是( ) A.硬水的软化 B.电解饱和食盐水制造NaOH C.电渗析淡化海水 D.海水中提取金属Mg 解析:选D。硬水的软化、电解饱和食盐水制NaOH、电渗析淡化海水均使用离子交换技术;海水提镁,使其发生反应Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2,再过滤得Mg(OH)2,最终制得Mg,没有使用离子交换技术。 4.(2011年高考福建卷)下列关于化学与生产、生活的认识不正确的是( ) A.CO2、CH4、N2等均是造成温室效应的气体 B.使用清洁能源是防止酸雨发生的重要措施之一 C.节能减排符合低碳经济的要求 D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 解析:选A。造成温室效应的气体包含CO2和CH4,但不包含N2。 5.下列叙述正确的是( ) ①海水中含有大量的Br-,所以从海水中提取溴一般要经历浓缩和提取两个步骤 ②铝是一种比较活泼的金属,所以铝合金制品易被腐蚀 ③在煤中加入适量的生石灰,可以减少煤燃烧时二氧化硫的排放 ④制造玻璃的主要原料是纯碱、石灰石和石英 A.②③ B.②④ C.①③ D.③④ 解析:选D。海水中提取Br2要经历富集、氧化、萃取等,①错;铝在常温下易形成一层致密的氧化膜,不易被腐蚀,②错;根据钙基固硫,加入适量CaO可吸收SO2,减少污染,故选③④,D项正确。 6.某工厂排放的酸性废水中含有较多的Cu2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的( ) A.食盐、硫酸 B.胆矾、石灰水 C.铁粉、生石灰 D.苏打、盐酸 解析:选C。铁粉能除去Cu2+,生石灰能中和H+且能沉淀Fe2+。A项中增加废水的酸性,B项中增加废水中的Cu2+,D项中增加废水的酸性,且不能除去Cu2+。 7.(2011年高考大纲全国卷)某含铬(Cr2O)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( ) A.消耗硫酸亚铁铵的物质的量为n(2-x)mol B.处理废水中Cr2O的物质的量为 mol C.反应中发生转移的电子数为3nx mol D.在FeO· FeyCrxO3中,3x=y 解析:选A。Cr2O具有强氧化性,FeSO4·(NH4)2SO4·6H2O具有强还原性,二者发生氧化还原反应,Fe2+被氧化成Fe3+,Cr2O中+6价Cr被还原成+3价Cr。该反应中,Fe失电子的物质的量等于Cr得电子的物质的量,则有ny mol=3nx mol,即3x=y。据Cr、Fe原子守恒可知,生成n mol FeO·FeyCrxO3时,消耗 mol Cr2O,消耗n(y+1)mol硫酸亚铁铵,反应中转移电子的物质的量为 mol×6=3nx mol,又知3x=y,则消耗硫酸亚铁铵的物质的量为n(3x+1) mol。 二、非选择题 8.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图: 请回答: (1)在粗盐中含有Ca2+、Mg2+、SO等杂质,精制时所用的试剂为:a.盐酸 b.氯化钡溶液 c.氢氧化钠溶液 d.碳酸钠溶液。则加入试剂的顺序是(填编号)________。 (2)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为________。 a.蒸馏 b.灼烧 c.过滤 d.蒸发 e.冷却结晶 (3)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是________________________________________________________________________。 (4)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是________。 a.精制饱和食盐水进入阳极室 b.纯水(加少量NaOH)进入阴极室 c.阴极产物为氢氧化钠和氢气 d.阳极的电极反应为:Cl2+2e-===2Cl- (5)母液中常含有MgCl2、NaCl、MgSO4、KCl等(其溶解度与温度的关系如下图所示),可进一步加工制得一些重要的产品。若将母液加热升温到60 ℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是________;过滤上述晶体后,将滤液降温到30 ℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的________________晶体。 解析:(1)根据除杂原则:①除杂试剂必须过量,②过量除杂试剂必须除尽,可判断:BaCl2溶液必在Na2CO3溶液之前,盐酸必在Na2CO3之后。故加入试剂的顺序应为bdca或cbda。 (2)因要制备MgCl2·6H2O需冷却结晶后过滤得到。 (3)由MgCl2·6H2O制备无水MgCl2要注意抑制Mg2+的水解。 (4)可根据电解原理分析判断。 (5)温度升高MgSO4溶解度减小,KCl、NaCl因水分减少而析出,MgCl2溶解度较大,基本不析出或析出很少。 答案:(1)bdca(或cbda) (2)ec (3)在HCl气流中脱水,防止MgCl2水解 (4)d (5)MgSO4 NaCl、KCl 9.自然环境提供的能够为人类利用的淡水资源并不丰富,地球上海水总量约为1.4×1018 t,是人类理想的淡水资源库。电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示: (1)海水________(填“能”或“不能”)直接通入到该装置中,理由是________________________________________________________________________。 (2)a连电源的________极,b连电源的________极。 (3)②是________室(填“淡水”或“浓水”),Ⅱ口排出的是________(填“淡水”或“浓水”)。 (4)电渗析法的主要原理是________________________________________________________________________ ________________________________________________________________________。 (5)该装置产生的“浓水”________(填“能”或“不能”)直接排放,理由是________________________________________________________________________, 可用于哪些工业?________________________________________________________________________。 解析:海水中有些悬浮杂质不能被离子交换膜除去,相反这些悬浮杂质会破坏离子交换膜,所以在进入装置前必须除去,从电源连接电极名称可判断,阴极连电源的负极,阳极连电源的正极,利用电场作用,阳离子即Na+、H+移向阴极,阴离子即Cl-移向阳极,但在离子交换膜的选择性透过作用下,阳离子透过阳膜,阴离子透过阴膜,使有的间隔内离子浓度变大(如②间隔),有的间隔内离子浓度变小(如①间隔),这样就可以分别得到浓水和淡水;排出的浓水中含有大量盐分,直接排入环境中会导致土壤盐碱化,故不能直接排放;浓水含NaCl较多,精制后,可用于氯碱工业或海水提取盐工业。 答案:(1)不能 海水中含有一些悬浮杂质,会破坏离子交换膜 (2)负 正 (3)浓水 淡水 (4)在电场作用下,海水中阴离子移向阳极,透过阴膜,被阳膜阻挡在浓水室,阳离子移向阴极,透过阳膜,被阴膜挡在浓水室,形成含盐多的浓水和含盐少的淡水 (5)不能 排出浓水中含大量盐分,直接排放会导致土壤盐碱化 可用于氯碱工业或海水提盐工业 10.我国实施的“南水北调”工程是为了解决北方地区长期缺水的状况,在这项工程完成之前北方的许多地区是饮用地下水,而地下水中含有较大量的Ca2+、Mg2+等。科学上把含有较多Ca2+、Mg2+的水称为硬水。 (1)将硬水中所含Ca2+、Mg2+、HCO等除去的方法是加入生石灰生成Ca(OH)2,进而发生若干复分解反应,在沉降池中所得沉淀的主要成分为________和________(填化学式)。 (2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀。凝聚剂除去悬浮固体颗粒起到净水作用的过程________(填写编号)。 ①发生水解 ②发生氧化还原反应 ③发生胶体的聚沉 (3)净化后的水要进一步消毒,常用的消毒剂是Cl2。Cl2消毒的实质是Cl2和水反应生成了________(填化学式),Cl2与水反应的离子方程式为________________________________________________________________________ ________________________________________________________________________。 (4)由于Cl2与水中的有机物作用会产生对人体不利的物质,所以世界卫生组织要求停止用Cl2对自来水进行消毒,而用其他的代用品,我国已经开始使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率比为________。 (5)从氧化还原反应角度看,下列物质中________(填写编号)可以作为Cl2的代用品。 ①Ca(ClO)2 ②NH2Cl(氯氨) ③K2FeO4 ④SO2 ⑤Al2(SO4)3 解析:水是重要的资源,所以有关水的题目也很多。 (1)从溶解度角度可以得出沉淀是Mg(OH)2、CaCO3; (2)FeSO4·7H2O是常用的凝聚剂,其净水的过程发生了水解、氧化还原反应、胶体的聚沉等; (3)消毒剂Cl2的消毒作用主要是因为Cl2与水反应的产物中有HClO,Cl2+H2OHCl+HClO; (4)使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率比为∶=2.63∶1; (5)一般具有强氧化性、与水反应的产物对人体等没有影响的试剂都可以作水的消毒剂,如选项中的①②③。 答案:(1)Mg(OH)2 CaCO3 (2)①②③ (3)HClO Cl2+H2O H++HClO+Cl- (4)2.63∶1 (5)①②③ 11.(2011年天津一中教学质量检测)从石油和煤中可以得到多种化工资源,如用来生产苯酚和丙酮的丙烯和苯,其生产流程如下: 回答下列问题: (1)石油分馏时可以得到一些丙烯,但远不能满足生产需要,把石油分馏产品中的重油经过________可得到更多丙烯。 (2)从煤焦油中分离得到苯的方法为________。 (3)生产流程中①和②的反应类型分别为______________、______________。 (4)写出反应①和②的化学方程式________________________________、________________________________。 解析:通过裂解可以从重油中得到更多丙烯、乙烯等产品;煤焦油的主要成分为苯及苯的同系物、稠环芳香烃等,只能用分馏的方法分离出苯;反应①使丙烯中的不饱和键变为饱和键,故属于加成反应,反应②中使有机物加氧,属于典型的氧化反应,可以利用元素守恒写出两个化学方程式。 答案:(1)裂解 (2)分馏 (3)加成反应 氧化反应 12.硬度较高的河水,饮用前一般要经过如图所示过程进行处理。 回答下列问题: (1)A的化学式是__________________,净化的反应原理为________________________________________________________________________。 (2)B的化学式是______________,软化硬水的反应原理为________________________________________________________________________ ________________________________________________________________________。 (3)氯气消毒的原理是________________________________________________________________________ ________________________________________________________________________(需写出相关的化学方程式)。 (4)如图是实验室拟用A制取硫酸铝和硫酸钾的操作步骤图(图中略去了沉淀物的洗涤操作),有关参考数据如下表: 溶解度(g) 20 ℃ 100 ℃ KNO3 31.6 247 NaCl 36.0 39.8 K2SO4 11.1 24.1 Al2(SO4)3 26.7 98.1 请填空: Ⅰ.试剂a________________,b__________________________,c________________(写化学式)。 Ⅱ.分离方法①______________,③______________。 解析:净化水的常用试剂是KAl(SO4)2·12H2O,利用Al3+水解产生Al(OH)3胶体,吸浮悬浮物等杂质,起到净水的作用。硬水中的Ca2+、Mg2+ 可用NaR在离子交换柱中交换除去,氯气溶于水产生具有强氧化性的HClO,而起到杀菌消毒的效果。 (4)小题根据Al(OH)3溶于强酸而不溶于弱碱分析判断,主要考查了铝及其化合物的相互转化。 答案:(1)KAl(SO4)2·12H2O Al3++3H2O Al(OH)3(胶体)+3H+ (2)NaR Ca2++2NaR===2Na++CaR2,Mg2++2NaR===2Na++MgR2 (3)Cl2+H2OHCl+HClO,HClO具有强氧化性 (4)Ⅰ.NH3·H2O H2SO4 KOH Ⅱ.过滤 蒸发结晶查看更多