- 2021-07-08 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考一轮复习人教版第11讲铜及其化合物金属材料开发利用金属矿物学案3
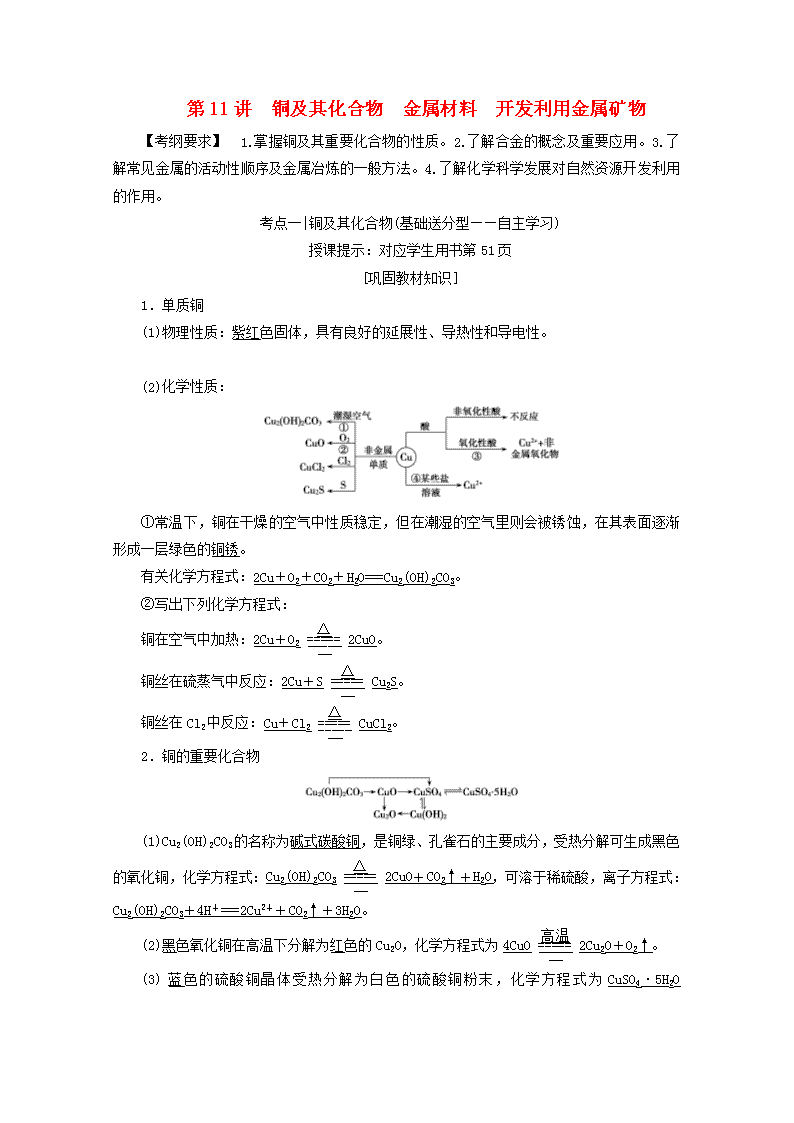
第11讲 铜及其化合物 金属材料 开发利用金属矿物 【考纲要求】 1.掌握铜及其重要化合物的性质。2.了解合金的概念及重要应用。3.了解常见金属的活动性顺序及金属冶炼的一般方法。4.了解化学科学发展对自然资源开发利用的作用。 考点一|铜及其化合物(基础送分型——自主学习) 授课提示:对应学生用书第51页 [巩固教材知识] 1.单质铜 (1)物理性质:紫红色固体,具有良好的延展性、导热性和导电性。 (2)化学性质: ①常温下,铜在干燥的空气中性质稳定,但在潮湿的空气里则会被锈蚀,在其表面逐渐形成一层绿色的铜锈。 有关化学方程式:2Cu+O2+CO2+H2O===Cu2(OH)2CO3。 ②写出下列化学方程式: 铜在空气中加热:2Cu+O22CuO。 铜丝在硫蒸气中反应:2Cu+SCu2S。 铜丝在Cl2中反应:Cu+Cl2CuCl2。 2.铜的重要化合物 (1)Cu2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的氧化铜,化学方程式:Cu2(OH)2CO32CuO+CO2↑+H2O,可溶于稀硫酸,离子方程式:Cu2(OH)2CO3+4H+===2Cu2++CO2↑+3H2O。 (2)黑色氧化铜在高温下分解为红色的Cu2O,化学方程式为4CuO2Cu2O+O2↑。 (3)蓝色的硫酸铜晶体受热分解为白色的硫酸铜粉末,化学方程式为CuSO4·5H2O CuSO4+5H2O。 (4)Cu2O与稀硫酸反应,溶液变蓝,同时生成红色的单质铜,离子方程式为Cu2O+2H+===Cu+Cu2++H2O。 3.正误判断,正确的打“√”,错误的打“×”。 (1)用胆矾炼铜不涉及化学反应。( ) (2)氢气通过灼热的CuO粉末反应后固体物质增重。( ) (3)CuO是黑色固体,与水反应可生成Cu(OH)2。( ) (4)Cu2O遇硝酸会被氧化成Cu2+。( ) (5)Cu2(OH)2CO3是铜锈的主要成分,在干燥的空气中不易生成。( ) (6)过量的铜与浓硝酸反应一定没有一氧化氮生成。( ) (7)利用无水硫酸铜遇水变成蓝色这一性质,来检验水的存在。( ) (8)将铁片置于CuSO4溶液中,铁片上有红色物质析出,说明铁比铜活泼。( ) 答案:(1)× (2)× (3)× (4)√ (5)√ (6)× (7)√ (8)√ [练透基础小题] 题点一 铜及其化合物的性质 1.(RJ必修1·P686题改编)铜钱在历史上曾经是一种广泛流通的货币。从物理性质和化学性质的角度分析,铜常用于制造货币的说法正确的是( ) A.铜来源广泛,易于从自然界冶炼得到 B.铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型 C.铜的外观为紫红色,大方美观,易于被人们接受 D.铜的化学性质不稳定,在空气中易转化为铜绿,铜绿具有抗腐蚀能力,易于流通 答案:B 2.把铜及其化合物的化学式与其颜色连接起来。 Cu CuSO4 白色 Cu2O 蓝色 Cu(OH)2 红色 CuSO4·5H2O 紫红色 CuO 棕黄色 CuCl2 黑色 Cu2S 答案: 3.下列有关铜的化合物的性质的叙述正确的是( ) A.CuSO4变成CuSO4·5H2O是物理变化 B.一定条件下,新制的Cu(OH)2悬浊液能与乙醛反应但不能与乙酸反应 C.CuO是黑色固体,与水反应可生成Cu(OH)2 D.Cu2O遇硝酸可能会被氧化成Cu2+ 解析:A项:CuSO4+5H2O===CuSO4·5H2O是化学变化;B项:Cu(OH)2与乙醛在加热的条件下能反应,在常温下,Cu(OH)2与乙酸也能发生中和反应;C项:CuO与水不反应;D项:。 答案:D [备考提醒] Cu2+在水溶液中的颜色 1.含Cu2+的溶液常为蓝色。 2.浓CuCl2溶液为蓝绿色,稀CuCl2溶液为蓝色。 题点二 铜及其化合物间的转化 4.已知CuO经高温灼烧生成Cu2O,Cu2O与H+发生反应:Cu2O+2H+===Cu+Cu2++H2O。将经高温灼烧后的CuO样品投入足量的热的稀硝酸溶液中,下列有关说法中正确的是( ) A.如果溶液变为蓝色、同时有紫红色固体出现,说明样品全部生成了Cu2O B.溶液中最终可能有紫红色固体出现 C.这种实验的结果无法说明CuO分解的程度 D.如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO没有分解 解析:若误认为Cu不与热的稀硝酸反应会造成错选D。如果样品部分生成了Cu2O,也会有类似现象发生,即这种实验的结果无法说明CuO分解的程度,A项错误、C项正确;由于Cu能够与热的稀硝酸反应,所以不论CuO是否完全分解,溶液中最终不可能有紫红色固体出现,B、D项错误。 答案:C 5.Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图: Cu2SCuCu2O、CuOAB胆矾 (1)Cu2S中铜元素的化合价为________,火法炼铜的反应原理是________________(用化学方程式表示)。 (2)向Cu2O、CuO中加入足量稀硫酸得到的体系A中溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式:________________。 (3)若将A中红色物质反应掉,操作Ⅰ中加入的试剂最好是________(填字母序号)。 A.适量的NaNO3 B.适量的HNO3 C.适量的H2O2 解析:(1)Cu2S中铜为+1价,火法炼铜中Cu、O被还原,S被氧化,反应原理为Cu2S+O22Cu+SO2。 (2)依据信息知Cu2O在酸性条件下生成Cu2+(蓝色)和单质铜(红色),写出反应物和生成物,配平方程式。 (3)H2O2不产生污染物。 答案:(1)+1 Cu2S+O22Cu+SO2 (2)Cu2O+2H+===Cu+Cu2++H2O (3)C 6.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为 (1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________。 a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化 c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化 (2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是______________________________________________。 答案:(1)ab (2)耗酸少;无污染性气体SO2产生 考点二|合金及常见金属材料(基础送分型——自主学习) 授课提示:对应学生用书第52页 [巩固教材知识] 1.合金 (1)概念: 合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质,而且是一种混合物。 (2)性能: ①多数合金的熔点比它的各成分金属的熔点低。 ②合金的硬度一般比它的各成分金属的硬度大。如生铁的熔点比纯铁的熔点低,硬度比纯铁的大。 2.常见金属材料 (1)重要的黑色金属材料——钢铁: ①钢是用量最大,用途最广的合金。 ②钢的分类: (2)有色金属材料——铜和铝: ①铜合金:我国使用最早的铜合金是青铜,常见的铜合金还有黄铜和白铜。 ②铝合金: 3.(RJ必修1·P681题改编)正误判断,正确的打“√”,错误的打“×”。 (1)合金的硬度一般比它的各成分金属的大。( ) (2)一般地,合金的熔点比它的各成分金属的更低。( ) (3)改变原料的配比、改变生成合金的条件,得到有不同性能的合金。( ) (4)合金比纯金属的导电性更强。( ) (5)合金比纯金属的应用范围更广泛。( ) (6)合金材料中不可能含有非金属元素。( ) (7)地震灾区重建要使用大量钢材,钢材是合金。( ) (8)铁是人类在生产、生活中最早使用的金属。( ) 答案:(1)√ (2)√ (3)√ (4)× (5)√ (6)× (7)√ (8)× [练透基础小题] 1.下列关于不锈钢和普通钢的认识中,正确的是( ) A.它们的组成元素是相同的 B.它们的主要成分都是铁,故化学性质完全相同 C.它们的耐腐蚀性能不同 D.它们的物理性质完全相同 答案:C 2.某合金与铁的物理性质的比较如下表所示: 熔点 / ℃ 密度/ (g/cm3) 硬度(金 刚石为10) 导电性 (银为100) 某合金 2 500 3.00 7.4 2.3 铁 1 535 7.86 4.5 17 还知该合金耐腐蚀、强度大,从以上性能看,该合金不适合做( ) A.导线 B.门窗框 C.炉具 D.飞机外壳 解析:该合金与铁的性质比较可知,其导电性比Fe差很多,不适合做导线。 答案:A 3.下表中是四种金属的熔、沸点数据: 金属 Na Al Cu Fe 熔点/ ℃ 97.81 660 1 038 1 535 沸点/ ℃ 883 2 467 2 567 2 750 (1)根据表中数据,归纳出两种金属不能形成合金的有哪些组合? ________________________________________________________________________。 (2)概括出能形成合金的两种金属应具备的条件。 ________________________________________________________________________ ________________________________________________________________________。 答案:(1)NaCu,NaFe (2)要形成合金,各成分都要有共同的液态温度范围,即合金中一种金属的熔点要高于另一种金属的熔点而低于它的沸点 考点三|金属矿物的开发和利用(基础送分型——自主学习) 授课提示:对应学生用书第53页 [巩固教材知识] 1.金属在自然界中的存在形式 2.金属冶炼的一般步骤 3.金属冶炼的实质 金属冶炼的过程就是把金属从化合态还原为游离态的过程。即:Mn++ne-===M。 4.金属冶炼的方法(用化学方程式表示) 5.正误判断,正确的打“√”,错误的打“×”。 (1)工业上通过电解氯化钠溶液制备金属钠和氯气。( ) (2)用金属钠能置换氯化铜溶液中的铜。( ) (3)工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应。( ) (4)电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al。( ) (5)用黄铜矿经电解精炼得到纯度为99.9%的铜。( ) (6)电解氯化镁溶液制取金属镁。( ) (7)用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物。( ) 答案:(1)× (2)× (3)√ (4)× (5)× (6)× (7)√ [练透基础小题] 题点一 金属的冶炼方法 1.下列有关金属冶炼的方法叙述正确的是( ) A.电解氯化镁水溶液制备金属镁 B.利用铝热反应制备金属铝 C.加热分解Fe2O3的方法制备金属铁 D.用火法或湿法均可制备金属铜 答案:D 2.(1)能否用电解AlCl3和MgO的方法冶炼Al、Mg? (2)冶炼Al时加入冰晶石(Na3AlF6)的目的是什么? 答案:(1)不能。因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不导电;而MgO虽是离子化合物,但其熔点太高,熔融会消耗大量的电能,成本较高。 (2)冰晶石可以降低Al2O3熔化的温度。 题点二 铝热反应冶炼难熔金属 3.用铝热反应还原下列物质,制得金属各1 mol时,消耗铝最少的是( ) A.MnO2 B.Cr2O3 C.V2O5 D.Fe3O4 解析:制得1 mol金属需要电子最少的消耗铝最少。A~D项制得1 mol金属需要电子的物质的量依次为4 mol、3 mol、5 mol、 mol。 答案:D 4.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验: ①取适量A进行铝热反应,产物中有单质B生成; ②另取20 g A全部溶于0.15 L 6.0 mol/L盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。 请填空: (1)①中引发铝热反应的实验操作是_______________________________, 产物中的单质B是________。 (2)②中所发生的各反应的化学方程式是____________________________________ _____________________________________________________________________。 (3)③中所发生的各反应的离子方程式是_____________________________________ ________________________________________________________________________。 答案:(1)加少量KClO3,插上镁条并将其点燃 Fe (2)Fe2O3+6HCl===2FeCl3+3H2O、 MgO+2HCl===MgCl2+H2O (3)Fe+2H+===Fe2++H2↑、Fe+2Fe3+===3Fe2+ [备考提醒] 有金属参加或生成的置换反应 1.活泼金属与水或酸反应置换出H2; 2.铁与水蒸气反应置换出H2; 3.水溶液中,金属活动性顺序表中排在前面的金属置换出排在后面的金属; 4.镁置换出碳:2Mg+CO22MgO+C; 5.铝热反应; 6.非水溶液中,非金属单质C、H2等可还原出Cu、Fe、W等金属。 题点三 金属铜的冶炼 5.工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如下: (1)气体A中的大气污染物可选用下列试剂中的________吸收。 a.浓硫酸 B.稀硝酸 c.NaOH溶液 d.氨水 (2)由泡铜冶炼粗铜的化学反应方程式为_______________________________________ ________________________________________________________________________。 (3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。 a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应 c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属 (4)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为____________________________________________________。 答案:(1)cd (2)3Cu2O+2AlAl2O3+6Cu (3)bd (4)4H++O2+4e-===2H2O [真题发掘·知识串联] 串线索 固双基 回扣关键知识 以黄铜矿冶炼铜的工艺流程为载体 串联金属冶炼的常用方法 授课提示:对应学生用书第54页 高考载体 (2012·山东高考卷) 工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如下: 知识串联——高考还可以这样考 (1)写出用电解法冶炼钠和铝的化学方程式:____________________________,________________________________________________________________________。 (2)工业上冶炼铁用的还原剂是什么?________,写出反应的化学方程式: ___________。 (3)由泡铜(Cu2O、Cu)冶炼粗铜的化学方程式是______________________________ ________________________________________________________________________。 (4)已知Cu2O能与稀H2SO4反应生成CuSO4和Cu,泡铜中的Cu2O和Cu均是红色物质,如何通过实验鉴别Cu2O与Cu?__________________________________________。 (5)冰铜(mCu2S·nFeS)中铜元素的化合价是多少?________,将冰铜中的Cu2S在O2中灼烧能冶炼出铜,试写出该反应的化学方程式:__________________________。 (6)由粗铜电解精炼铜时,粗铜接电源的正极还是负极?______________________。 (7)设计由粗铜、浓H2SO4、水等物质制备CuSO4的实验方案。_______________________。 答案:(1)2NaCl(熔融) 2Na+Cl2↑ 2Al2O3(熔融)4Al+3O2↑ (2)CO 3CO+Fe2O32Fe+3CO2 (3)3Cu2O+2Al6Cu+Al2O3 (4)将少量红色物质放入稀H2SO4中,有固体析出,若溶液变成蓝色,说明红色物质为Cu2O,若溶液不变蓝色,则红色物质为Cu (5)+1价 Cu2S+O22Cu+SO2 (6)正极 (7)由粗铜制备CuSO4的实验流程为 课时作业(授课提示:对应学生用书第261页) 1.(2017·湖南师大附中月考)下列有关说法中,正确的是( ) ①钢与纯铁相比较不易生锈 ②冶炼铝和钠都可以用电解法 ③KSCN溶液可以检验Fe3+ ④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金 A.①②③④⑤ B.②③④⑤ C.①③④ D.①②④⑤ 解析:①钢中含有碳等杂质容易形成原电池,腐蚀更快,错误;②冶炼铝和钠都是用电解法,正确;③铁离子遇到硫氰化钾显红色,正确;④钙是组成骨骼的重要元素,缺钙会使骨质疏松,血红蛋白中含有铁元素,缺铁会引起缺铁性贫血,正确;⑤青铜为铜锡等形成的合金,不锈钢为铁镍等形成的合金,硬铝为镁铝等形成的合金,正确。 答案:B 2.下列冶炼金属的原理正确的是( ) A.2Al2O3+3C4Al+3CO2↑ B.Fe2O3+3CO2Fe+3CO2 C.MgO+H2Mg+H2O D.2HgO2Hg+O2↑ 解析:A项冶炼金属Al所用的为电解熔融Al2O3;C项冶炼金属Mg所用的为电解熔融MgCl2;D项冶炼金属Hg所用的是热分解法。 答案:B 3.下列有关金属的工业制法正确的是( ) A.制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物 C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜 解析:钠与水反应,不能从溶液中置换出钛,A错;电解NaCl溶液得不到Na,C错;用粗铜电解精炼,而不是用黄铜矿,D错。 答案:B 4.Fe、Cu都是重要的金属元素。下列说法正确的是( ) A.两者的单质放置在空气中均只生成氧化物 B.两者的单质都能与稀硫酸反应产生氢气 C.常温条件下,两种金属都能溶解于浓硝酸中 D.制备FeCl3、CuCl2,均不能采用将其溶液直接蒸干的方法 解析:Cu放置在空气中可生成Cu2(OH)2CO3,A项错误;铜为不活泼金属,不能与稀硫酸反应生成氢气,B项错误;常温下,浓硝酸能够使铁钝化,C项错误;直接蒸干FeCl3、CuCl2溶液得到的固体分别是Fe(OH)3、Cu(OH)2,D项正确。 答案:D 5.铜在自然界多以化合态的形式存在于矿石中。常见的铜矿石有:黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)、辉铜矿(Cu2S)、孔雀石[CuCO3·Cu(OH)2]。下列说法不正确的是( ) A.可用稀盐酸除去铜器表面的铜绿 B.硫酸铜溶液可用作游泳池的消毒剂 C.工业上常采用电解法制取粗铜 D.在上述几种含铜化合物中,铜的质量分数最高的是Cu2S 答案:C 6.(2015·四川高考卷)下列有关CuSO4溶液的叙述正确的是( ) A.该溶液中Na+、NH、NO、Mg2+可以大量共存 B.通入CO2气体产生蓝色沉淀 C.与H2S反应的离子方程式:Cu2++S2-===CuS↓ D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O===Cu(OH)2↓+2NH 解析:A项,CuSO4溶液显酸性,Na+、NH、NO、Mg2+可以大量共存,A项正确;B项,CO2与CuSO4溶液不发生反应,违背了强酸制弱酸的原理,B项错误;C项,H2S属于弱电解质,书写离子反应方程式时,要写化学式,C项错误;D项,CuSO4溶液与过量浓氨水反应生成四氨基合铜离子,D项错误。 答案:A 7.已知下列转化关系中,M、N均为单质,则M可能是( ) A.Na B.Al C.Fe D.Cu 解析:Na、Al、Fe均为活泼金属,电解相关溶液不能制取其单质;电解铜盐溶液可以生成铜单质,转化关系可能是溶液。 答案:D 8.用锌、氧化铜、稀硫酸做原料制取铜,有下列两种途径: (1)ZnH2Cu; (2)CuOCuSO4Cu 若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( ) A.生成的硫酸锌质量相同 B.消耗相同质量的硫酸 C.消耗相同质量的锌 D.消耗相同质量的氧化铜 解析:H2还原CuO时H2的消耗量比理论值要多,则(1)中消耗Zn、H2SO4和生成的ZnSO4的量都多。 答案:D 9.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( ) A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2 B.相对于途径①、③,途径②更好地体现了绿色化学思想 C.1 mol CuSO4在1 100 ℃所得混合气体X中O2一定为0.75 mol D.Y可以是葡萄糖 解析:根据途径①中的离子反应方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O可知n(NO)∶n(H+)=2∶8,即n(H2SO4)∶n(HNO3)=3∶2,A项正确;途径②的反应为2Cu+O2+2H2SO4===2CuSO4+2H2O,不产生污染性气体,符合绿色化学思想,B项正确;葡萄糖与新制Cu(OH)2悬浊液生成Cu2O,D项正确。 答案:C 10.部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理: 下列说法正确的是( ) A.滤液A中的阳离子为Fe3+、Fe2+、H+ B.样品中Fe元素的质量为2.24 g C.样品中CuO的质量为4.0 g D.V=896 解析:根据题意,3.2 g滤渣一定是铜,而铜与Fe3+不共存,则A项错误;最后的3.2 g固体为Fe2O3,其中Fe元素的质量为2.24 g,B正确;样品中Cu元素和O元素共5.76 g-2.24 g=3.52 g,则C项错误;因2.24 g Fe元素已部分氧化,且Fe还与Fe3+、Cu2+发生反应,故生成的氢气的体积应小于896 mL,D错误。 答案:B 11.孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸): (1)反应①能观察到的现象是_________________________________________, 有关反应的化学方程式为______________________________________________ ________________________________________________________________________。 (2)反应②加入的金属可能是________,有关反应的离子方程式为________________。 解析:孔雀石中加入稀硫酸可看到孔雀石逐渐溶解,溶液由无色变为蓝色,且有气泡产生;反应的化学方程式为Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O。经过滤除去难溶于水和稀硫酸的杂质,则滤液中主要含有CuSO4,加入的金属粉末能将Cu2+从溶液中置换出来即可,故金属可能是Fe或Zn等。 答案:(1)固体逐渐消失,溶液由无色变成蓝色,有气泡产生 Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O (2)铁粉(答案合理即可) Fe+Cu2+===Fe2++Cu 12.(2016·四川高考卷)CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。 [资料查阅] [实验探究] 该小组用如图所示装置进行实验(夹持仪器略)。 请回答下列问题: (1)仪器X的名称是________。 (2)实验操作的先后顺序是a→________→e(填操作的编号)。 a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2 (3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是________________________________________________________________________。 (4)装置D中发生的氧化还原反应的离子方程式是 ________________________________________________________________________ ________________________________________________________________________。 [探究反思] (5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。根据资料信息分析: ①若杂质是CuCl2,则产生的原因是_____________________________________。 ②若杂质是CuO,则产生的原因是__________________________________________。 解析:(1)仪器X是干燥管。(2)根据实验要求及有关信息可知,首先检查装置的气密性,加入药品后应在“气体入口”处通入干燥HCl,再点燃酒精灯,加热,待反应完成后,熄灭酒精灯,冷却,最后停止通入HCl,然后通入N2赶出装置中的HCl气体和氯气,使反应气被充分吸收,故实验操作的顺序为a→c→d→b→e。(3)无水硫酸铜遇到CuCl2·2H2O分解产生的水后变为蓝色,而分解产生的氯气不被硫酸铜吸收,当氯气通过并接触湿润的蓝色石蕊试纸时,氯气遇水反应生成盐酸和次氯酸,盐酸使试纸先变红,次氯酸有强氧化性,可使变红色的试纸褪色。(4)D中的氢氧化钠吸收多余的Cl2和HCl气体,防止污染空气,其中发生的氧化还原反应的离子方程式为2OH-+Cl2===Cl-+ClO-+H2O。(5)由题给信息可知,①如果产生杂质是CuCl2,则产生的原因是没能保持温度在大于300 ℃条件下充分反应,即加热的时间不足或温度较低;②若杂质是CuO,则产生的原因是通入氯化氢的量不足,导致在加热失水过程中有部分CuCl2·2H2O发生水解生成Cu2(OH)2Cl2,最后分解生成CuO。 答案:(1)干燥管 (2)c→d→b (3)先变红,后褪色 (4)2OH-+Cl2===Cl-+ClO-+H2O (5)①加热时间不足或温度偏低 ②通入HCl的量不足 13.(2017·豫南四校联考)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。 Ⅰ.铁矿石中含氧量的测定 ①按如图组装仪器,____________________; ②将5.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略); ③从左端导气管口处不断地缓缓通入H2,待装置C出口处H2验纯后,点燃A处酒精灯; ④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。 (1)补全步骤①的操作: _____________________________________________。 (2)装置C的作用为______________________________________。 (3)测得反应后装置B增重1.35 g,则铁矿石中氧的质量百分含量为________。 Ⅱ.铁矿石中含铁量的测定 (1)步骤④中煮沸的作用是______________________。 (2)下列有关步骤⑥的操作中说法正确的是________(填字母)。 a.因为碘水为黄色,所以滴定过程中不需加指示剂 b.滴定过程中可利用淀粉溶液作为指示剂 c.滴定管用蒸馏水洗涤后可以直接装液 d.锥形瓶不需要用待测液润洗 e.滴定过程中,眼睛注视滴定管中液面变化 f.滴定结束后,30 s内溶液不恢复原来的颜色,再读数 (3)若滴定过程中消耗0.400 0 mol·L-1的KI溶液25.00 mL,则铁矿石中铁的质量百分含量为________。 Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为________。 解析:Ⅰ.(1)由于该实验中有气体通过装置参加反应,所以要检验装置的气密性。(2)该实验中,氢气和铁的氧化物反应生成金属铁和水,根据固体质量的变化来计算铁的含量,装置B处的干燥管作用是吸收反应产生的水蒸气,所以装置C要防止空气中的水蒸气和CO2进入装置B中,影响测定结果。(3)测得反应后装置B增重1.35 g,根据反应的实质,增加的是水的质量,n(H2O)==0.075 mol,则铁矿石中含有氧元素的物质的量是0.075 mol。根据质量守恒定律,铁矿石中氧的质量百分含量是×100%=24%。 Ⅱ.(1)溶液A中通入足量的Cl2,将Fe2+氧化为Fe3+,煮沸后可以降低Cl2在溶液中的溶解度,赶走溶液中溶解的过量Cl2,防止在步骤⑥中Cl2与KI反应,影响测定结果。(2)碘水为黄色,三价铁离子在溶液中也呈黄色,滴定过程中需加指示剂,a错误;滴定过程中,三价铁离子可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,不能确定是否达到滴定终点,b错误;滴定管用蒸馏水洗涤后必须用标准液润洗,c错误;锥形瓶不需要用待测液润洗,d正确;滴定过程中,眼睛应注视锥形瓶,观察颜色的变化,e错误;滴定结束后,30 s内溶液不恢复原来的颜色,再读数,f正确。(3)根据反应的方程式:2Fe3++2I-===2Fe2++I2,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即0.400 0 mol·L-1×0.025 L=c(Fe3+)×0.02 L,解得c(Fe3+)=0.5 mol·L-1。所以在10.0 g铁矿石中含有Fe元素的物质的量是n(Fe3+)=0.5 mol·L-1×0.25 L=0.125 mol,从而可求出铁元素的百分含量为×100%=70%。 Ⅲ.铁元素的质量分数是70%,氧元素的质量分数为24%,所以100 g铁矿石中,铁元素的质量是70 g,氧元素的质量是24 g。铁元素和氧元素的物质的量比为∶=5∶6,所以铁的氧化物的化学式为Fe5O6。 答案:Ⅰ.(1)检验装置的气密性 (2)防止空气中的水蒸气和CO2进入装置B中,影响测定结果 (3)24% Ⅱ.(1)赶走溶液中溶解的过量Cl2 (2)df (3)70% Ⅲ.Fe5O6查看更多