- 2021-07-08 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学一轮复习化学能与热能作业
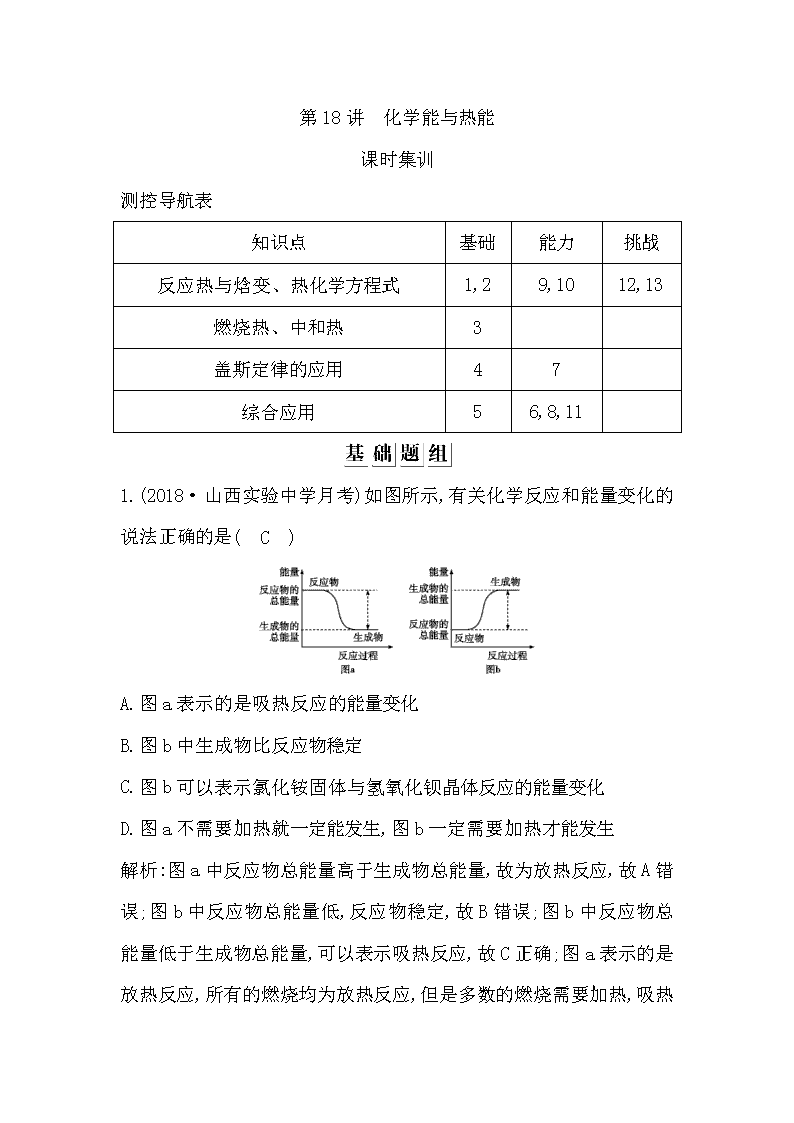
第18讲 化学能与热能 课时集训 测控导航表 知识点 基础 能力 挑战 反应热与焓变、热化学方程式 1,2 9,10 12,13 燃烧热、中和热 3 盖斯定律的应用 4 7 综合应用 5 6,8,11 1.(2018·山西实验中学月考)如图所示,有关化学反应和能量变化的说法正确的是( C ) A.图a表示的是吸热反应的能量变化 B.图b中生成物比反应物稳定 C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 D.图a不需要加热就一定能发生,图b一定需要加热才能发生 解析:图a中反应物总能量高于生成物总能量,故为放热反应,故A错误;图b中反应物总能量低,反应物稳定,故B错误;图b中反应物总能量低于生成物总能量,可以表示吸热反应,故C正确;图a表示的是放热反应,所有的燃烧均为放热反应,但是多数的燃烧需要加热,吸热反应也不一定需要加热,故D错误。 2.(2019·湖北武汉部分学校调研)已知化学反应S(l)+O2(g)SO2(g),通常情况下,燃烧1 mol S液体生成SO2气体放出293.23 kJ的热量。分析下列说法中正确的是( C ) A.1 mol固体S单质燃烧放出的热量大于293.23 kJ B.1 mol气体S单质燃烧放出的热量小于293.23 kJ C.1 mol SO2(g)的键能总和大于1 mol S(l)和1 mol O2(g)的键能 之和 D.1 mol SO2(g)的键能总和小于1 mol S(l)和1 mol O2(g) 的键能 之和 解析:因物质由液态转变成固态要放出热量,所以1 mol固体S单质燃烧放出的热量小于293.23 kJ,故A错误;因物质由液态转变成气态要吸收热量,所以1 mol气体S单质燃烧放出的热量大于293.23 kJ,故B错误;因放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1 mol SO2(g)的键能总和大于1 mol S(l)和1 mol O2(g)的键能总和,故C正确,D错误。 3.(2018·甘肃天水一中月考)下列说法正确的是( A ) A.在25 ℃、101 kPa,1 mol S(s)和2 mol S(s)的燃烧热相等 B.1 mol H2SO4(浓)与1 mol Ba(OH)2完全中和所放出的热量为中和热 C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 D.101 kPa时,1 mol H2燃烧所放出的热量为氢气的燃烧热 解析:燃烧热指25 ℃、101 kPa时1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,因此S的燃烧热相等,故A正确;中和热是稀酸与稀碱发生中和反应生成1 mol H2O时放出的热量,浓硫酸遇水放出热量,故B错误;所有的燃烧都是放热反应,故C错误;应是生成稳定的氧化物,即101 kPa时1 mol氢气燃烧产生的H2O是液态水时,放出的热量才是燃烧热,故D错误。 4.(2018·湖南长沙长郡中学月考)已知热化学方程式:①CH4(g)+ 2O2(g)CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol;②N2(g)+O2(g) 2NO(g) ΔH=+180 kJ/mol。则CH4(g)+4NO(g)CO2(g)+2N2(g)+ 2H2O(l)的ΔH为( A ) A.-1 250.3 kJ/mol B.-2 500.6 kJ/mol C.+1 250.3 kJ/mol D.+2 500.6 kJ/mol 解析:CH4(g)+4NO(g)CO2(g)+2N2(g)+2H2O(l),这个反应可由①-②×2得到,则由盖斯定律,ΔH=-890.3 kJ/mol-(+180 kJ/mol)×2=-1 250.3 kJ/mol,故A正确。 5.(2018·河南淮阳月考)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。 化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C 键能/ (kJ·mol-1) 460 360 436 431 176 347 提示:1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键。 请回答下列问题: (1)已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):SiC Si,Si SiO2。 (2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+ 4HCl(g),则2 mol H2生成高纯硅需 (填“吸收”或“放出”)能量 kJ。 (3)已知硅燃烧热的热化学方程式为Si(s)+O2(g)SiO2(s) ΔH= -989.2 kJ·mol-1,则OO键键能为 。 解析:(1)化学键越强,断裂时需要的能量越高,熔点越高,所以碳化硅的熔点强于硅,单质硅的熔点弱于二氧化硅。 (2)反应热就是断裂化学键吸收的能量和形成化学键放出的能量的差值,所以该反应的反应热是360 kJ·mol-1×4+2×436 kJ·mol-1-4× 431 kJ·mol-1-176 kJ·mol-1×2=+236 kJ·mol-1,所以是吸热反应。 (3)设O-O 键键能为x,由键能可知176 kJ·mol-1×2+x-4× 460 kJ·mol-1=-989.2 kJ·mol-1,所以x=498.8 kJ·mol-1 答案:(1)> < (2)吸收 236 (3)498.8 kJ·mol-1 6.(2018· 广西河池高级中学月考)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1 molN—N 键吸收 193 kJ 热量,断裂1 mol N≡N键吸收941 kJ热量,则下列说法不正确的是( B ) A.N4与N2互为同素异形体 B.1 mol N4气体转化为N2时要吸收724 kJ能量 C.N4变成N2是化学变化 D.N4分子中有6个共价键 解析:N4和N2均是氮元素形成的单质,互为同素异形体,A正确;1 mol N4转化为N2时能量变化为6×193 kJ-2×941 kJ=-724 kJ,即放出724 kJ能量,B不正确;N4和N2均是氮元素形成的单质,互为同素异形体,N4转化为N2属于化学变化,C正确;根据结构式可知N4分子中有6个共价键,D正确。 7.(2018·山东日照高三联考)已知CaSO4·2H2O脱水过程的热化学方程式如下: CaSO4·2H2O(s)CaSO4·H2O(s)+H2O(g) ΔH1=+83.2 kJ·mol-1 CaSO4·H2O(s)CaSO4(s)+H2O(g) ΔH2又知:CaSO4·2H2O(s) CaSO4(s)+2H2O(l) ΔH3=+26 kJ·mol-1 H2O(g)H2O(l) ΔH4=-44 kJ·mol-1 则ΔH2为( A ) A.+30.8 kJ·mol-1 B.-30.8 kJ·mol-1 C.+61.6 kJ·mol-1 D.-61.6 kJ·mol-1 解析:①CaSO4·2H2O(s)CaSO4·H2O(s)+H2O(g) ΔH1= +83.2 kJ·mol-1; ③CaSO4·2H2O(s)CaSO4(s)+2H2O(l) ΔH3=+26 kJ·mol-1; ④H2O(g)H2O(l) ΔH4=-44 kJ·mol-1; 根据盖斯定律,③-①-④×2,得CaSO4·H2O(s)CaSO4(s)+H2O(g) ΔH2,ΔH2=+30.8 kJ·mol-1,故A正确。 8.(2018·湖北华师一附中、黄冈中学等八校联考)已知 298 K时反应2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1,在相同温度下向一密闭容器中加入2 mol SO2和1 mol O2,达化学平衡时放出热量为a1 kJ;向另一容积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达化学平衡时放出热量为a2 kJ,则下列关系式中正确的是( B ) A.2a2>a1>197 B.2a2查看更多