山东省潍坊诸城市2019-2020学年高一下学期期中考试 化学 Word版含答案
www.ks5u.com
2019-2020学年下学期诊断性检测
高一化学
说明:
1.答题前,考生先将自己的学校、班级、姓名、考生号、座号填写在答题卡的相应位置。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5mm黑色签字笔书写在相应答题区域,超出答题区域书写的答案无效;在草稿纸和试卷上答题无效。
3.本试卷满分100分,考试时间90分钟。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl35.5 Cu64
一、选择题:本题共10个小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列装置工作时,将化学能转化为电能的是
2.随着航天技术的不断发展,我国“嫦娥工程”探月计划稳步实施。据科学家预测,月球土壤中吸附着数百万吨的He,而地球上氦元素主要以He的形式存在。下列说法不正确的是
A.He和He的中子数不同 B.He的化学性质比He活泼.
C.He和He的电子数相同 D.He和He是两种不同的核素
3.下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性依次减弱
C.第3周期主族元素的最高正化合价等于它所处的族序数
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
4.萨巴蒂尔反应CO2(g)+4H2(g)CH4(g)+2H2O(g) △H<0,可将CO2转化为天然气(CH4)。若容器容积不变,下列措施不能增大CO2转化率的是
A.充入He,使体系压强增大 B.降低温度
C.充入H2,使体系压强增大 D.将CH4从体系中分离
5.黑火药是我国古代四大发明之一,它是由木炭(C)、硫磺(S)、火硝(KNO3
- 9 -
)按一定比例混合而成,爆炸时发生反应:S+2KNO3+3CK2S+3CO2↑+N2↑。下列叙述不正确的是
A.K2S属于离子化合物 C.火硝中既含有离子键,又含有共价键
B.CO2和N2分子中均含有共价键 D.组成黑火药成分的元素都属于短周期元素
6.已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理如下:
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是
A.反应活化能等于98 kJ·mol-1 B.反应速率与I-浓度无关
C.I-是该反应的催化剂 D.v(H2O2)=v(H2O)=v(O2)
7.X、Y、Z、W四种短周期主族元素在周期表中的位置如图所示,且X原子最外层有4个电子。下列说法正确的是
A.离子半径:W->Z2- B.酸性:H2ZO4>H2XO3
C.还原性:Z2-
H2Z
8.热激活电池(又称热电池)可用作导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法不正确的是
A.钙电极是电池的负极
B.放电过程中,Li+向PbSO4电极移动
C.常温下,在正负极间接上电流表,指针发生偏转
D.正极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb
9.N2O4常用作火箭推进器的燃料。已知反应2NO2(g)N2O4(g) △H<0,不同条件下,N2O4的含量随时间(t)的变化如图,则反应历程从I改变为II所采取的措施可能是
- 9 -
A.增大NO2的浓度 B.升高温度 C.增大压强 D.加入催化剂
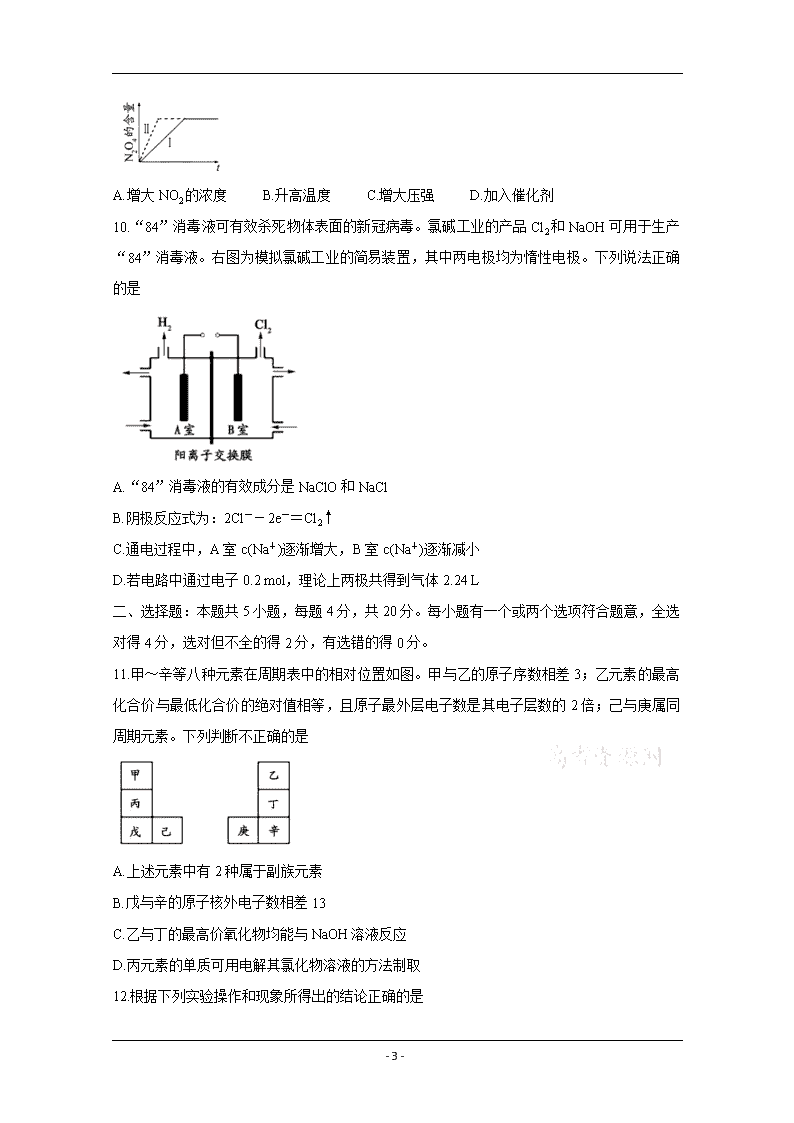
10.“84”消毒液可有效杀死物体表面的新冠病毒。氯碱工业的产品Cl2和NaOH可用于生产“84”消毒液。右图为模拟氯碱工业的简易装置,其中两电极均为惰性电极。下列说法正确的是
A.“84”消毒液的有效成分是NaClO和NaCl
B.阴极反应式为:2Cl--2e-=Cl2↑
C.通电过程中,A室c(Na+)逐渐增大,B室c(Na+)逐渐减小
D.若电路中通过电子0.2 mol,理论上两极共得到气体2.24 L
二、选择题:本题共5小题,每题4分,共20分。每小题有一个或两个选项符合题意,全选对得4分,选对但不全的得2分,有选错的得0分。
11.甲~辛等八种元素在周期表中的相对位置如图。甲与乙的原子序数相差3;乙元素的最高化合价与最低化合价的绝对值相等,且原子最外层电子数是其电子层数的2倍;己与庚属同周期元素。下列判断不正确的是
A.上述元素中有2种属于副族元素
B.戊与辛的原子核外电子数相差13
C.乙与丁的最高价氧化物均能与NaOH溶液反应
D.丙元素的单质可用电解其氯化物溶液的方法制取
12.根据下列实验操作和现象所得出的结论正确的是
- 9 -
13.全世界每年由于腐蚀而造成报废的钢铁高达总产量的三分之一。某校化学兴趣小组在一定条件下,研究发现碳钢腐蚀与溶液pH的关系如下表所示:
下列说法不正确的是:
A.当pH<4时,负极反应为Fe-2e-=Fe2+
B.当pH>6时,碳钢主要发生析氢腐蚀
C.当pH>14时,正极反应为O2+4H2O+4e-=4OH-
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
14.亚硝酰氯(NOCl)是有机合成中的重要试剂,由NO与Cl2反应制取NOCl的反应为:2NO(g)+Cl2(g)2NOCl(g) △H<0。当反应达到平衡后,下列分析正确的是
A.增大压强,对正反应的反应速率影响更大
B.升高温度,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
15.全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池,适合用作电动汽车的动力电源,其工作原理如图所示。已知充电过程中V3+发生还原反应。下列说法不正确的是
- 9 -
A.质子交换膜可阻止VO2+与V2+直接发生反应
B.充电时,阴极的电极反应为:V2+-e-=V3+
C.充电时,氢离子通过交换膜移向右侧
D.放电时,正极的电极反应为:VO2++e-+H2O=VO2++2OH-
三、非选择题:本题共5个小题,共60分。
16.(12分)某化学实验小组设计如图装置验证元素的非金属性强弱(夹持装置省略,装置A可加热)。
可选用的试剂:浓盐酸、浓硫酸、稀盐酸、稀硫酸、稀硝酸、MnO2固体、石灰石、Na2S溶液、Na2SiO3溶液、饱和食盐水、NaOH溶液、饱和NaHCO3溶液。
回答下列问题:
(1)验证非金属性:Cl>S
①利用装置A制取氯气,B中盛放饱和食盐水,则装置C中应选用的试剂是 ,装置D的作用是 。
②实验现象:当装置A开始产生黄绿色气体时,观察到C溶液中产生少量淡黄色物质,当黄绿色气体充满整个装置时,C溶液中产生大量淡黄色物质。试分析实验开始时C中产生少量淡黄色物质的原因 (用离子方程式回答)。
(2)验证非金属性:N>C>Si
①试剂a选用 ;装置C中的试剂是 。
②装置B中试剂的作用是 。
- 9 -
③可以证明实验结论的实验现象是 。
17.(10分)X、Y、Z、M、G五种元素均为短周期主族元素,且原子序数依次增大。其中X、M同主族;元素Y原子的最外层电子数等于最内层电子数的一半;元素Z的最高价氧化物对应的水化物,与强碱或强酸均能反应生成盐和水;M的氧化物是形成酸雨的主要物质。回答下列问题:
(1)元素X在元素周期表中的位置是 。写出元素G的离子结构示意图 。
(2)X、Y、M三种元素的简单离子半径由大到小的顺序为 (用离子符号表示)。
(3)M和G的最高价氧化物对应的水化物中,酸性强的是 (填写化学式)。
(4)写出元素Z的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式 。
18.(14分)氨是一种重要的化工原料,广泛应用于化肥、制药、合成纤维等领域。回答下列问题:
(1)研究工业合成氨N2(g)+3H2(g)2NH3(g) △H<0反应原理。在2L密闭容器中加入0.1 mol N2和0.3 mol H2,在不同条件下进行实验。实验I、II、III中c(N2)随时间(t)的变化如图所示。
①下列叙述能证明合成氨反应达到化学平衡状态的是 (填字母)。
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中混合气体的密度保持不变 d.2v正(H2)=3v逆(NH3)
②从开始到达到平衡状态的过程中,实验I用H2表示的平均反应速率为 ;实验II N2的平衡转化率为 。
③与实验II相比,实验II所采用的实验条件可能为 (填字母)。
a.使用催化剂 b.升高温度 c.降低温度 d.增大压强 e.减小压强
(2)科研工作者成功实现利用太阳能合成氨,其简易装置如图所示。
- 9 -
①写出装置阴极的电极反应式 。
②装置工作时电解质溶液中的H+向 (填写“a”或“b”)极区移动;工作一段时间后,a极区与b极区产生气体的物质的量之比为 。
19.(10分)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。利用印刷电路板为原料回收铜的一种工艺流程如图所示。
回答下列问题:
(1)写出NH4Cl中阳离子的电子式 。
(2)操作I和操作II中都需要用到的玻璃仪器有烧杯、 (填写名称)。
(3)加入H2O2、NH3和NH4Cl溶液,将废电路板中的Cu转化为[Cu(NH3)4]2+,写出反应的离子方程式 。
(4)电解过程采用石墨作电极,写出阳极反应式 。
(5)流程中有三次实现了试剂的循环使用,除了NH3、NH4Cl和RH以外,还有 (填化学式)。
20.(14分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
- 9 -
写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式 。
(2)H2S可用于高效制取氢气,其反应为2H2S(g)S2(g)+2H2(g) △H。若向体积均为2L的A、B两个恒容容器中分别加入2.0 mol H2S、1.0 mol H2S,测得不同温度下H2S的平衡转化率如图所示。
①试判断△H 0(填“>”“<”或“=”);图中曲线表示A容器中反应的是 (填写“I”或“II”);反应速率最小的点是 (填写“M”、“N”或“P”)。
②实际生产中,若要进一步提高H2S的转化率,除了改变温度和压强外,还可以采取的措施有 。
(3)储氢还可借助有机物。一定条件下,利用如图所示装置电解有机物C6H6可实现电化学储氢。
①电极B是 (填写“阴极”或“阳极”)。
②写出实现储氢过程的电极反应式 。
③通电一段时间,若产生x mol O2,测得产生的混合气体中含有y mol H2,试计算制得储氢物质C6H12的物质的量为 mol(用含x、y的代数式表示)。
- 9 -
- 9 -