- 2021-07-06 发布 |
- 37.5 KB |
- 30页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版镁、铝及其重要化合物学案(3)
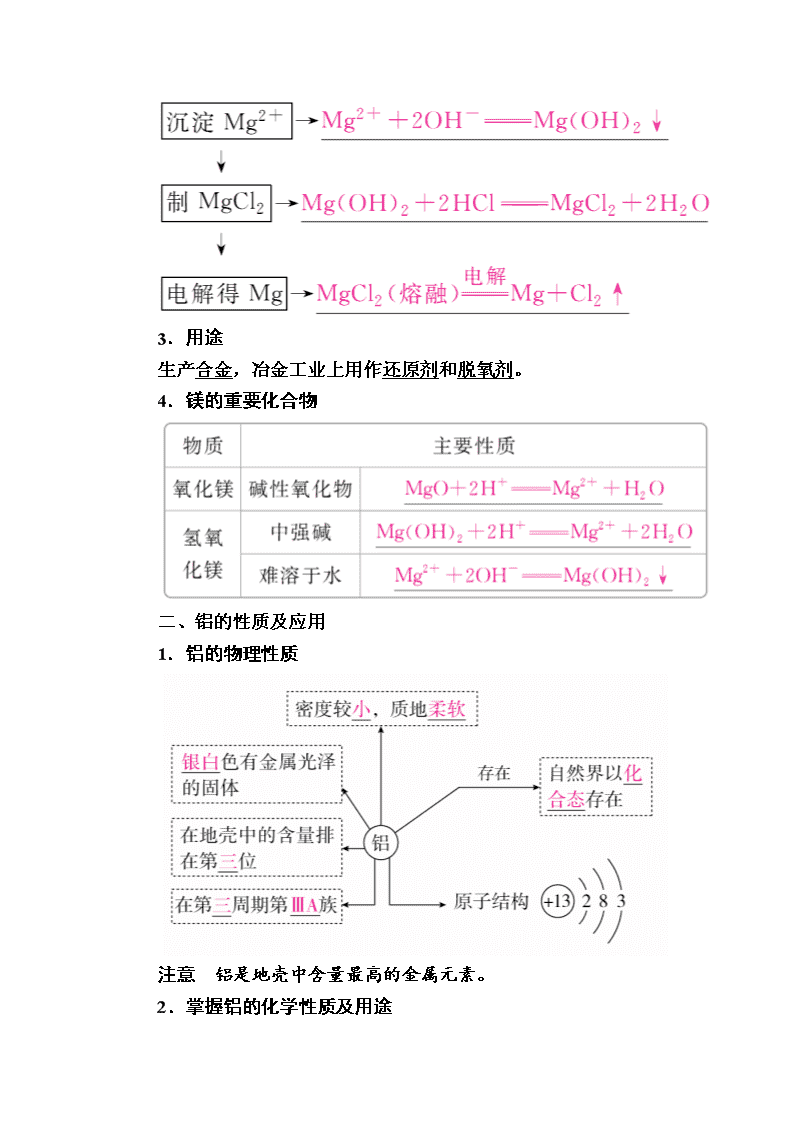
第10讲 镁、铝及其重要化合物 一、镁及其重要化合物的主要性质和应用 1.镁的性质 (1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、导热性和延展性。 (2)化学性质 ①与非金属反应 ②与CO2反应:2Mg+CO22MgO+C ③与H2O反应:Mg+2H2OMg(OH)2+H2↑ ④与H+反应:Mg+2H+===Mg2++H2↑ 2.海水提镁 3.用途 生产合金,冶金工业上用作还原剂和脱氧剂。 4.镁的重要化合物 二、铝的性质及应用 1.铝的物理性质 注意 铝是地壳中含量最高的金属元素。 2.掌握铝的化学性质及用途 (1)铝的化学性质 写出图中标号反应的化学方程式或离子方程式: (2)铝的制备及用途 三、铝的重要化合物 1.氧化铝 (1)物理性质:白色固体,难溶于水,有很高的熔点。 (2)化学性质 2.氢氧化铝 (1)物理性质 白色胶状不溶于水的固体,有较强的吸附性。 (2)化学性质(用化学方程式表示) Al(OH)3的电离方程式为 ②受热分解:2Al(OH)3Al2O3+3H2O。 (3)制备 ①向铝盐中加入氨水,离子方程式为 Al3++3NH3·H2O===Al(OH)3↓+3NH。 ②向NaAlO2溶液中通入足量CO2,离子方程式为AlO+CO2+2H2O===Al(OH)3↓+HCO。 ③NaAlO2溶液与AlCl3溶液混合: 3AlO+Al3++6H2O===4Al(OH)3↓。 3.常见的铝盐 (1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。 (2)明矾的化学式为KAl(SO4)2·12H2O,它是无色晶体,可溶于水,水溶液pH<7(填“<”“>”或“=”)。明矾可以净水,其净水的原理是Al3++3H2O??Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中杂质形成沉淀而净水。 1.正误判断,正确的画“√”,错误的画“×”。 (1)工业电解熔融MgCl2得到的镁需在CO2气体中冷却。( ) (2)在CO2中,Mg燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性。( ) (3)1 mol铝分别与足量的盐酸或NaOH溶液充分反应,产生氢气的量相同。( ) (4)将铝片放入到浓硝酸或浓硫酸中没有明显现象,说明铝与这两种溶液不能发生化学反应。( ) (5)用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低。( ) 答案 (1)× (2)√ (3)√ (4)× (5)× 2.教材改编题 (据人教必修一P54 T6)相同体积、相同物质的量浓度的NaOH溶液和盐酸,分别与足量铝反应,生成的H2在相同条件下的体积之比为( ) A.1∶1 B.2∶1 C.3∶1 D.3∶2 答案 C 考点1 镁及其重要化合物的性质和应用 典例1 镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是( ) A.①和② B.②和③ C.③和④ D.④和⑤ 解析 点燃或高温条件下Mg与O2、CO2、N2均反应,故不能在这些气体中冷却,故选C。 答案 C 名师精讲 Mg及其化合物的特性 (1)Mg在空气中燃烧得到的固体物质主要为MgO和少量Mg3N2及C的混合物。 (2)Mg着火后,不可用CO2灭火。 (3)MgO的熔点高,常用作耐火材料。 (4)Mg(OH)2为难溶于水的白色沉淀,常用NaOH溶液检验Mg2+的存在。 (5)由于Mg(OH)2的溶解度比MgCO3的小,故水垢的主要成分中含有的是Mg(OH)2,而非MgCO3。 1.某同学通过系列实验探讨Mg及其化合物的性质,操作正确且能达到目的的是( ) A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg的活泼性 B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 答案 B 解析 稀释浓硫酸时,应将浓硫酸沿着器壁慢慢加入水中,并及时搅拌,A不正确;过滤时需要用玻璃棒引流,因此C不正确;蒸发溶液时应该用蒸发皿而不是表面皿,由于MgCl2水解,所以加热时必需在HCl的气氛中加热才能得到MgCl2固体,所以D不正确。 2.(1)海水提镁的一段工艺流程如下图: 浓海水的主要成分如下: 离子 Na+ Mg2+ Cl- SO 浓度/(g·L-1) 63.7 28.8 144.6 46.4 该工艺过程中,脱硫阶段主要反应的离子方程式为__________________________________________________________,产品2的化学式为________,1 L浓海水最多可得到产品2的质量为________g。 (2)采用电解熔融的氯化镁制取金属镁,发生反应的化学方程式为__________________________________________________________。 答案 (1)Ca2++SO===CaSO4↓ Mg(OH)2 69.6 (2)MgCl2Mg+Cl2↑ 解析 (1)由题给海水的主要成分,脱硫就是除掉硫酸根离子,发生反应:Ca2++SO===CaSO4↓;由框图信息知,产品2为Mg(OH)2;1 L浓海水中含有Mg2+28.8 g,物质的量为1.2 mol,则最多生成Mg(OH)21.2 mol,质量为1.2 mol×58 g·mol-1=69.6 g。 (2)电解熔融氯化镁生成氯气和单质镁。 考点2 铝的性质及应用 典例2 铝作为一种特殊的金属,既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2,就铝的这些特性回答下列问题: (1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。 (2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。 (3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。 解析 (1)根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑得Al与H2的关系式均为2Al~3H2,故只要参加反应的Al的量相等,所得H2的量必相等。 (2)因为在反应中Al过量,产生的H2由HCl和NaOH的量决定。根据化学反应中的关系式:6HCl~3H2、2NaOH~3H2,故当HCl、NaOH的物质的量相等时,二者产生H2的体积比为1∶3。 (3)因为铝足量且产生的H2相等,根据关系式n(HCl)∶n(NaOH)=3∶1,又因为两溶液体积相等,故物质的量浓度c(HCl)∶c(NaOH) =n(HCl)∶n(NaOH)=3∶1。 答案 (1)1∶1 (2)1∶3 (3)3∶1 名师精讲 铝与酸、碱反应生成H2的量的关系 铝与盐酸、氢氧化钠反应的化学方程式分别为2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑。从化学方程式可以看出Al与酸、碱反应时生成H2的实质都是AlAl3+/AlO,所以无论与酸还是与碱反应,Al与H2的关系都是2Al~3H2。 (1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比=1∶1。 (2)足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比=1∶3。 (3)一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,产生氢气的体积比<<,则必定是①铝与盐酸反应时,铝过量而盐酸不足;②铝与氢氧化钠反应时,铝不足而氢氧化钠过量。解题时应充分利用上述过量关系。 铝的这种既能与酸(非氧化性酸)反应又能与强碱反应产生H2的性质常作为推断题的“题眼”。 3.科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水的酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而达到预期目的。下列判断错误的是( ) A.处理废水时铝单质转化为Al3+ B.处理废水时亚硝酸盐被还原 C.处理过程中,OH-参与了反应 D.铝粉颗粒大小影响废水处理的速率 答案 A 解析 pH>12,溶液显碱性,则处理废水时,铝单质转化为AlO,A错误;铝是金属,具有还原性,因此处理废水时,亚硝酸盐被还原,B正确;处理废水时铝单质转化为AlO,这说明OH-参与了反应,C正确;固体反应物的表面积越大,反应速率越快,因此铝粉颗粒的大小影响废水处理的速率,D正确。 4.甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积之比为1∶2,则加入的铝粉的质量为( ) A.5.4 g B.3.6 g C.2.7 g D.1.8 g 答案 A 解析 其反应原理分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的HCl和NaOH的物质的量一样多时,产生H2的体积比是1∶3,而题设条件体积比为1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于NaOH来说是不足的。 2Al+6HCl === 2AlCl3+3H2↑ 6 mol 3 mol 3 mol·L-1×0.1 L 0.15 mol 则Al与NaOH反应生成的H2为0.15 mol×2=0.3 mol。 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 2×27 g 3 mol 5.4 g 0.3 mol 即投入的铝粉为5.4 g。 考点3 铝的重要化合物 典例3 工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3 作冶炼铝的原料,提取时操作过程如下图,指出图中操作错误的是( ) A.④⑤ B.③④ C.②⑤ D.①② 解析 由流程图可知,反应③得到的滤液为NaAlO2溶液,加入过量盐酸后得到AlCl3而不是Al(OH)3沉淀,应通入过量CO2,操作④错误;Al(OH)3在常温干燥条件下并不发生分解,故操作⑤需要加热灼烧,⑤错误。 答案 A 名师精讲 1.两种提纯氧化铝的方案 铝是地壳中含量最多的金属元素,在自然界中主要以化合态形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因而可设计出两种提纯氧化铝的方案。 方案一:碱溶法 方案二:酸溶法 2.Al(OH)3的特性 (1)Al(OH)3是一种不溶于水的白色胶状物,能作净水剂,能中和胃酸,也是一种阻燃材料。 (2)Al(OH)3具有两性,能溶于强酸、强碱,但不溶于弱酸(如H2CO3)、弱碱(如氨水)。因此,制备Al(OH)3是用可溶性铝盐与过量氨水反应而不用NaOH溶液。 (3)中学化学中常见的既能与盐酸反应,又能与NaOH溶液反应的物质有①Al、②Al2O3、③Al(OH)3、④多元弱酸的酸式盐(如NaHCO3)、⑤弱酸的铵盐[如(NH4)2CO3]。 3.铝的化合物间的转化关系及应用 (1)Al3+、AlO、Al(OH)3的转化关系 (2)铝盐与强碱(如NaOH)溶液反应,铝元素的存在形式 (3)应用 ①鉴别(利用滴加试剂顺序不同,现象不同): a.向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。 b.向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。 ②分离提纯: a.利用Al能溶于强碱溶液,分离Al与其他金属的混合物。如Mg(Al):加足量NaOH溶液; b.利用Al2O3能与强碱溶液反应,分离Al2O3与其他金属氧化物。如Fe2O3(Al2O3):加足量NaOH溶液; c.利用Al(OH)3能与强碱溶液反应,分离Al3+与其他金属阳离子。如Mg2+(Al3+):加过量NaOH溶液,过滤,再加酸充分溶解。 5.下列各组物质,不能按(“―→”表示反应一步完成)关系转化的是( ) 选项 a b c A Al2O3 NaAlO2 Al(OH)3 B AlCl3 Al(OH)3 NaAlO2 C Al Al(OH)3 Al2O3 D MgCl2 Mg(OH)2 MgO 答案 C 解析 各选项中物质间的转化为:A项,Al2O3NaAlO2 eq o(――→,sup17(CO2))Al(OH)3Al2O3;B项,AlCl3Al(OH)3NaAlO2AlCl3;D项,MgCl2Mg(OH)2MgOMgCl2;C项中,Al不能一步转化成Al(OH)3。 6.铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3、Fe2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: 回答下列问题: (1)写出反应1的化学方程式______________________________________________________; (2)滤液Ⅰ中加入CaO生成的沉淀是________,反应2的离子方程式为____________________________________________; (3)电解制铝的化学方程式是____________________。 答案 (1)2NaOH+SiO2===Na2SiO3+H2O、 2NaOH+Al2O3===2NaAlO2+H2O (2)CaSiO3 AlO+CO2+2H2O===Al(OH)3↓+HCO (3)2Al2O3(熔融)4Al+3O2↑ 解析 本题是常考的Al的制备实验,由流程图可知反应1用于溶解二氧化硅和氧化铝,Fe2O3不与碱反应,利用过滤除去 Fe2O3 ,所以滤液中的成分为硅酸钠和偏铝酸钠,加入氧化钙后硅酸钠转化为硅酸钙沉淀,偏铝酸钠溶液中通入二氧化碳气体后转变为氢氧化铝,加热后生成氧化铝,电解氧化铝制备金属铝。 考点4 铝三角及其应用 典例4 下列实验操作对应的图像不正确的是( ) 解析 A项,向MgCl2、AlCl3溶液中加入NaOH溶液,会产生Al(OH)3、Mg(OH)2沉淀,当NaOH溶液过量时,Al(OH)3沉淀又逐渐溶解,最后只剩余Mg(OH)2沉淀,图像与反应事实符合,正确;B 项,向HCl、MgCl2、AlCl3、NH4Cl溶液中加入NaOH溶液,首先与HCl反应,无沉淀产生,然后产生Al(OH)3、Mg(OH)2沉淀,再生成NH3·H2O,最后Al(OH)3沉淀溶解,只有Mg(OH)2沉淀,图像与反应事实符合,正确;C项,向NaOH、NaAlO2溶液中加入HCl溶液,首先与NaOH反应,没有沉淀生成,然后与AlO反应生成Al(OH)3沉淀,HCl溶液过量后,Al(OH)3沉淀完全溶解, 图像与反应事实符合,正确;D项,向NaOH、Na2CO3混合溶液中滴加稀盐酸,首先与NaOH反应,没有气体生成,后与Na2CO3反应生成NaHCO3,没有气体生成,再与NaHCO3生成气体,图像与反应事实不符合,符合题意。 答案 D 名师精讲 1.铝盐与碱、偏铝酸盐与酸反应的六大图像 2.制备Al(OH)3的三种方法 方法一:可溶性铝盐溶液与过量氨水反应 离子方程式:Al3++3NH3·H2O===Al(OH)3↓+3NH 方法二:向可溶性偏铝酸盐溶液中通入过量CO2 离子方程式: AlO+2H2O+CO2===Al(OH)3↓+HCO 方法三:相互促进水解法 3.破解Al(OH)3图像计算的技巧 当横坐标为NaOH溶液,纵坐标为沉淀的物质的量(或质量)时,可利用Al(OH)3溶于NaOH溶液的“量”的关系来计算。原溶液中Al3+的物质的量、沉淀溶解过程中消耗NaOH的物质的量与沉淀中Al(OH)3的物质的 量或原溶液中Al3+的物质的量相等。抓住这一定量关系可迅速破题。例如,向MgCl2、AlCl3混合溶液中加入NaOH溶液的图像如下所示。 则AB段为Al(OH)3溶于NaOH的过程,原溶液中n(Al3+)=n[Al(OH)3]=(0.6-0.5)mol=0.1 mol, n(Mg2+)==0.1 mol。 4.含Al3+的混合溶液与碱反应的先后顺序 当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,NaOH 先与H+反应,再与Al3+、Mg2+反应生成沉淀,再与NH反应,最后才溶解Al(OH)3沉淀。 7. 如图是向MgCl2、AlCl3混合液中依次加入M和N时生成沉淀的物质的量与加入的M和N的体积关系图(M、N分别表示盐酸或氢氧化钠溶液中的一种),以下结论不正确的是( ) A.混合溶液中c(AlCl3)∶c(MgCl2)=1∶1 B.混合溶液中c(AlCl3)∶c(MgCl2)=3∶1 C.点V之前加NaOH溶液,点V之后加盐酸 D.所加盐酸与NaOH溶液中溶质的物质的量浓度相同 答案 B 解析 ①O~A ②A~B ③B~COH-+H+===H2O ④C~D ⑤D~E 8.某溶液中可能含有H+、NH、Mg2+、Al3+、Fe3+、CO、SO、NO中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( ) A.溶液中的阳离子只有H+、Mg2+、Al3+ B.溶液中n(NH)=0.2 mol C.溶液中一定不含CO,可能含有SO和NO D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1 答案 B 解析 由①知溶液中一定含有H+,一定没有CO、NO,由②及图像知溶液中一定含有Mg2+、Al3+和NH,且n(NH)=0.7 mol-0.5 mol=0.2 mol,n(H+)=0.1 mol,n(Al3+)=0.8 mol-0.7 mol=0.1 mol,沉淀Al3+、Mg2+共消耗0.4 mol OH-,其中沉淀Al3+消耗0.3 mol OH-,沉淀Mg2+消耗0.1 mol OH-,根据Mg2+~2OH-,可得n(Mg2+)=0.05 mol,故只有选项B正确。 (建议用时:40分钟) 一、选择题(每题6分,共66分) 1.下列关于铝及其化合物的叙述正确的是( ) A.铝罐可久盛食醋 B.氢氧化铝可作胃酸的中和剂 C.明矾用作净水剂不涉及化学变化 D.铝与Fe2O3发生铝热反应,反应后固体物质增重 答案 B 解析 铝罐容易受食醋中的醋酸腐蚀而损坏,无法久盛食醋,A错;明矾用作净水剂是利用Al3+水解生成的氢氧化铝胶体的吸附性,涉及化学变化,C错;铝与氧化铁反应,反应前后都是固体,质量不变,D错。 2.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( ) A.此法的优点之一是原料来源丰富 B.第④步也可采用电解MgCl2溶液的方法 C.①②③步骤的目的是从海水中提取MgCl2 D.以上提取镁的过程中涉及化合、分解和复分解反应 答案 B 解析 电解MgCl2溶液得不到金属镁,B错误。 3.下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( ) ①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al A.全部 B.只有①③④⑤ C.只有③④⑤ D.只有②③④⑤ 答案 A 解析 弱酸的酸式盐、弱酸的铵盐、Al、Al2O3、Al(OH)3等物质既可与强酸反应又可与强碱反应,故选A。 4.镁、铝单质的化学性质以相似性为主,但也存在某些重大差异性,下列物质能用于证明二者存在较大差异性的是( ) ①CO2 ②盐酸 ③NaOH溶液 ④CuSO4溶液 A.①④ B.②③ C.①③ D.②③④ 答案 C 解析 镁能与CO2反应而铝不能,铝能与NaOH溶液反应而镁不能。 5.足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是( ) A.氢氧化钠溶液 B.稀硫酸 C.盐酸 D.稀硝酸 答案 A 解析 A项,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,1 mol Al消耗1 mol NaOH;B项,2Al+3H2SO4===Al2(SO4)3+3H2↑,1 mol Al消耗1.5 mol H2SO4;C项,2Al+6HCl===2AlCl3+3H2↑,1 mol Al消耗3 mol HCl;D项,Al和稀硝酸反应不放H2。综上所述,符合题意的是A项。 6.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( ) A.3 mol·L-1 HCl B.4 mol·L-1 HNO3 C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4 答案 A 解析 在镁、铝混合物中加入HNO3和浓H2SO4都不产生H2;加入NaOH溶液,只有Al与之反应生成H2,而镁不反应;加入盐酸,镁、铝都与盐酸反应生成H2,所以放出H2的量最多。 7.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示。原溶液中Cl-与SO的物质的量之比为( ) A.1∶3 B.2∶3 C.6∶1 D.3∶1 答案 C 解析 OA上升的直线表示Al(OH)3和Mg(OH)2一起沉淀,AB下降的直线表示Al(OH)3沉淀溶解,B点表示Al(OH)3完全溶解。AB段完全溶解Al(OH)3消耗NaOH溶液0.1 L,则Al3+生成Al(OH)3消耗NaOH溶液0.3 L,沉淀Mg2+消耗NaOH溶液0.1 L,因而n(AlCl3)∶n(MgSO4)=2∶1,所以,n(Cl-)∶n(SO)=6∶1。 8. 已知A、B、D、E均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。下列说法错误的是( ) A.A、B、D可能是钠及其化合物 B.A、B、D可能是镁及其化合物 C.A、B、D可能是铝及其化合物 D.A、B、D可能是非金属及其化合物 答案 B 解析 A项,A为NaOH、B为NaHCO3、D为Na2CO3、E为CO2时满足框图转化关系,正确;B项,镁及其化合物不满足此转化关系,错误;C项,A为AlCl3,E为NaOH,B为NaAlO2,D为 Al(OH)3时满足框图转化关系,正确;D项,A为C、E为O2、B为CO2、D为CO时满足框图转化关系,所以A、B、D可能是非金属及其化合物,正确。 9.通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一。下列由实验现象得出正确结论的是( ) 选项 实验现象 结论 A 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 由此得出:铝的金属性比镁强 B 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有滴落 由此得出:铝不易燃烧 C 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 由此得出:该气体是氨气 D 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 由此得出:氢氧化铝能溶于强碱溶液 答案 D 解析 A项,比较金属性的强弱是用金属单质与水或酸反应产生H2的快慢程度,错误;B项,由于生成了熔点很高的氧化铝,起到隔绝空气的作用,错误;C项,产生的气体应为H2和NH3的混合气体,错误。 10.下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( ) A.向1 L浓度均为0.1 mol·L-1的NaAlO2、Ba(OH)2混合溶液中加入0.1 mol·L-1的稀H2SO4 B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液 C.向烧碱溶液中滴加明矾溶液 D.向AlCl3溶液中滴加过量氨水 答案 A 解析 A项,Ba(OH)2和NaAlO2中加入稀H2SO4,发生的反应依次为Ba2++2OH-+2H++SO===BaSO4↓+2H2O、AlO+H++H2O===Al(OH)3↓、Al(OH)3+3H+===Al3++3H2O,所以加入1 L稀H2SO4时,Ba(OH)2反应完,再加0.5 L稀H2SO4时AlO反应完,再加1.5 L稀H2SO4时,Al(OH)3全部溶解,正确;B项,向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的NaOH溶液,发生的反应依次是Al3++3OH-===Al(OH)3↓、OH-+NH===NH3·H2O、Al(OH)3+OH-===AlO+2H2O,所以沉淀Al3+和溶解Al(OH)3所用NaOH溶液的体积之比为3∶1,而图像上看到的是1∶1,错误;C项,向烧碱溶液中滴加明矾溶液,发生的反应依次是Al3++4OH-===AlO+2H2O、Al3++3AlO+6H2O===4Al(OH)3↓ ,所以无现象阶段与产生沉淀阶段所加入的明矾溶液体积之比为3∶1,错误;D项,AlCl3溶液中滴加过量氨水,沉淀不会溶解 ,错误。 11.将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示: 则下列说法不正确的是( ) A.镁和铝的总质量为9 g B.最初20 mL NaOH溶液用于中和过量的硫酸 C.硫酸的物质的量浓度为2.5 mol/L D.生成的氢气在标准状况下的体积为11.2 L 答案 D 解析 由图像知,n[Mg(OH)2]=0.15 mol,n[Al(OH)3]=0.35 mol-0.15 mol=0.2 mol,则m(Mg)=0.15 mol×24 g/mol=3.6 g,m(Al)=0.2 mol×27 g/mol=5.4 g,所以镁和铝的总质量为9 g;由图像知,最初20 mL NaOH溶液用于中和过量的硫酸;当沉淀达到最大值时,溶液中的溶质只有Na2SO4,则有n(Na+)=2n(SO),即n(NaOH)=2n(H2SO4),所以,硫酸的物质的量浓度为=2.5 mol/L;0.15 mol的Mg生成的氢气在标准状况下的体积为3.36 L,0.2 mol的Al生成的氢气在标准状况下的体积为6.72 L,所以镁和铝混合物生成的氢气在标准状况下的体积为10.08 L,故选D项。 二、非选择题(共34分) 12.(10分)实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种实验方案: 方案① Al→Al3+→Al(OH)3 方案② Al→AlO→Al(OH)3 方案③ →Al(OH)3 (1)用方案①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是_________________________ ________________________________________________________; 写出该方案中有关的离子方程式:_______________________ _________________________________________________________。 (2)用方案②来制备Al(OH)3时,必须注意________的用量,以防止生成的Al(OH)3溶解。 (3)三种方案中,你认为最好的是________(填序号),原因是______________________。 答案 (1)若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量 2Al+6H+===2Al3++3H2↑,Al3++3NH3·H2O===Al(OH)3↓+3NH (2)稀硫酸 (3)③ 药品用量最少 解析 分析本题应从Al(OH)3的两性着手,过量的强酸、强碱均会降低Al(OH)3的产率,而Al3+与AlO反应制取Al(OH)3,则不存在该问题,故方案③最佳。 13.(10分)某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示: 请回答下列问题: (1)粉碎后的铝土矿碱浸时应在高温下进行,其目的是______________________。 (2)AlO(OH)与NaOH溶液反应的化学方程式为_______________________________________________________。 (3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的________气体的方法来代替。 (4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:________________________________________________________。 (5)该生产流程能实现____________(填化学式)的循环利用。 答案 (1)加快反应速率 (2)AlO(OH)+NaOH===NaAlO2+H2O (3)CO2 (4)Na2CO3+Ca(OH)2===CaCO3↓+2NaOH (5)NaOH 解析 (1)粉碎后的铝土矿碱浸时应在高温下进行,是因为温度越高,反应速率越快。 (2)AlO(OH)与NaOH溶液反应,最后得到偏铝酸钠,钠和铝的物质的量之比为1∶1所以AlO(OH)与NaOH以物质的量之比1∶1反应,即反应的化学方程式为AlO(OH)+NaOH===NaAlO2+H2O。 (3)“稀释、结晶”工艺中,也可以用偏铝酸盐与CO2 反应代替,即2H2O+AlO+CO2===Al(OH)3↓+HCO。 (4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,杂质是碳酸钠,碳酸钠与氢氧化钙反应生成苛性钠,从而除去碳酸根离子,化学方程式为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。 (5)后续反应中又生成氢氧化钠,而开始时是用氢氧化钠溶液溶解铝土矿,故该生产流程能实现循环利用的是NaOH。 14.(14分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: (1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。 (2)如下图所示,过滤操作中的一处错误是________。 (3)判断流程中沉淀是否洗净所用的试剂是________。高温焙烧时,用于盛放固体的仪器名称是________。 (4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。 装置B中盛放饱和NaCl溶液,该装置的主要作用是_______________。F中试剂的作用是________________________,用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________________。 答案 (1)B (2)漏斗下端尖嘴没有紧靠烧杯内壁 (3)AgNO3溶液(或硝酸酸化的AgNO3溶液) 坩埚 (4)除去氯气中HCl 防止水蒸气进入E 碱石灰(或NaOH与CaO混合物) 解析 (1)Mg2+、Al3+同时生成沉淀,则先加入氨水。 (2)过滤时漏斗下端尖嘴没有紧靠烧杯内壁。 (3)检验沉淀是否洗净可向洗涤液中加入AgNO3溶液,观察是否有沉淀产生。高温焙烧在坩埚中进行。 (4)装置B中饱和NaCl溶液用于除去氯气中HCl,F盛装浓硫酸,防止水蒸气进入E。用干燥管盛装碱石灰可以起到F和G的作用。查看更多