- 2021-07-05 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国版2021高考化学一轮复习题型突破1“多角度”突破有关阿伏加德罗常数的判断课件
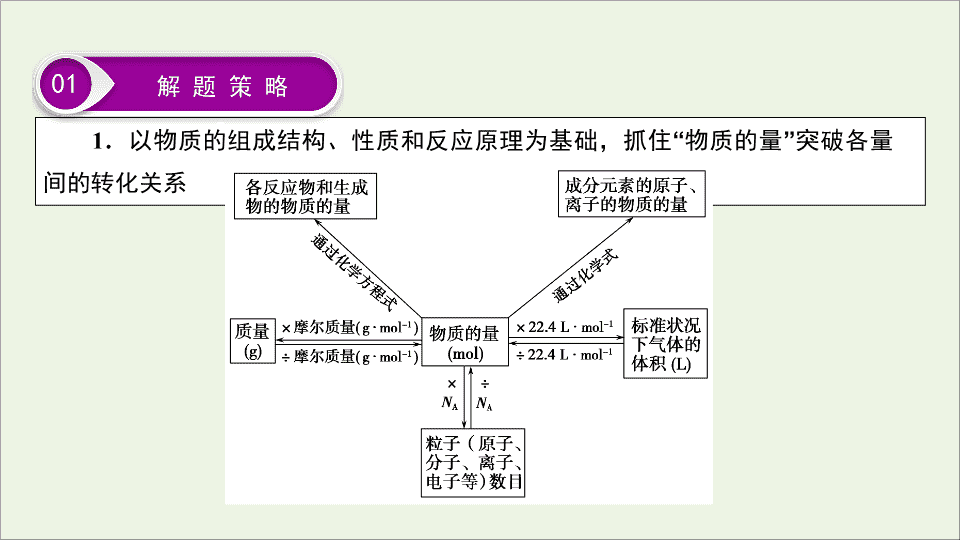
化学计量在实验中的应用 第一章 题型突破 1 “多角度”突破有关阿伏 加德罗常数的判断 在近几年的高考中,有关阿伏加德罗常数的判断正误题一直备受青睐,保持着较高的稳定性与连续性,该题型在命题角度上灵活多变,可以涉及到物质的组成与结构、元素化合物的性质、氧化还原反应中电子的转移、化学反应原理等多方面的知识要素,能够全面地考查学生的对化学知识的掌握情况和分析问题的能力;在命题形式上主要以阿伏加德罗常数为载体,考查与物质的量相关的量之间的相互转化关系;解题的关键是抓住 “ 物质的量 ” 这一核心为纽带,突破常见的命题陷阱。 1 . 以物质的组成结构、性质和反应原理为基础,抓住 “ 物质的量 ” 突破各量间的转化关系 01 解 题 策 略 2 . 认真审题,抓住关键字词,突破常见命题 “ 陷阱 ” (1) 关注 “ 两看 ” ,突破气体与状况陷阱 一看 “ 气体 ” 是否处在 “ 标准状况 ” 。 二看 “ 标准状况 ” 下,物质是否为 “ 气体 ” [ 如 CCl 4 、 CHCl 3 、 CH 2 Cl 2 ( 注: CH 3 Cl 为气体 ) 、 H 2 O 、溴、 SO 3 、己烷、苯等在标准状况下均不为气体 ] 。 (2) 抓住 “ 实质 ” ,突破质量 ( 或物质的量 ) 与状况无关陷阱 给出非标准状况下气体的物质的量或质量,干扰学生的正确判断,误以为无法求解物质所含的粒子数,实际上,此时物质所含的粒子数与温度、压强等外界条件无关。 (3) 记住 “ 组成 ” ,突破物质结构陷阱 ①记特殊物质中所含微粒 ( 分子、原子、电子、质子、中子等 ) 的数目,如 Ne 、 D 2 O 、 18 O 2 、 — OH 、 OH - 等。 ②记最简式相同的物质,如 NO 2 和 N 2 O 4 、乙烯 (C 2 H 4 ) 和丙烯 (C 3 H 6 ) 等。 ③记摩尔质量相同的物质,如 N 2 、 CO 、 C 2 H 4 等。 ④记物质中所含化学键的数目,如一分子 H 2 O 2 、 C n H 2 n + 2 中化学键的数目分别为 3 、 3 n + 1 。 (4) 审视 “ 组成与性质 ” 因素,突破电解质溶液中粒子数目陷阱 ①是否存在弱电解质的电离或盐类水解。 ②已知浓度,是否指明体积,用好公式 n = cV 。 ③在判断溶液中微粒总数时,是否忽视溶剂水。 (6) 分析 “ 化合价升降 ” ,突破氧化还原反应的电子转移陷阱 ② 熟记常考氧化还原反应转移的电子数 ( 其他反应物均过量 ) 反应 物质 转移电子的物质的量或电子数目 Na 2 O 2 + CO 2 ( 或 H 2 O) 1 mol Na 2 O 2 1 mol 或 N A 1 mol O 2 2 mol 或 2 N A Cl 2 + NaOH 1 mol Cl 2 1 mol 或 N A Cl 2 + Fe 1 mol Cl 2 2 mol 或 2 N A 1 mol Fe 3 mol 或 3 N A 02 真 题 示 例 1 . (2018 · 全国卷 Ⅰ , 10) N A 是阿伏加德罗常数的值。下列说法正确的是 ( ) A . 16.25 g FeCl 3 水解形成的 Fe(OH) 3 胶体粒子数为 0.1 N A B . 22.4 L( 标准状况 ) 氩气含有的质子数为 18 N A C . 92.0 g 甘油 ( 丙三醇 ) 中含有羟基数为 1.0 N A D . 1.0 mol CH 4 与 Cl 2 在光照下反应生成的 CH 3 Cl 分子数为 1.0 N A B 解析 B 对:氩气是单原子分子,标准状况下, 22.4 L 氩气的物质的量为 1 mol ,含有的质子数为 18 N A 。 A 错: Fe(OH) 3 胶体粒子是若干个 Fe(OH) 3 分子的集合体。 C 错: 92.0 g 甘油的物质的量为 1 mol ,每个甘油分子含有 3 个羟基,所以 1 mol 甘油含有的羟基数为 3.0 N A 。 D 错: CH 4 与 Cl 2 发生取代反应生成的有机物除了 CH 3 Cl 以外,还有 CH 2 Cl 2 、 CHCl 3 和 CCl 4 ,生成的 CH 3 Cl 分子数小于 1.0 N A 。 2 . (2018 · 全国卷 Ⅱ , 11) N A 代表阿伏加德罗常数的值。下列说法正确的是 ( ) A .常温常压下, 124 g P 4 中所含 P — P 键数目为 4 N A B . 100 mL 1 mol · L - 1 FeCl 3 溶液中所含 Fe 3 + 的数目为 0.1 N A C .标准状况下, 11.2 L 甲烷和乙烯混合物中含氢原子数目为 2 N A D .密闭容器中, 2 mol SO 2 和 1 mol O 2 催化反应后分子总数为 2 N A C 解析 C 对:标准状况下, 11.2 L 甲烷和乙烯混合物的物质的量为 0.5 mol ,每个甲烷和乙烯分子都含有 4 个氢原子,所以含有氢原子数目为 2 N A 。 A 错: 124 g P 4 的物质的量为 1 mol ,每个 P 4 分子中含有 6 个 P — P 键,所以含有 P — P 键数目为 6 N A 。 B 错: Fe 3 + 在水溶液中能发生水解, 100 mL 1 mol · L - 1 FeCl 3 溶液中所含 Fe 3 + 的数目小于 0.1 N A 。 D 错: SO 2 和 O 2 的化合反应为可逆反应, 2 mol SO 2 和 1 mol O 2 催化反应后,混合气体的物质的量大于 2 mol ,即分子总数大于 2 N A 。 03 即 时 训 练 1 . [ 气体摩尔体积的适用条件及物质的聚集状态 ] 判断正误,正确的划 “ √ ” ,错误的划 “ × ” 。 (1)2.24 L CO 2 中含有的原子数为 0.3 N A ( ) (2) 常温下, 11.2 L 甲烷气体含有的甲烷分子数为 0.5 N A ( ) (3) 标准状况下, 2.24 L HF 含有的 HF 分子数为 0.1 N A ( ) (4) 标准状况下, 22.4 L SO 3 含有的 SO 3 分子数为 N A ( ) (5) 常温常压下, 22.4 L 氯气与足量镁粉充分反应,转移的电子数为 2 N A ( ) × × × × × 2 . [ 物质的量或质量与状况 ] 判断正误,正确的划 “ √ ” ,错误的划 “ × ” 。 (1) 常温常压下, 3.2 g O 2 所含的原子数为 0.2 N A ( ) (2) 标准状况下, 18 g H 2 O 所含的氧原子数目为 N A ( ) (3) 室温下, 1 mol CH 4 中含有 5 N A 原子 ( ) (4) 常温常压下, 1 mol CO 2 与 SO 2 的混合气体中含氧原子数为 2 N A ( ) 3 . [ 物质的组成与结构 ] 判断正误,正确的划 “ √ ” ,错误的划 “ × ” 。 (1) 相同质量的 CO 与 N 2 所含分子数、原子数均相同 ( ) (2)17 g — OH 与 17 g OH - 所含电子数均为 10 N A ( ) (3)31 g 白磷中所含共价键数目为 N A ( ) (4)30 g SiO 2 中含有硅氧键个数为 N A ( ) (5)32 g 甲醇中所含共价键数目为 5 N A ( ) √ √ √ √ √ × × × √ 4 . [ 电解质溶液中粒子数目的判断 ] 判断正误,正确的划 “ √ ” ,错误的划 “ × ” 。 (1)0.1 L 3.0 mol · L - 1 的 NH 4 NO 3 溶液中含有的 NH 的数目为 0.3 N A ( ) (2) 等体积、等物质的量浓度的 NaCl 和 KCl 溶液中,阴、阳离子数目之和均为 2 N A ( ) (3)0.1 mol · L - 1 的 NaHSO 4 溶液中,阳离子的数目之和为 0.2 N A ( ) (4)25 ℃ 时, pH = 13 的 1.0 L Ba(OH) 2 溶液中含有的 OH - 数目为 0.2 N A ( ) (5)1 L 0.1 mol · L - 1 的 Na 2 CO 3 溶液中所含氧原子数目为 0.3 N A ( ) × × × × × 5 . [ 阿伏加德罗常数的应用与 “ 隐含反应 ” ] 判断正误,正确的划 “ √ ” ,错误的划 “ × ” 。 (1)2 mol SO 2 和 1 mol O 2 在一定条件下充分反应后,混合物的分子数为 2 N A ( ) (2) 密闭容器中 2 a mol NO 与 a mol O 2 充分反应,产物的分子数为 2 aN A ( ) (3) 标准状况下, 0.1 mol Cl 2 溶于水,转移的电子数目为 0.1 N A ( ) (4)1 L 0.1 mol · L - 1 的氨水中有 N A 个 NH 。 ( ) (5) 向含 4 mol HCl 的浓盐酸中,加入足量的 MnO 2 ,加热,充分反应后,生成 N A 个 Cl 2 ( ) (6) 用含有 1 mol FeCl 3 的溶液充分反应后得的 Fe(OH) 3 胶体中含有 N A 个 Fe(OH) 3 胶粒 ( ) × × × × × × 6 . [ 以氧化还原反应中的电子转移数目为设陷方向 ] 判断正误,正确的划 “ √ ” ,错误的划 “ × ” 。 (1)5.6 g 铁粉与硝酸反应失去的电子数一定为 0.3 N A ( ) (2)0.1 mol Zn 与含 0.1 mol HCl 的盐酸充分反应,转移的电子数目为 0.2 N A ( ) (3)1 mol Na 2 O 2 与足量 CO 2 充分反应转移的电子数为 2 N A ( ) (4) 向 FeI 2 溶液中通入适量 Cl 2 ,当有 1 mol Fe 2 + 被氧化时,共转移的电子数目为 N A ( ) × × × × 正确判断有关阿伏加德罗常数正误的 “ 三大步骤 ” 第一步 :查看物质的状态及所处状况 —— 正确运用气体摩尔体积的前提 第二步 :分析题干所给物理量与物质的量的关系 —— 正确进行换算的前提 第三步 :准确把握物质的微观结构和物质变化过程中微粒数目的变化 —— 正确判断微粒数目的前提查看更多