- 2021-07-05 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习晶体结构与性质作业(2)
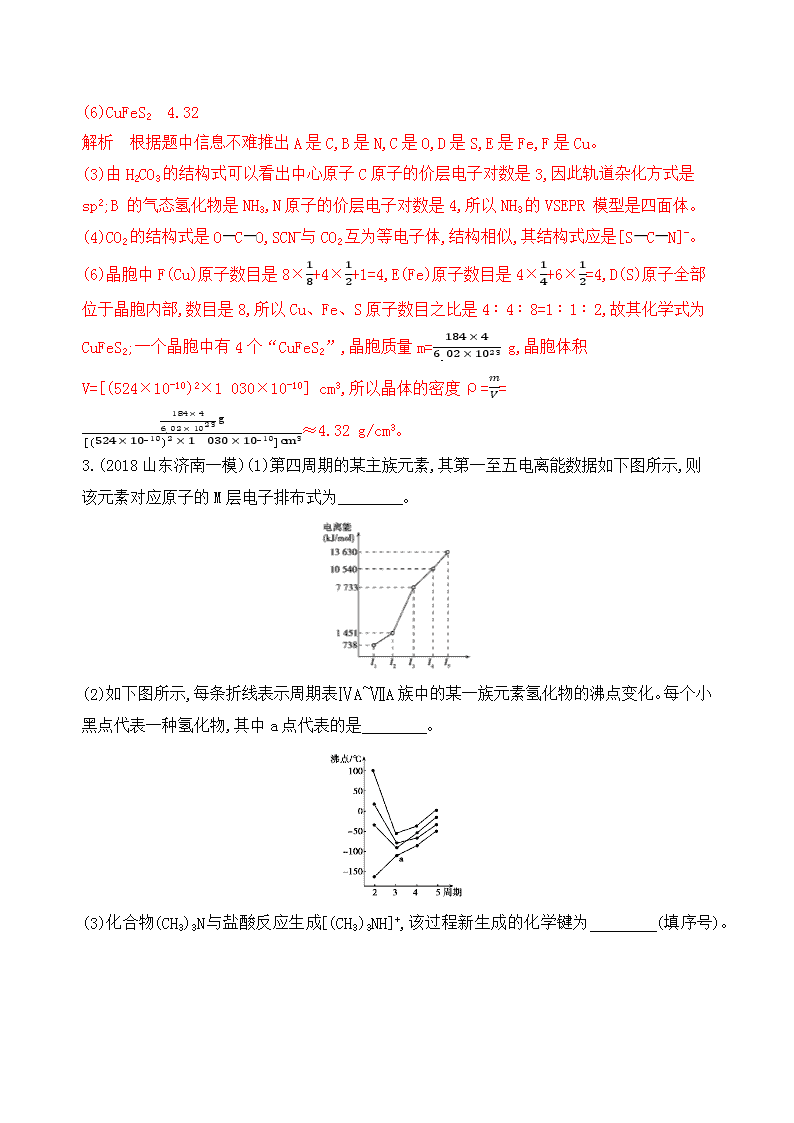
第3讲 晶体结构与性质 A组 基础题组 1.M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。 请回答下列问题: (1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。 (2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。 (3)X与M形成的XM3分子的空间构型是 。 (4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是 (填离子符号)。 (5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。 答案 (1)1s22s22p63s1或[Ne]3s1 Cl (2)H2O分子间存在氢键,H2S分子间无氢键 (3)平面三角形 (4)Na+ (5)K2Cr2O7+3H2O2+4H2SO4 K2SO4+Cr2(SO4)3+3O2↑+7H2O 解析 由题意可知M为O,R为Na,X为S,Y为Cl,Z为Cr。(3)XM3为SO3,其分子中中心原子的价层电子对数为3,无孤电子对,故分子的空间构型为平面三角形。(4)由题图可知 个数为8×18+6×12=4, 个数为8,R2M为Na2O,Na+与O2-的个数比为2∶1,故黑球代表Na+。(5)Cr的最高价含氧酸的钾盐(橙色)为K2Cr2O7,氧元素的氢化物中能被K2Cr2O7氧化的为H2O2。 2.已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大。A 原子、C 原子的 L 能层中都有两个未成对的电子,C、D 同主族。E、F 都是第四周期元素,E 原子核外有 4 个未成对电子,F 原子除最外能层只有 1 个电子外,其余各能层均为全充满。根据以上信息填空: (1)基态 D 原子中,电子占据的最高能层符号为 , 该能层具有的原子轨道数为 。 (2)E2+的价层电子排布图是 ,F 原子的电子排布式是 。 (3)A 的最高价氧化物对应的水化物分子结构式为 ,其中心原子采取的轨道杂化方式为 ,B 的气态氢化物的 VSEPR 模型为 。 (4)化合物AC2、B2C 和阴离子DAB-互为等电子体,它们结构相似,DAB-的结构式为 。 (5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为 6。甲的水溶液可以用于实验室中E2+的定性检验,检验E2+的离子方程式为 。 (6)某种化合物由 D、E、F 三种元素组成,其晶胞如图所示,则其化学式为 。该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据计算该晶体的密度:ρ≈ g/cm3(计算结果保留2位小数)。 答案 (1)M 9 (2) ↑↓ ↑ ↑ ↑ ↑ 3d 1s22s22p63s23p63d104s1或[Ar]3d104s1 (3) sp2 四面体 (4)[SCN]- (5)3Fe2++2[Fe(CN)6]3- Fe3[Fe(CN)6]2↓ (6)CuFeS2 4.32 解析 根据题中信息不难推出A是C,B是N,C是O,D是S,E是Fe,F是Cu。 (3)由H2CO3的结构式可以看出中心原子C原子的价层电子对数是3,因此轨道杂化方式是sp2;B 的气态氢化物是NH3,N原子的价层电子对数是4,所以NH3的VSEPR 模型是四面体。 (4)CO2的结构式是OCO,SCN-与CO2互为等电子体,结构相似,其结构式应是[SCN]-。 (6)晶胞中F(Cu)原子数目是8×18+4×12+1=4,E(Fe)原子数目是4×14+6×12=4,D(S)原子全部位于晶胞内部,数目是8,所以Cu、Fe、S原子数目之比是4∶4∶8=1∶1∶2,故其化学式为CuFeS2;一个晶胞中有4个“CuFeS2”,晶胞质量m=184×46.02×1023 g,晶胞体积V=[(524×10-10)2×1 030×10-10] cm3,所以晶体的密度ρ=mV=184×46.02×1023g[(524×10-10)2×1 030×10-10]cm3≈4.32 g/cm3。 3.(2018山东济南一模)(1)第四周期的某主族元素,其第一至五电离能数据如下图所示,则该元素对应原子的M层电子排布式为 。 (2)如下图所示,每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 。 (3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为 (填序号)。 A.离子键 B.配位键 C.氢键 D.非极性共价键 若化合物(CH3)3N能溶于水,试解析其原因: 。 (4)CO2在高温高压下所形成的晶体其晶胞如下图所示。该晶体的熔点比SiO2晶体 (选填“高”或“低”),该晶体中碳原子轨道的杂化类型为 。 (5)Cu2+等的水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为 (填“有”或“无”)色离子,依据是 。 离子 Sc3+ Ti3+ Fe2+ Cu2+ Zn2+ 颜色 无色 紫红色 浅绿色 蓝色 无色 (6)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,FexO中x的值为 (精确至0.01)。 答案 (1)3s23p6 (2)SiH4 (3)B 化合物(CH3)3N为极性分子且可与水分子间形成氢键 (4)高 sp3杂化 (5)有 Ni2+的3d轨道上有未成对电子 (6)0.92 解析 (1)由该元素的第一至五电离能数据可以知道,该元素第一、二电离能较小,说明容易失去2个电子,即最外层有两个电子,已知该元素为第四周期的某主族元素,则为第四周期第ⅡA族元素Ca,其原子M层有8个电子,则M层电子排布式为3s23p6。 (2)在ⅣA~ⅦA族元素中的氢化物里,NH3、H2O、HF因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,组成与结构相似,相对分子质量越大,分子间作用力越大,沸点越高,故a点代表的应是第ⅣA族Si的氢化物,即SiH4。 (3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为氮与氢离子形成配位键,所以选B。 (4)CO2在高温高压下所形成的晶体中原子之间通过共价键结合,属于原子晶体,而碳氧键的键长短,所以该晶体的熔点比SiO2晶体高;该晶体中C原子形成4个C—O单键,则C原子含有4个价层电子对,所以C原子轨道的杂化类型为sp3。 (6)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV可知4×56x+16NA g=5.71 g·cm-3×(4.28×10-8 cm)3,解得:x≈0.92。 4.(2017江苏单科,21A,12分)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。 (1)Fe3+基态核外电子排布式为 。 (2)丙酮()分子中碳原子轨道的杂化类型是 ,1 mol丙酮分子中含有σ键的数目为 。 (3)C、H、O三种元素的电负性由小到大的顺序为 。 (4)乙醇的沸点高于丙酮,这是因为 。 (5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为 。 图1 FexNy晶胞结构示意图 图2 转化过程的能量变化 答案 (1)[Ar]3d5或1s22s22p63s23p63d5 (2)sp2和sp3 9NA (3)H查看更多
相关文章
- 当前文档收益归属上传用户