- 2021-07-05 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省南平市高级中学2019-2020学年高一下学期期中考试化学试题 Word版含答案
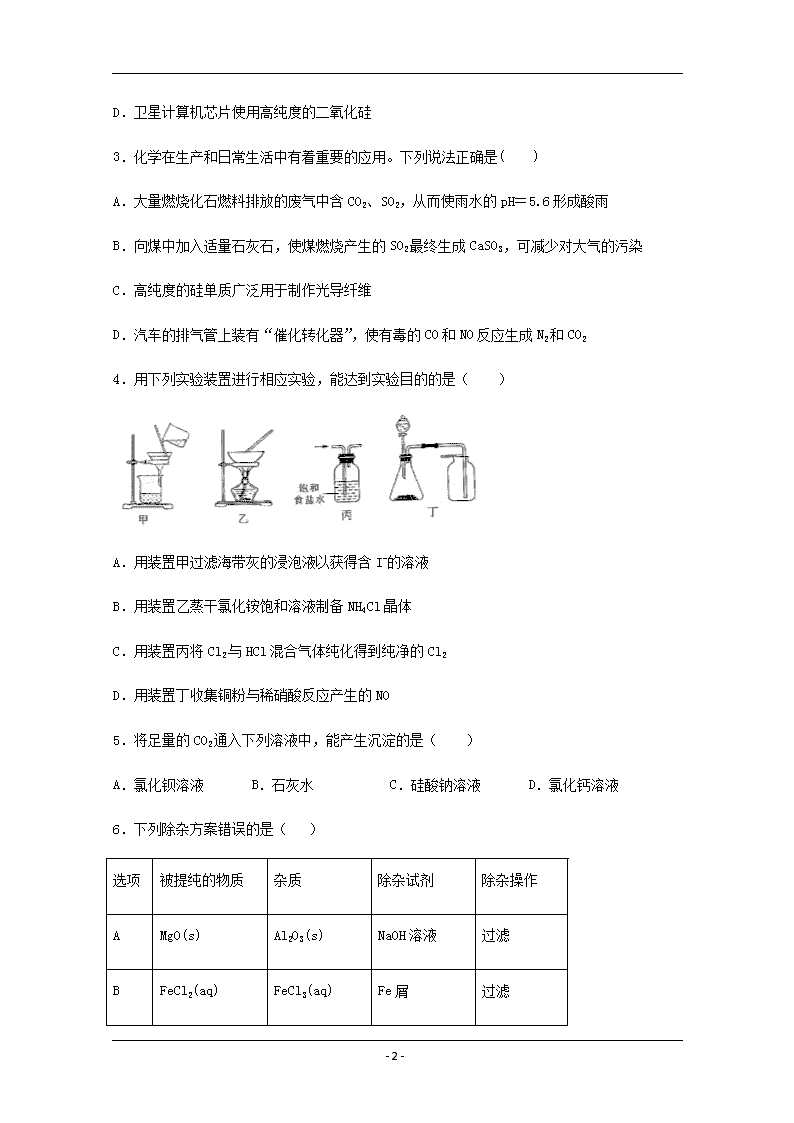
www.ks5u.com 南平市高级中学2019-2020学年度第二学期 高一年级化学期中考试试题卷 本试卷共100分 考试时间90分钟 命题人: 林惠云 审卷人: 命题时间: 2020 年5月 相对原子质量H—1 O—16 Na—23 Mg-24 Al—27 S—32 Si—28 Cl—35.5 第I卷(选择题) 一、选择题(本题包括22小题,每小题2分,共44分,每小题只有一个选项符合题意。) 1.古丝绸之路贸易中的下列商品,主要成分属于无机物的是( ) A.瓷器 B.丝绸 C.茶叶 D.中草药 2.2019 年 12 月 27 日晚,长征五号运载火箭“胖五”在海南文昌航天发射场成功将实践二十号卫星送入预定轨道。下列有关说法正确的是( ) A.“胖五”利用液氧和煤油为燃料,煤油为纯净物 B.火箭燃料燃烧时将化学能转化为热能 C.火箭箭体采用铝合金是为了美观耐用 - 12 - D.卫星计算机芯片使用高纯度的二氧化硅 3.化学在生产和日常生活中有着重要的应用。下列说法正确是( ) A.大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 B.向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 C.高纯度的硅单质广泛用于制作光导纤维 D.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 4.用下列实验装置进行相应实验,能达到实验目的的是( ) A.用装置甲过滤海带灰的浸泡液以获得含I-的溶液 B.用装置乙蒸干氯化铵饱和溶液制备NH4Cl晶体 C.用装置丙将Cl2与HCl混合气体纯化得到纯净的Cl2 D.用装置丁收集铜粉与稀硝酸反应产生的NO 5.将足量的CO2通入下列溶液中,能产生沉淀的是( ) A.氯化钡溶液 B.石灰水 C.硅酸钠溶液 D.氯化钙溶液 6.下列除杂方案错误的是( ) 选项 被提纯的物质 杂质 除杂试剂 除杂操作 A MgO(s) Al2O3(s) NaOH溶液 过滤 B FeCl2(aq) FeCl3(aq) Fe屑 过滤 - 12 - C NaHCO3 (aq) Na2CO3(aq) Ca(OH)2溶液 过滤 D CuO(s) Cu(s) O2 加热 7.下列有机化学方程式及反应类型均正确的是( ) A.CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O 脂化反应 B.CH2=CH2+HOCl → HOCH2—CH2Cl 加聚反应 C.2CH3CH2OH+O22CH3CHO+H2O 氧化反应 D.CH3Cl+Cl2CH2Cl2+HCl 取代反应 8.我国成功地发射了嫦娥一号探测卫星,对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月球表层 5 cm 厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石(CaMgSi2O6)、斜长石(NaAlSi3O8)和橄榄石[(Mg或Fe)2SiO4]等。下列说法或分析不正确的是( ) A.辉石、斜长石及橄榄石均属于硅酸盐矿 B.斜长石的氧化物形式可表示为Na2O·Al2O3·3SiO2 C.月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 D.橄榄石中铁元素为+2价 9.下列关于铝及其化合物说法,不正确的是( ) A.明矾可用作净水剂和消毒剂 B.利用铝热反应可冶炼高熔点金属 C.铝可用作包装材料和建筑材料 D.氢氧化铝可用作治疗胃酸过多的药物 10.下列说法不正确的是( ) A.太阳能电池可用硅材料制作,其应用有利于环保、节能 - 12 - B.SiO2可用于制造光导纤维 C.Na2SiO3水溶液俗称水玻璃,可用作木材防火剂及黏胶剂 D.建设三峡大坝使用了大量水泥,水泥是有机材料 11.熔融氢氧化钠应选用的器皿是( ) A.陶瓷坩埚 B.石英坩埚 C.普通玻璃坩埚 D.生铁坩埚 12.下列各组有机物中,仅使用溴水不能鉴别出的是( ) A.乙烯、乙炔 B.苯、四氯化碳 C.乙烷、乙烯 D.苯、酒精 13.既能与酸(H+)反应,又能与碱(OH-)反应的化合物是 ( ) ①MgO ②Al(OH)3 ③NaHSO4 ④NaHCO3 ⑤CH3COONH4 ⑥Al A.②④ B.②③④ C.②④⑤ D.②④⑤⑥ 14.下列指定反应的离子方程式正确的是( ) A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH−ClO−+Cl−+H2O B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH−[Al(OH)4]-+H2↑ C.室温下用稀HNO3溶解铜:Cu+2+2H+Cu2++2NO2↑+H2O D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+H2SiO3↓+2Na+ 15.工业上制备PVC(聚氯乙烯)的一种合成路线如下,下列说法错误的是( ) A.X的球棍模型为: B.Y有2种不同结构 - 12 - C.反应②为加成聚合反应 D.PVC的结构简式为: 16.下列说法中,正确的是( ) A.符合通式CnH2n的烃一定是烯烃 B. 是同分异构体 C.乙烯使酸性KMnO4溶液褪色是加成反应 D.由丙烯生成聚丙烯是聚合反应 17.在一定条件下,下列物质不能与二氧化硅反应的是( ) ①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙 ⑧氮气 A.③⑤⑦⑧ B.⑤⑦⑧ C.⑤⑧ D.⑤⑦ 18.C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及化合物的说法中正确的是( ) A.三种元素在自然界中既有游离态又有化合态 B.二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应 C.最低价的气态氢化物都具有还原性,易与O2发生反应 D.其最高价氧化物对应水化物的酸性强弱:H2SO4>H2SiO3>H2CO3 19.“青取之于蓝而胜于蓝”中的蓝是指靛蓝,它是历史上最早使用的还原性染料,结构简式如图,下列关于它的性质的叙述中错误的是( ) A.它的苯环上的一氯取代物有4种 B.它的化学式是C16H11N2O2 C.它可以与溴水因发生加成反应而使溴水褪色 D.它不属于烃类 - 12 - 20.甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后生成的气体的体积比为甲∶乙=1∶2,则加入铝粉的质量为( ) A.5.4 g B.3.6 g C.2.7 g D.1.8 g 21.Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( ) 选项 A B C D a Na Al Fe Cu b NaOH Al2O3 FeCl3 CuSO4 c NaCl Al(OH)3 FeCl2 CuCl2 22.下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( ) A.甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡 B.乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 C.丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量 D.丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量 - 12 - 第II卷(非选择题) 二、填空题(共56分) 23.(8分)将下列物质进行分类(填序号) ①O2与O3 ②126C与136C ③H2O和D2O ④冰与干冰 ⑤H2、D2、T2 ⑥乙醇与乙醚(CH3-O-CH3) ⑦CH3CH2CH2CH2CH3和CH3CH2CH2CH2 CH3 (1)互为同位素的是__________ ___ (2)互为同素异形体的是___________ (3)互为同分异构体的是______ ___ (4)属于同一化合物的是___________ 24.(10分)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3 ,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下: (1)I和II步骤中分离溶液和沉淀的操作是: ; (2)沉淀M中除含有泥沙外,一定还含有 ,固体N是 - 12 - ; (3)滤液X中,含铝元素的溶质的化学式为 ,它属于 (填“酸”、“碱”或“盐”)类物质; (4)实验室里常往AlCl3溶液中加人 (填“氨水”或“NaOH溶液”)来制取Al(OH)3,请写出该反应的方程式 25.(12分)将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。 (1)写出bc段发生的化学反应方程式___________________; (2)镁和铝的总质量为________g; (3)b点溶液中的溶质为__________,硫酸的物质的量浓度为___________mol/L; (4)生成的氢气在标准状况下的体积为__________L; (5)c点溶液中通入足量的CO2的反应化学方程式为___________。 26.(12分)(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的________(填字母)。 a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH (2)已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化: - 12 - ①写出下列物质的化学式:X:___,A:____,B:___,C:_____。 ②写出以下反应的离子方程式:A→B ;X→C: 。 27.(14分)晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。 (1)工业上生产纯硅的工艺流程如下: 石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。 (2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。 ①装置B中的试剂是___________,装置C中的烧瓶需要加热,其目的是_________________。 ②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。 ③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。 - 12 - a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液 - 12 - 南平市高级中学2019-2020学年度第二学期 高一年级化学期中考试答案及评分标准 一.选择题(每小题2分共44分) 题号 1 2 3 4 5 6 7 8 9 10 答案 A B D A C C D B A D 题号 11 12 13 14 15 16 17 18 19 20 21 22 答案 D A C A B D C C B A B C 2 6 +8 二.填空题(共6小题,共56分) 23、(每空2分)② ① ⑥ ⑦ 24、(1)过滤(1分) (2)Fe2O3 (2分) Al2O3 (2分) (3) Na[Al(OH)4] (1分) 盐(1分) (4)氨水(1分) AlCl3 +3NH3•H2O = Al(OH)3 ↓+3NH4Cl (2分) 25、 (每空2分) (1) Al(OH)3+NaOH=NaAlO2+2H2O (2) 9 (3) Na2SO4 2.5 (4) 10.08 (5) NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 26、(1) 2Al+2OH-+2H2O=2AlO2-+3H2↑(2分) c (2分) (2) ①X:Al A : Al2O3 B: NaAlO2 C: AlCl3 (各1分) ②Al2O3+2OH-=2AlO2-+H2O (2分) 2 Al+6H+= 2Al3++3H2↑(2分) 27、 (1)还原剂 (2分) 1.204×1023或0.2NA (2分) - 12 - (2) ①浓硫酸(2分) 使滴入烧瓶中的SiHCl3汽化(2分) ② 有固体物质生成(2分) SiHCl3+H2Si+3HCl(2分) ③ bd (2分) - 12 -查看更多