2019届一轮复习鲁科版化学平衡的移动学案
第2节 化学平衡的移动
1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。
2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
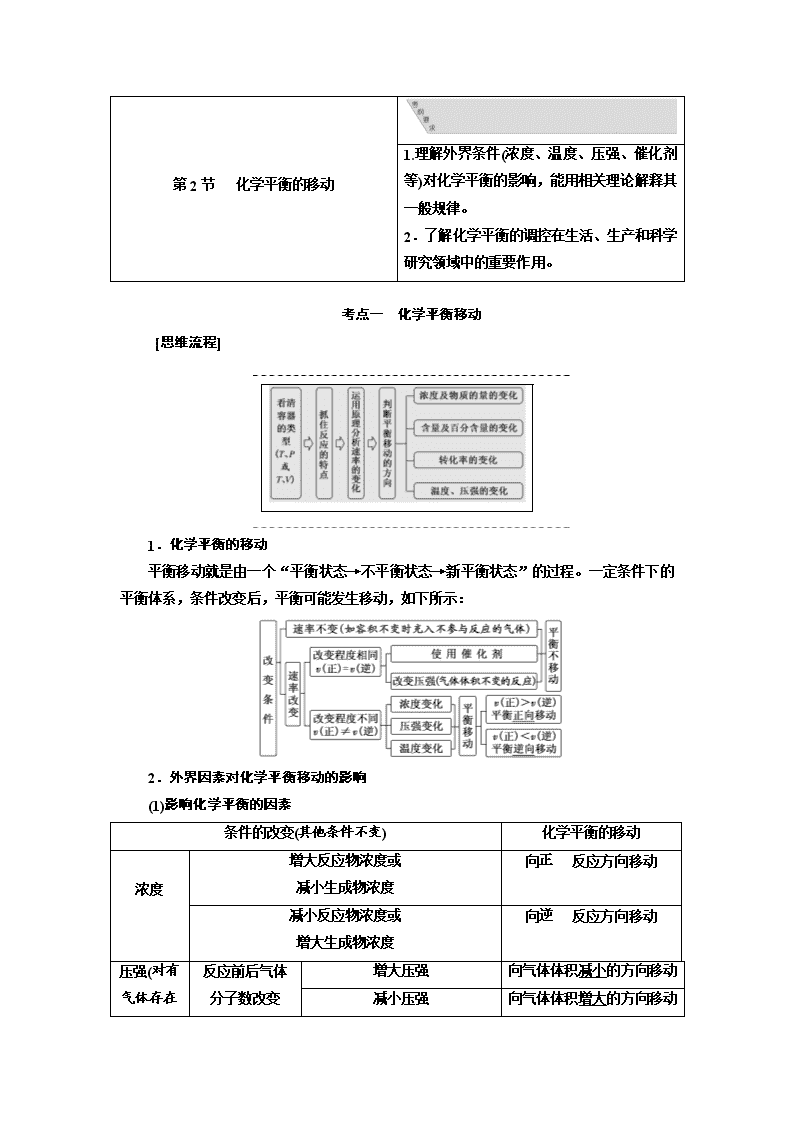
考点一 化学平衡移动
[思维流程]
1.化学平衡的移动
平衡移动就是由一个“平衡状态→不平衡状态→新平衡状态”的过程。一定条件下的平衡体系,条件改变后,平衡可能发生移动,如下所示:
2.外界因素对化学平衡移动的影响
(1)影响化学平衡的因素
条件的改变(其他条件不变)
化学平衡的移动
浓度
增大反应物浓度或
减小生成物浓度
向反应方向移动
减小反应物浓度或
增大生成物浓度
向反应方向移动
压强
反应前后气体分子数改变
增大压强
向气体体积减小的方向移动
(对有气体存在的反应)
减小压强
向气体体积增大的方向移动
反应前后气体分子数不变
改变压强
平衡移动
温度
升高温度
向吸热反应方向移动
降低温度
向放热反应方向移动
催化剂
使用催化剂
平衡移动
(2)通过图像分析影响化学平衡移动的因素
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
①加催化剂对反应速率影响的图像是__C__(填字母,下同),平衡__不__移动。
②升高温度对反应速率影响的图像是__A__,平衡向逆反应方向移动。
③增大反应容器体积对反应速率影响的图像是__D__,平衡向逆反应方向移动。
④增大O2的浓度对反应速率影响的图像是__B__,平衡向正反应方向移动。
(3)几种特殊情况说明
①改变固体或纯液体的量,对化学平衡无影响。
②“惰性气体”对化学平衡的影响。
恒温
恒容
条件
原平衡体系体系总压强增大―→体系中各组分的浓度不变―→平衡不移动
恒温
恒压
条件
③同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
3.勒夏特列原理
如果改变影响化学平衡的条件之一(如温度、压强、以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。
[注意] 外界条件改变时,化学平衡发生移动,最终结果只能“减弱”条件的改变,但不能“消除”条件的改变。
[典例] (2016·全国卷Ⅱ)丙烯腈(CH2===CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2===CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g)ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g)ΔH=-353 kJ·mol-1
有利于提高丙烯腈平衡产率的反应条件是_________________________________
________________________________________________________________________;
提高丙烯腈反应选择性的关键因素是______________________________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________________________________________________________________
________________________________________________________________________;
高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为________,理由是______________________________________________________。
进料气氨、空气、丙烯的理论体积比约为______________________________________。
[学审题析题]
第(1)问分析可获得以下解题信息
由题给生成丙烯腈的热化学方程式①可知其反应的特点:正反应为放热反应,正反应方向是气体物质的量增加的反应;故降低温度或降低压强,平衡均向正反应方向移动,有利于提高丙烯腈的平衡产率。
在化工生产中由于此反应会伴随副反应发生,为提高丙烯腈反应的选择性,使用合适催化剂十分重要。
第(2)问分析可获得以下解题信息
由图(a)可知,低于460 ℃时丙烯腈的产率随温度的升高而增大,高于460 ℃时丙烯腈的产率随温度的升高而降低,当460 ℃时丙烯腈的产率最高,而根据反应①可知反应放热,其丙烯腈的产率理应随着温度的升高而降低。图(a)展示的产率变化与反应①应该呈现的产率变化相矛盾的原因是低于460 ℃时,图(a)中呈现的产率变化是未平衡时的产率变化,当460 ℃时达到平衡,高于460 ℃时呈现的产率变化才是平衡产率。
第(3)问分析可获得以下解题信息
由图(b)可知,当n(氨)/n(丙烯)=1时,丙烯腈的产率最高,而丙烯醛的产率已趋近于0,如果n(氨)/n(丙烯)再增大,丙烯腈的产率反而降低,故最佳n(氨)/n(丙烯)约为1。空气中O2的体积分数约为,结合反应①方程式及最佳n(氨)/n(丙烯)约为1可知,进料气氨、空气、丙烯的理论体积比应为1∶∶1=1∶7.5∶1。
[答案] (1)降低温度、降低压强 催化剂 (2)不是 该反应为放热反应,平衡产率应随温度升高而降低 AC
(3)1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1
[规律方法]
化工生产适宜条件选择的一般原则
条件
原则
从化学反应速率分析
既不能过快,又不能太慢
从化学平衡移动分析
既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析
增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析
如设备承受高温、高压能力等
从催化剂的使用活性分析
注意催化剂的活性对温度的限制
[对点训练]
1.下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
解析:选C 气体中存在平衡2NO2(g)N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正向移动,二氧化氮的浓度又降低,颜色又变浅,由于移动的目的是减弱变化,而不是消除,故颜色仍比原来的颜色深,所以可用平衡移动原理解释,A不选;存在平衡2SO2+O2(g)2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,有利于合成SO3,能用平衡移动原理解释,B不选;催化剂只能改变反应速率,不影响平衡移动,C选;反应为可逆反应,使K变成蒸气从反应混合物中分离出来,生成物浓度减小,平衡正向移动,能用平衡移动原理解释,D不选。
2.将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生反应并达到平衡:X(g)+3Y(g)2Z(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,表中关于新平衡与原平衡的比较正确的是( )
选项
改变条件
新平衡与原平衡比较
A
升高温度
X的转化率变小
B
增大压强
X的浓度变小
C
充入一定量Y
Y的转化率增大
D
使用适当催化剂
X的体积分数变小
解析:选A 升高温度,平衡逆向移动,X的转化率变小,A正确;增大压强,平衡正向移动,但容器的体积减小,X的浓度增大,B错误;充入一定量Y,X的转化率增大,而Y的转化率减小,C错误;使用适当催化剂,只能加快反应速率,不能改变平衡,X的体积分数不变,D错误。
3.(2018·黄冈模拟)在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其他条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示。则下列结论正确的是( )
A.该反应的热化学方程式M(g)+3N(g)2R(g) ΔH>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其他条件不变,升高温度,正、逆反应速率均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
解析:选C 从图a可得出该反应为M(g)+3N(g)2R(g),从图b中可看出T1>T2,升高温度,N的体积分数变大,即平衡逆向移动,该反应为放热反应,A错误;缩小容器的体积,即增大压强,平衡正向移动,B错误;升高温度,v正、v逆均增大,平衡逆向移动,M的转化率减小,C正确;若是在恒温恒容的容器中通入稀有气体,则平衡不移动,D错误。
4.化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 Ⅰ
如图所示,反应Ⅰ在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是_______________________
________________________________________________________________________。
解析:(1)由题意可知,未提纯的TaS2粉末变成纯净TaS2晶体,要经过两步转化:①TaS2+2I2TaI4+S2,②TaI4+S2TaS2+2I2,即反应Ⅰ先在温度T2端正向进行,后在温度T1端逆向进行,反应Ⅰ的ΔH大于0,因此温度T1小于T2,该过程中循环使用的物质是I2。(2)从图像来看,随着温度的升高,CO的转化率变小,故ΔH<0,综合温度、压强对CO转化率的影响来看,在题给压强下,CO的转化率已经很大,不必再增大压强。
答案:(1)< I2
(2)< 在1.3×104 kPa下,CO的转化率已较高,再增大压强CO转化率提高不大,同时生产成本增加,得不偿失
考点二 化学平衡图像
[思维流程]
1.化学平衡图像的类型
(1)含量—时间—温度(压强)图像
常见图像形式有如下几种。其中C%指生成物的百分含量,B%指反应物的百分含量。
①
②
③
④
⑤
[判读技法]
表示不同条件下,反应达到平衡的时间快慢、反应速率的快慢以及平衡混合物中某物质的百分含量的关系。解题方法是“先拐先平,数值大”。即曲线先出现拐点的首先达到平衡,反应速率快,以此判断温度或压强的高低。再依据外界条件对平衡的影响分析判断反应的热效应及反应前后气体体积的变化。
(2)转化率(或质量分数)与压强—温度图像
①恒压线图像
表示两个外界条件同时变化时,反应物A的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。
如:图1中,当压强相等(任意一条等压线)时,升高温度,A的转化率增大,说明平衡正移,即正反应ΔH>0。当温度相等时,在图1中作直线,与三条等压线交于三点,这三点自下而上为增大压强,A的转化率增大,说明平衡正移,即正反应为气体体积减小的反应。 [判读技法]
②恒温线图像
图1中,当温度相等(任意一条等温线)时,增大压强,A的转化率增大,说明平衡正移,即正反应是气体体积减小的反应。当压强相等时,在图1中作直线,与两条等温线交于两点,这两点自下而上为降低温度,A的转化率增大,说明平衡正移,即正反应ΔH<0。 [判读技法]
(3)化学平衡中的特殊图像
①对于化学反应:mA(g)+nB(g)pC(g)+qD(g),M点前,表示从反应开始,v(正) >v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应的ΔH<0。
②对于化学反应:mA(g)+nB(g)pC(g)+qD(g),L线上所有的点都是平衡点。L线的上方(E点),A的百分含量大于此压强时平衡体系中A的百分含量,所以E点满足v(正)>v(逆);同理L线的下方(F点)满足v(正)
p1可推得反应图像中p2先出现拐点,故A、C两项错误;此反应为反应前后气体体积增大的反应,增大压强,平衡逆向移动,Z的体积分数减小,D错误,B正确。
2.向某容积为2 L的恒容密闭容器中充入2 mol X(g)和1 mol Y(g),发生反应2X(g)+Y(g)3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
A.M点时,Y的转化率最大
B.升高温度,平衡常数减小
C.平衡后充入X,达到新平衡时X的体积分数减小
D.W、M两点Y的正反应速率相同
解析:选B Q点时体系中X的体积分数最小、转化率最大,故Q点时Y的转化率最大,A项错误;升高温度,平衡向逆反应方向移动,平衡常数减小,B项正确;反应物有X、Y两种,平衡后充入X,达到新平衡时X的体积分数增大,C项错误;W点对应的温度低于M点对应的温度,温度越高,反应速率越快,所以W点Y的正反应速率小于M点Y的正反应速率,D项错误。
3.(2018·宁德一检)在密闭容器中,反应2NO2(g)N2O4(g)在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)随时间的变化情况;图b表示恒压条件下,平衡体系中N2O4
的质量分数随温度的变化情况(实线上的任意一点为对应温度下的平衡状态)。下列说法正确的是( )
A.其他条件不变时,向平衡体系中充入N2O4,平衡常数增大
B.图a中,A1→A2变化的原因一定是充入了NO2
C.图b中,E点对应状态中,v(正)>v(逆)
D.图b中,E→A所需时间为x,D→C所需时间为y,则xv(逆),C项正确;温度越高,反应速率越大,达到平衡用时较少,D项错误。
4.(2018·江南十校联考)对于密闭容器中可逆反应A2(g)+3B2(g)2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度)。下列判断正确的是( )
A.加入催化剂可以使状态d变为状态b
B.若T1>T2,则逆反应一定是放热反应
C.达到平衡时A2的转化率大小:b>a>c
D.在T2和n(A2)初始不变时达到平衡,AB3的物质的量大小:c>b>a
解析:选D 催化剂不能使平衡发生移动,A项错误;若T1>T2,由图像可知,温度升高AB3的平衡体积分数减小,说明升高温度平衡向逆反应方向移动,则逆反应为吸热反应,B项错误;增大一种反应物的量会使另一种反应物的转化率增大,则n(B2)初始越大,达到平衡时A2的转化率越大,即达到平衡时A2的转化率大小为c>b>a,C项错误;温度T2及n(A2)初始不变时,增大B2的量,生成物的物质的量增大,则平衡时AB3的物质的量大小为c>b>a,D项正确。
[真题验收]
1.(2015·四川高考)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数。
下列说法正确的是( )
A.550 ℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650 ℃时,反应达平衡后CO2的转化率为25.0%
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
解析:选B 550 ℃时,若充入惰性气体,v正、v逆均减小,由于保持了压强不变,相当于扩大了体积,平衡正向移动,A项错误。根据图示可知,在650 ℃时,CO的体积分数为40%,根据反应方程式:C(s)+CO2(g)2CO(g),设开始加入1 mol CO2,反应掉了x mol CO2,则有:
C(s)+CO2(g) 2CO(g)
始态: 1 mol 0
变化: x mol 2x mol
平衡: (1-x)mol 2x mol
因此有:×100%=40%,解得x=0.25,则CO2的平衡转化率为×100%=25.0%,B项正确。由图可知,T ℃时,CO与CO2的体积分数相等,在等压下充入等体积的CO和CO2,对原平衡条件无影响,平衡不移动,C项错误。925 ℃时,CO的体积分数为96%,故Kp===23.04p总,D项错误。
2.(2017·全国卷Ⅲ)298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO(aq)+I2(aq)+2OH-(aq)AsO(aq)+2I-(aq)+H2O(l)。溶液中c(AsO)与反应时间(t)的关系如图所示。
若平衡时溶液的pH=14,则该反应的平衡常数K为________。
解析:根据题意,起始时[AsO]=[I2]=x mol·L-1。根据图像可知平衡时[AsO]=y mol·L-1,则此时[I-]=2y mol·L-1,[AsO]=[I2]=(x-y) mol·L-1,平衡时溶液的pH=14,则[OH-]=1 mol·L-1,故该反应的平衡常数K==。
答案:
[综合演练提能]
[课堂巩固练]
1.下列事实能用勒夏特列原理来解释的是( )
A.SO2氧化为SO3,往往需要使用催化剂
2SO2(g)+O2(g)2SO3(g)
B.500 ℃左右的温度比室温更有利于合成氨反应
N2(g)+3H2(g)2NH3(g) ΔH<0
C.H2、I2、HI平衡混合气体加压后颜色加深
H2(g)+I2(g)2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气
Cl2+H2OH++Cl-+HClO
解析:选D 加入催化剂有利于加快反应速率,但不会引起平衡移动,不能用勒夏特列原理解释,A错误;合成氨的正反应是放热反应,升高温度平衡逆向移动,500 ℃左右的温度比室温更有利于合成氨反应,是从反应速率不能太低和催化剂的活性两方面考虑,不能用平衡移动原理解释,B错误;在H2(g)+I2(g)2HI(g)平衡中,增大压强,浓度增加,颜色加深,平衡不移动,不能用勒夏特列原理解释,C错误;氯气和水的反应是可逆反应,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,减小氯气溶解度,实验室可用排饱和食盐水的方法收集氯气,能用勒夏特列原理解释,D正确。
2.(2018·湖州月考)在一定条件下,可逆反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,达到化学平衡状态时,下列说法正确的是( )
A.降低温度,可提高反应速率
B.加入合适的催化剂,可提高N2的转化率
C.N2的正反应速率等于NH3的逆反应速率
D.反应物和生成物的浓度都不再发生变化
解析:选D 降低温度,反应速率减慢,A项错误;加入合适的催化剂,反应速率加快,但平衡不移动,N2的转化率不变,B项错误;反应达到平衡时,N2的正反应速率等于NH3的逆反应速率的一半,C项错误;反应达到平衡时,反应物和生成物的浓度不变,D项正确。
3.反应2A(g)2B(g)+E(g) ΔH=Q kJ·mol-1(Q>0),达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.缩小体积加压 B.扩大体积减压
C.增加E的浓度 D.降温
解析:
选D 缩小体积加压,平衡逆向移动,A的浓度增大,但正反应速率也增大,A错误;扩大体积减压,平衡正向移动,正反应速率降低,但A的浓度也减小,B错误;增加E的浓度,平衡逆向移动,A的浓度增大,但正反应速率增大,C错误;降温,正反应速率降低,且平衡逆向移动,A的浓度增大,D正确。
4.(2018·宜昌调研)已知4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1。一定条件下,向容积为1 L的密闭容器中投入0.8 mol NH3和1.6 mol O2,发生上述反应,2 min末和4 min末时NH3的物质的量分别为0.6 mol和0.3 mol。下列说法中不正确的是( )
A.上述反应的逆反应的活化能不小于905.9 kJ·mol-1
B.反应从2 min末到4 min末,O2的平均反应速率为0.15 mol·L-1·min-1
C.反应在2 min末时改变了某一条件,该条件可能是使用催化剂或升高温度
D.反应达平衡后降低压强,混合气体的平均摩尔质量减小
解析:选B 正反应是放热反应,该反应的逆反应的活化能减去正反应的活化能等于905.9 kJ·mol-1,则逆反应的活化能不小于905.9 kJ·mol-1,A项正确;v(O2)=v(NH3)=×=0.187 5 mol·L-1·min-1,B项错误;反应从2 min末到4 min末,使用催化剂或升高温度均能加快反应速率,使反应物的物质的量减少,C项正确;反应达平衡后降低压强,平衡正向移动,反应物和生成物的总质量不变,总物质的量增大,则混合气体的平均摩尔质量减小,D项正确。
5.一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中发生反应:N2(g)+O2(g)2NO(g)。图中曲线a表示温度为T时N2的浓度随时间的变化关系,曲线b表示在某一起始反应条件改变时N2的浓度随时间的变化关系(不改变反应物的物质的量)。下列叙述正确的是( )
A.曲线a和曲线b表示该反应可能在相同温度下进行
B.曲线b对应的起始反应条件改变是加入了催化剂
C.温度T下,该反应平衡前后混合气体的密度不发生变化
D.温度T下,该反应的平衡常数K=
解析:选C 该反应为气体分子数不变的反应,压强对反应限度无影响,则曲线a、b对应的只能是在不同温度下进行的反应,A项错误;两种条件下反应达到平衡时N2的浓度不同,说明反应的限度不同,则改变的条件不是加入了催化剂,B项错误;容器体积不变,反应体系中的物质全部为气体,故平衡前后容器中混合气体的密度不变,C项正确;根据“三段式”可求温度为T时该反应的平衡常数:
N2(g) + O2(g) 2NO(g)
起始/(mol·L-1) c0 c0 0
转化/(mol·L-1) c0-c1 c0-c1 2(c0-c1)
平衡/(mol·L-1) c1 c1 2(c0-c1)
平衡常数K==,D项错误。
6.在一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)2SO3(g) ΔH= -196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。
请回答下列问题:
(1)判断该反应达到平衡状态的标志是______(填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)SO2的转化率为____________,达到平衡时反应放出的热量为____________。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。
则温度关系:T1________T2(填“>”“<”或“=”)。
解析:(1)a项,SO2、O2、SO3三者的浓度之比为2∶1∶2和计量数比相等,与反应是否平衡没有必然联系,不能作为判断平衡的标志;b项,因该平衡是一个恒容条件下的化学平衡,反应前后气体的物质的量发生变化,现在压强不变,说明气体总量不变,反应达到了平衡状态;c项,因该平衡是恒容条件下的化学平衡,反应物和生成物均为气体,则气体质量恒定,气体密度恒定,不能作为判断达到平衡的标志;d项,SO3的物质的量不再变化,可逆反应达到平衡状态;e项,SO2的生成速率和SO3的生成速率相等,可逆反应达到平衡状态。(2)在容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,设反应前后,O2消耗了x mol
2SO2(g)+O2(g)2SO3(g)
起始(mol) 0.4 0.2 0
转化(mol) 2x x 2x
平衡(mol) 0.4-2x 0.2-x 2x
当反应达到平衡时,容器内压强变为起始时的0.7倍,得到=0.7,解得x=0.18,则
2SO2(g)+O2(g)2SO3(g)
起始(mol) 0.4 0.2 0
转化(mol) 0.36 0.18 0.36
平衡(mol) 0.04 0.02 0.36
SO2的转化率为×100%=90%;达到平衡时反应放出的热量=0.36 mol× kJ·mol-1=35.28 kJ。(3)该反应为放热反应,升高温度,平衡逆向移动,SO2的体积分数增大,得到温度关系:T1T1
解析:选B B点SO2的转化率为0.85,则平衡时浓度为=0.03 mol·L-1,故A项错误;A点转化率为0.80,则
2SO2(g)+O2(g)2SO3(g)
开始/(mol·L-1) 0.2 0.1 0
转化/(mol·L-1) 0.16 0.08 0.16
平衡/(mol·L-1) 0.04 0.02 0.16
K==800,故B项正确;达平衡后,若增大容器容积,反应速率减小,平衡逆向移动,逆反应速率大于正反应速率,与图像不符,故C项错误;T1条件下反应先达到平衡,则T1>T2,故D项错误。
4.(2018·亳州第二次联考)在t ℃时,向a L密闭容器中加入1.6 mol HI(g),发生反应2HI(g)H2(g)+I2(g) ΔH>0,H2的物质的量随时间的变化如图所示,下列有关说法中正确的是( )
A.平衡时,I2蒸气的体积分数为25%
B.若在1.5 min时降低温度,则反应将向左进行
C.平衡后若升高温度,v正增大,v逆减小
D.平衡后向容器中加入一定量的H2后,平衡向左移动,H2的体积分数减小
解析:选A 该反应反应前后气体体积不变,由图可知,平衡时n(H2)=0.4 mol,则有n(I2)=0.4 mol,故I2蒸气的体积分数为×100%=25%,A正确;1.5 min时反应未达到平衡状态,降低温度,反应速率减慢,但反应仍向右进行,直至平衡,B错误;平衡后若升高温度,v正、v逆均增大,但v正增大的程度大于v逆,平衡向右移动,C错误;平衡后加入H2,平衡向左移动,根据勒夏特列原理可知,达到新平衡后,c(H2
)仍比原来大,则新平衡后H2的体积分数增大,D错误。
5.在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g)Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
A.反应进行到5 min时,b容器中v(正)=v(逆)
B.正反应为吸热反应,平衡常数:K(T1)>K(T2)
C.b中v(正)大于a中v(逆)
D.达到平衡时,a、b、c中CO的转化率为b>c>a
解析:选C 根据图像可知,随着温度的升高,φ(CO)先减小后增大,若三个容器都未达到平衡状态,则应该是随着温度的升高,φ(CO)一直减小,但b容器中φ(CO)小于c容器,所以可以确定反应在T2到T3之间,先达到了平衡状态,然后随着温度升高,平衡向逆反应方向移动,所以可知该反应的正反应为放热反应,B项错误。若三个容器都达到平衡状态,因为是放热反应,a容器的φ(CO)应小于b容器,但实际上a容器的φ(CO)大于b容器,所以确定a容器还未达到平衡状态,b容器不确定,所以v(正)、v(逆)不一定相等,A项错误。a容器中反应还没达到平衡,反应向正反应方向进行,所以va(正)>va(逆);因b容器的温度高于a容器的温度,所以相同时间内,vb(正)>va(正),所以vb(正)>va(逆),C项正确。因为该反应是放热反应,所以三容器达到平衡时,CO的转化率为a>b>c,D项错误。
6.在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)2C(g) ΔH>0。达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
选项
x
y
A
通入A气体
B的转化率
B
加入催化剂
A的体积分数
C
增大压强
混合气体的总物质的量
D
升高温度
混合气体的总物质的量
解析:选A A项,当通入A气体时,平衡向正反应方向移动,B的转化率增大,正确;B项,加入催化剂只能改变反应速率,平衡不移动,A的体积分数不变,错误;C项,增大压强,平衡向正反应方向移动,混合气体的总物质的量减小,错误;D项,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,混合气体的总物质的量减小,错误。
7.(2018·淮北一模)已知反应:2NO2(红棕色)N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
A.b点达到平衡状态
B.b点与a点相比,c(NO2)、c(N2O4)均减小
C.d点:v(正)z,平衡向正反应方向移动,C的体积分数增大,因为压缩了容器的容积,则B的物质的量浓度增大,故A项正确,B、C、D项错误。
9.(2017·荆门调研)一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是( )
A.反应方程式中x=2
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量D
D.t1~t3间该反应的平衡常数不相同
解析:选A t2时刻改变条件,浓度增大而平衡不移动,催化剂只改变反应速率,不影响平衡,则只能是改变容器的体积,使浓度增大且平衡不移动,所以反应前后气体体积不变,故x=2,A项正确,B项错误;由于D是固体,D的多少不影响反应速率和化学平衡,故C项错误;平衡常数只与温度有关,温度不变,平衡常数不变,故D项错误。
10.在①、②、③容积不等的恒容密闭容器中,均充入0.1 mol CO和0.2 mol H2,在催化剂的作用下发生反应:CO(g)+2H2(g)CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示。
下列说法正确的是( )
A.该反应的正反应为吸热反应
B.三个容器的容积:①>②>③
C.在P点,CO的转化率为75%
D.在P点,向容器②中再充入CO、H2及CH3OH各0.025 mol,此时v正(CO)<v逆(CO)
解析:选C 由题图可知,容积一定时,温度升高,CH3OH的体积分数减小,说明升高温度,平衡逆向移动,故该反应的ΔH<0,正反应为放热反应,A错误。三个容器中起始加入CO和H2的量分别相等,温度一定时,容器的容积越小,体系的压强越大,反应向正反应方向进行的程度越大,反应物的转化率越大,CH3OH的体积分数越大,故容器的容积:①<②<③,B错误。P点CH3OH的体积分数为50%,根据同温同压下,气体的体积之比等于其物质的量之比,则有
CO(g)+2H2(g)CH3OH(g)
起始量/mol 0.1 0.2 0
转化量/mol x 2x x
平衡量/mol 0.1-x 0.2-2x x
则CH3OH的体积分数为×100%=50%,解得x=0.075 mol,故P点CO的转化率为×100%=75%,C正确。在P点,向容器②中再充入CO、H2及CH3OH各0.025 mol,此时,容器②中n(CO)=0.05 mol、n(H2)=0.075 mol、n(CH3
OH)=0.1 mol,设容器②的容积为V L,则达到平衡时K==1 200V2,充入气体后Qc==355.6V2<K=1 200V2,平衡正向移动,此时v正(CO)>v逆(CO),D错误。
11.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从3 min到9 min,v(H2)=_______mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填字母)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为________。
(4)平衡时混合气体中CH3OH(g)的体积分数是_____________________________。
(5)一定温度下,第9 min时v逆(CH3OH)________(填“大于”“小于”或“等于”)第3 min时v正(CH3OH)。
解析:(1)从3 min到9 min消耗CO2是0.25 mol·L-1,根据方程式可知消耗氢气是0.75 mol·L-1,则v(H2)=0.75 mol·L-1÷6 min=0.125 mol·L-1·min-1。(2)反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)时反应速率仍然发生变化,没有达到平衡状态,A错误;密度是混合气体的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B错误;单位时间内消耗3 mol H2,同时一定生成1 mol H2O,不能说明反应达到平衡状态,C错误;CO2的体积分数在混合气体中保持不变说明反应达到平衡状态,D正确。(3)平衡时消耗CO2是0.75 mol·L-1,则CO2的转化率为×100%=75%。(4)平衡时剩余氢气是0.75 mol,生成水蒸气是0.75 mol,则混合气体中CH3OH(g)的体积分数是×100%=30%。(5)第9 min时反应达到平衡状态,则v逆(CH3OH)小于第3 min时v正(CH3OH)。
答案:(1)0.125 (2)D (3)75% (4)30% (5)小于
12.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
回答下列问题:
(1)该反应的化学方程式为_________________________________________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变
b.H2的浓度不再改变
c.气体的密度不随时间改变
d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。
根据图中数据分析:
①降低温度,平衡向________方向移动。
②在700 K、起始投料比=1.5时,H2的转化率为________。
③在500 K、起始投料比=2时,达到平衡后H2的浓度为a mol·L-1,则达到平衡时CH3CH2OH的浓度为________。
解析:(1)由题给信息可得到该反应的化学方程式为2CO2+6H2C2H5OH+3H2O。(2)该反应为气体分子数减小的化学反应,当体系的压强不再改变时,反应达到平衡状态,另外氢气的浓度不再变化,也能说明反应达到平衡状态;由于在500 K时,所有物质均为气体,故在恒容状态下气体的密度恒为定值,密度不变不能说明反应达到平衡状态;根据化学方程式可知,任何单位时间内消耗H2和CO2的物质的量之比均为3∶1。(3)①由图中信息可知,其他条件不变时,升高温度,CO2的转化率降低,说明平衡向逆反应方向移动,故正反应为放热反应,即降低温度,平衡将向正反应方向移动。②700 K时,当氢气与二氧化碳的起始投料比=1.5时,由图像可知二氧化碳的转化率为20%,由化学方程式:2CO2+6H2C2H5OH+3H2O,可计算出氢气的转化率为40%。③设起始时c(CO2)=x mol·L-1,则起始时c(H2)=2x mol·L-1,有
2CO2+6H2C2H5OH+3H2O
起始(mol·L-1): x 2x 0 0
转化(mol·L-1): 0.6x 1.8x 0.3x 0.9x
平衡(mol·L-1): 0.4x 0.2x 0.3x 0.9x
0.2x=a mol·L-1,则0.3x=1.5a mol·L-1。
答案:(1)2CO2+6H2C2H5OH+3H2O
(2)ab
(3)①正反应(或右) ②40% ③1.5a mol·L-1
13.醋酸由于成本较低,在生产中被广泛应用。
(1)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛作中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
CH2===CH2(g)+CH3COOH(l)CH3COOC2H5(l)
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是________(填字母)。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1 mol碳碳双键的同时乙酸恰好消耗1 mol
D.体系中乙烯的质量分数一定
(2)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题:
①温度在60~80 ℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是________[用v(p1)、v(p2)、v(p3)分别表示不同压强下的反应速率],分析其原因:________________________________________________________________________
________________________________________________________________________。
②压强为p1、温度为60 ℃时,若乙酸乙酯的产率为30%,则此时乙烯的转化率为________。
③在压强为p1、温度超过80 ℃时,分析乙酸乙酯产率下降的原因:________________________________________________________________________。
④
根据测定实验结果分析,较适宜的生产条件是________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有_______________________(任写出一条)。
解析:(1)浓度相同不能说明浓度保持不变,A项不能说明反应达到平衡;酯化合成反应的速率与酯分解反应的速率相等,说明正、逆反应速率相等,B项可以说明反应达到平衡;乙烯断开1 mol碳碳键与乙酸恰好消耗1 mol均表示正反应方向,C项不能说明反应达到平衡;体系中乙烯的质量分数一定,说明乙烯的浓度不变,D项可以说明反应达到平衡。(2)①由题图知,在60~80 ℃范围内,v(p1)>v(p2)>v(p3)。该反应为气体分子数减小的反应,增大压强,平衡正向移动,乙酸乙酯的产率增大,故p1>p2>p3,对于有气体参与的反应,其他条件相同时,压强越大,反应速率越快。②乙烯与乙酸乙酯的系数相等,故乙烯的转化率与乙酸乙酯的产率相等。④根据题图,p1、80 ℃时乙酸乙酯的产率最大,为较适宜的生产条件。根据平衡移动原理,通入乙烯气体或增大压强,均可提高乙酸乙酯的合成速率和产率。
答案:(1)BD (2)①v(p1)>v(p2)>v(p3) 其他条件相同时,对于有气体参与的反应,压强越大化学反应速率越快 ②30% ③由图像可知,压强为p1,温度为80 ℃时,反应已达平衡,且正反应放热,故压强不变升高温度平衡逆向移动,产率下降 ④p1、80 ℃ 通入乙烯气体(或增大压强)