- 2021-07-05 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省华南师范大学附属中学2020届高三上学期月考(二)化学试题
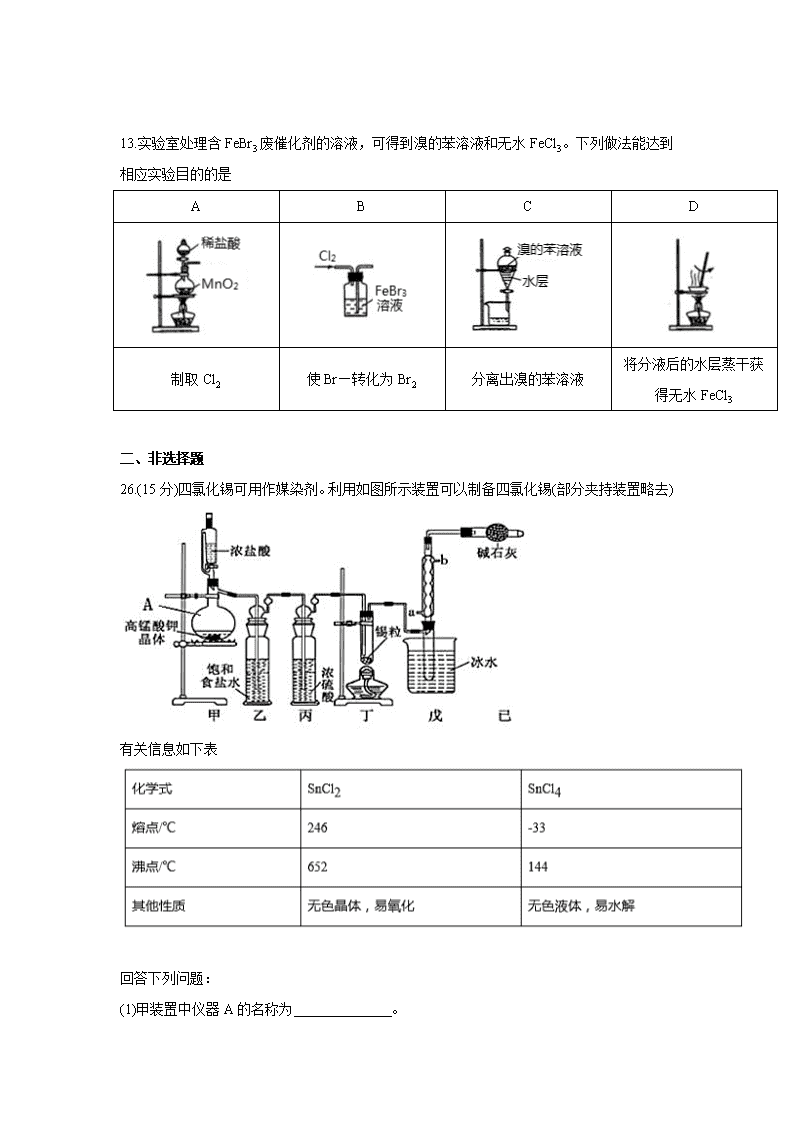
华南师大附中2020届高三年级月考(二) 化学 本试卷共12页,满分300分,考试时间150分钟 注意事项: 1.答卷前,请务必将自己的班级、姓名和考号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,答案必须写在答题卡各题目指定区域。不按要求作答的答案无效。 3.考生必须保持答题卡的整洁。考试结束后,将答题卡上交监考老师。 可能用到的相对原子质量:H-1 C-12 S-32 Cl-35.5 Cu-64 Sn-119 一、选择题:每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是 A.赤色固体可能是Fe2O3 B.“青矾厂气”可能是CO和CO2 C.青矾宜密闭保存,防止氧化变质 D.青矾燃烧过程中发生了电子转移 8.NA代表阿伏加德罗常数的值。下列说法正角的是 A. 1 mol CH3COOC2H5在稀硫酸中水解可得到的乙醇分子数为NA B. pH=1的H2SO3溶液中,含有0.1 NA个H+ C.1 mol Fe分别与足量的稀硫酸和稀硝酸反应转移电子数均为3NA D.常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子 9.化学与生活、生产密切相关,下列说法正确的是 A.常用于染料、医药、农药等的酚类物质可来源于煤的干馏 B.大豆中含有丰富的蛋白质,豆浆煮沸后蛋白质全部变为了氨基酸 C.可以用酸性高锰酸钾溶液鉴别苯和直馏汽油 D.涤纶、有机玻璃、光导纤维都是有机高分子化合物 10.KIO3可作为食盐中的补碘剂。利用“KIO3氧化法”制备KIO3包括以下两个反应: ① 11KIO3+6I2+3H2O=6KH(IO3)2+3Cl2↑+5KCl ② 2KH(IO3)2+KOH==2KIO3+H2O 下列说法正确的是 A.反应①表明氧化性:KH(IO3)2> KIO3 B.反应①中每转移4mol电子生成2.24L Cl2 C.向淀粉溶液中加入少量碘盐,溶液会变蓝 D.可用焰色反应实验证明碘盐中含有钾元素 11实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知Fe3+在pH=5时已经沉淀完全)。其中分析错误的是 A.步骤②发生的主要反应为:2Fe2++H2O2+2H++2Fe3++2H2O B.步骤④为过滤,步骤⑤蒸发结晶 C.步骤②不能用氯水、硝酸等强氧化剂代替H2O2 D.步骤③用CuCO3代替CuO也可调节溶液的pH 12.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是 选项 实验 现象 结论 A 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈红色 稀硝酸将Fe氧化为Fe3+ B 将铜粉加入1.0mol/L Fe2(SO4)3溶液中 溶液变蓝、有黑色固体出现 金属铁比铜活泼 C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 无液态铝滴落 金属铝的熔点高 D 将稀盐酸滴入Na2SiO3溶液中 溶液中出现凝胶 酸性:HCl>H2SiO3 13.实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是 A B C D 制取Cl2 使Br—转化为Br2 分离出溴的苯溶液 将分液后的水层蒸干获得无水FeCl3 二、非选择题 26.(15分)四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置略去) 有关信息如下表 回答下列问题: (1)甲装置中仪器A的名称为 。 (2)用甲装置制氯气,MnO4—被还原为Mn2+,该反应的离子方程式为 。 (3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到 (填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是: ①促进氯气与锡反应; ②_______________________________。 (4)乙装置的作用 ,如果缺少乙装置,可能发生的副反应的化学方程式为____________________________________;己装置的作用是 (填序号) A. 防止空气中CO2气体进入戊装置 B. 除去未反应的氯气,防止污染空气 C. 防止水蒸气进入戊装置的试管中使产物水解 D.防止空气中O2进入戊装置的试管中使产物氧化 (5)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.04g SnCl4,则SnCl4的产率为________。(保留2位有效数字) 27.(14分)从海水中提取溴的工业流程如图: (1)步骤I中将卤水酸化,再通入Cl2,是为了防止Cl2与碱反应,写出Cl2与碱反应的离子方程式 (2)步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是 (3)实验室保存液溴时,通常在盛液溴的试剂瓶中加少量的水,这与液溴的 性质有关(填写序号)。 A.氧化性 B.还原性 C.挥发性 D.密度比水大 (4)步骤II中将吹出的溴蒸汽用纯碱溶液吸收时还有CO2生成,写出吸收时发生反应的离子方程式: (5)步骤II中通入热空气吹出的Br2用纯碱溶液吸收前先经过NaBr溶液,其目的是 (6)步骤III中蒸馏出工业溴后残留液的主要溶质是 (7)步骤III中若使用硝酸酸化,缺点是 28.(14分)铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工业流程如下: 已知: i.铍、铝元素化学性质相似能形成BeO22—; ii.常温下部分难溶物的溶度积常数如下表: 难溶物 Cu(OH)2 Fe(OH)3 Mn(OH)2 溶度积常数(Ksp) 2.2×10-20 4.0×10-38 2.1×10-13 (1)用NaOH溶液溶解铍铜元件步骤中提高溶解率的措施是 。(至少写出两种)滤液A的主要成分除NaOH外,还有 (填化学式)。 (2)写出反应I中含铍化合物与过量盐酸反应的离子方程式 ,写出反应I中生成固体的化学方程式: 。 (3)滤液C中含NaCl、BeCl2和少量HCl。为提纯BeCl2,最合理的实验步骤顺序为 (填字母) a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤 (4)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS发生反应的化学方程式: (5)该小组从1kg该种旧铍铜元件中回收得到433g Cu,则该流程Cu的产率为 (保留三位有效数字)。 36.(15分)氨甲环酸(G)别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略): 回答下列问题: (1)A的结构简式是 。C的化学名称是 。 (2)G在NaOH催化下发生双分子脱水形成仅含两个环的有机物,写出该反应的化学反应方程式 (3)①~⑥中属于取代反应的是 。 (4)E中不含N原子的官能团名称为 。 (5)氨甲环酸(G)的分子式为 。 (6)满足以下条件的所有E的同分异构体有 种。 a.含苯环 b.含硝基 c.苯环上只有两个取代基 (7)写出以和CH2=CHCOOCH2CH3为原料,制备的合成路线: (无机试剂任性) 参考答案 7 8 9 10 11 12 13 B D A D D D C 26.(1)蒸馏烧瓶 (2) (3)丁装置内充满黄绿色气体;②使SnCl4气化 (4)利于从混合物中分离出来;;BC (5)78% 27.(1)Cl2+OH—=ClO—+Cl—+H2O (2)富集溴元素 (3)CD (4)3CO32—+3Br2=3CO2↑+5Br—+BrO3— (5)除去未反应完的氯气 (6)Na2SO4 (7)可能会生成氮氧化物气体污染空气 28.(1)搅拌、升温加热、将元件研磨成粉末、增加碱液的浓度(写出两种即可);Na2BeO2、Na2SiO3 (2)BeO22++4H+=Be2++2H2O;Na2SiO3+2HCl=2NaCl+H2SiO3↓ (3)afed (4)2H2SO4+CuS+MnO2=S+MnSO4+CuSO4+2H2O (5)91.5% 36.(1)CH2=CHCH=CH2;2-氯-1,3-丁二烯 (2) (3)④⑤ (4)酯基、碳碳双键 (5)C8H15O2N (6)15 (7) 查看更多