- 2021-07-05 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
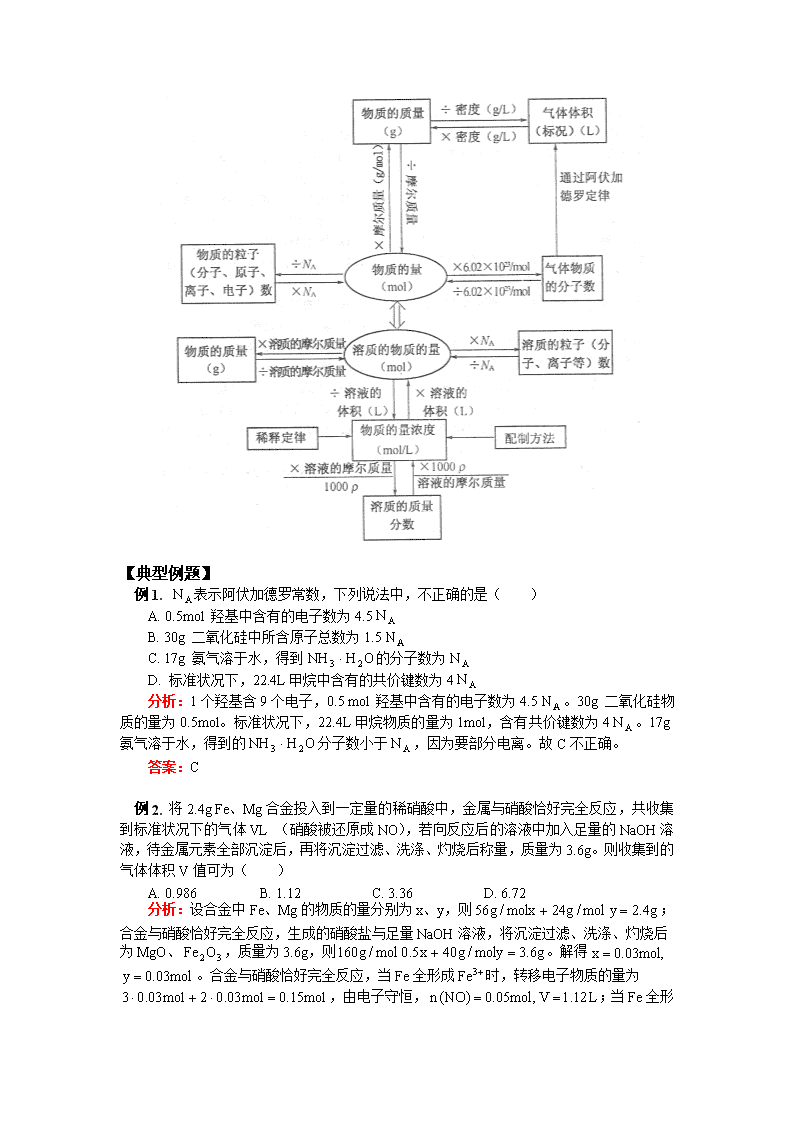
2019届一轮复习鲁科版化学常用计量及定律教案
年 级 高三 学 科 化学 版 本 山东科技版 内容标题 高考第一轮复习:化学常用计量及定律 【本讲教育信息】 一. 教学内容: 化学常用计量及定律 二. 教学目的: 1、认识物质的量是描述微观粒子集体的一个物理量,摩尔是物质的量的基本单位。了解阿伏加德罗常数的涵义。 2、了解摩尔质量、气体摩尔体积、物质的量浓度的涵义。 3、了解物质的质量、摩尔质量、物质的微粒数、物质的量、气体摩尔体积、物质的量浓度等物理量之间的关系,能用它们进行简单的化学计算。 4、体会定量研究的方法对研究和学习化学的重要作用。 三. 重点和难点: 1、物质的量、阿伏加德罗常数、摩尔。 2、摩尔质量、气体摩尔体积、物质的量浓度的概念及其关系。 3、有关物质的量、微粒数、摩尔质量、气体摩尔体积、物质的量浓度的计算。 4、一定物质的量浓度溶液的配制。 四. 考点分析: 本专题在高考中的主要考查点是: 1、物质的量、摩尔质量、气体摩尔体积、物质的量浓度的概念及它们之间的关系。 2、有关物质的量、微粒数、摩尔质量、气体摩尔体积、物质的量浓度的计算。 3、一定物质的量浓度溶液的配制。 五. 知识网络: 【典型例题】 例1. 表示阿伏加德罗常数,下列说法中,不正确的是( ) A. 0.5mol 羟基中含有的电子数为4.5 B. 30g 二氧化硅中所含原子总数为1.5 C. 17g 氨气溶于水,得到的分子数为 D. 标准状况下,22.4L甲烷中含有的共价键数为4 分析:1个羟基含9个电子,0.5 mol 羟基中含有的电子数为4.5。30g 二氧化硅物质的量为0.5mol。标准状况下,22.4L甲烷物质的量为1mol,含有共价键数为4。17g氨气溶于水,得到的分子数小于,因为要部分电离。故C不正确。 答案:C 例2. 将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL (硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V值可为( ) A. 0.986 B. 1.12 C. 3.36 D. 6.72 分析:设合金中Fe、Mg的物质的量分别为x、y,则;合金与硝酸恰好完全反应,生成的硝酸盐与足量NaOH溶液,将沉淀过滤、洗涤、灼烧后为MgO、,质量为3.6g,则。解得 。合金与硝酸恰好完全反应,当Fe全形成时,转移电子物质的量为,由电子守恒, ;当Fe全形成时,转移电子物质的量为,由电子守恒, ;收集到的气体体积V值可能为。故AB正确。 答案:AB 例3. 设为阿伏加德罗常数,下列说法中不正确的是( ) A. 常温常压下,11.2L氮气所含的原子数目为 B. 活泼金属从盐酸中置换出1 mol ,电子转移数为2 C. 100mL、溶液中的浓度为 D. 在标准状况下,0.5个氧气分子所占的体积是11.2L 分析:A选项中气体所处状况不是标准状态,而是常温常压,11.2L氮气所含的原子数目应小于;B盐酸中发生反应,所以说法正确;C中是强电解质,在水溶液中完全电离:浓度为原盐浓度的3倍,即,C说法正确;D中气体处于标准状况,0.5个氧气分子即,体积为11.2L,所以D说法正确。 答案:A 例4. 标况下有:①6.72L甲烷,②氯化氢分子,③13.6g硫化氢,④0.2mol 氨气,则这四种气体体积由大到小的顺序是_________,密度由大到小的顺序是___________。 分析:比较相同状况下气体体积大小通过比较气体的物质的量即可,因为在相同状况下,气体的体积与物质的量成正比。①中,②中 ,③中,④中;相同状况下气体的密度与分子的相对分子质量成正比,所以这四种气体的密度由大到小的顺序是②③④①。 答案:②③①④ ②③④① 例5. 某工厂用溶液腐蚀镀有铜的绝缘板生产印刷电路。某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50mL废液,向其中加入足量的稀硝酸,生成0.02mol NO;另取50mL 废液,向其中加入足量的溶液,析出沉淀43.05g。请回答以下问题: (1)该厂原来使用的溶液中溶质的物质的量浓度为____________(反应前后溶液的体积变化忽略不计)。 (2)原废液中各金属阳离子的物质的量浓度之比为_____________。 (3)另取50mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中的物质的量范围为___________。 分析:(1)由氯元素守恒, (2)50mL废液中加入足量的稀硝酸生成,由电子守恒,;根据电荷守恒,, 则: (3)向50mL废液中加入一定量铁屑,必须把反应完才可能析出铜,由 ,此时;充分反应后铜全部析出,由氯元素守恒,。 答案:(1)2mol/L (2)4:6:3 (3)查看更多