- 2021-07-05 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
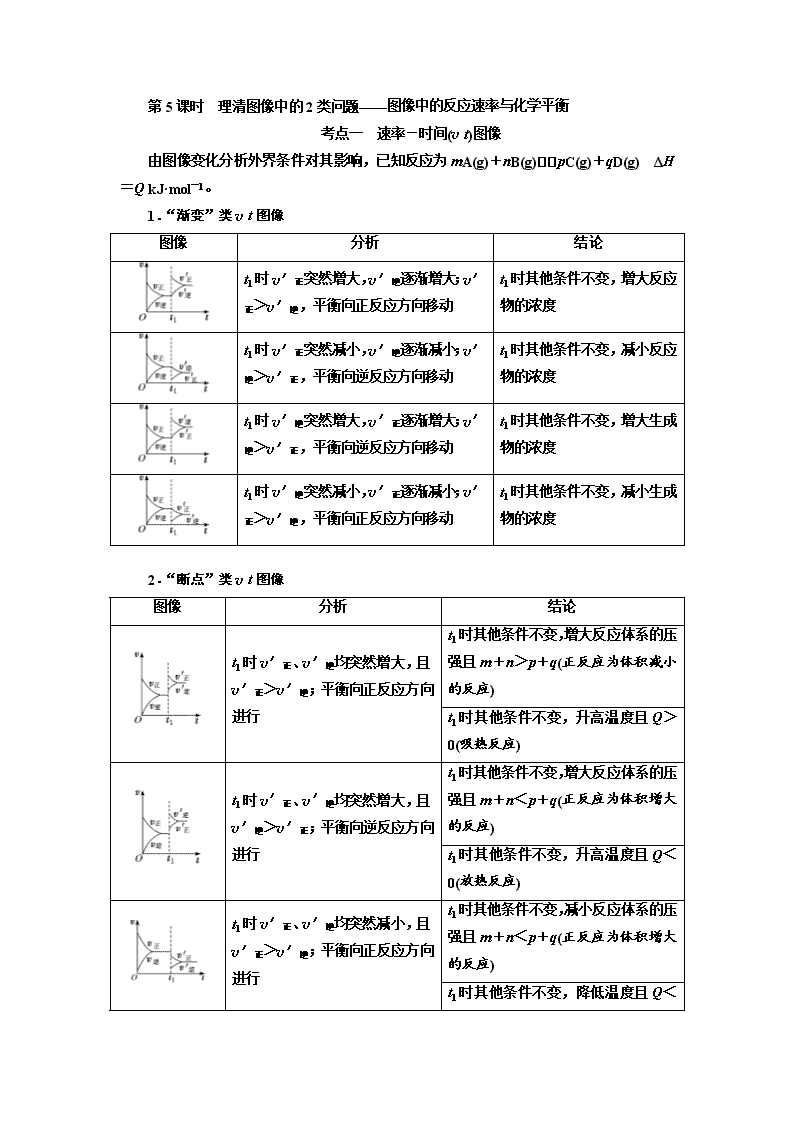
2020届一轮复习通用版7-5理清图像中的2类问题图像中的反应速率与化学平衡学案
第5课时 理清图像中的2类问题 考点一 速率-时间(vt)图像 由图像变化分析外界条件对其影响,已知反应为mA(g)+nB(g)pC(g)+qD(g) ΔH=Q kJ·mol-1。 1.“渐变”类vt图像 图像 分析 结论 t1时v′正突然增大,v′逆逐渐增大;v′正>v′逆,平衡向正反应方向移动 t1时其他条件不变,增大反应物的浓度 t1时v′正突然减小,v′逆逐渐减小;v′逆>v′正,平衡向逆反应方向移动 t1时其他条件不变,减小反应物的浓度 t1时v′逆突然增大,v′正逐渐增大;v′逆>v′正,平衡向逆反应方向移动 t1时其他条件不变,增大生成物的浓度 t1时v′逆突然减小,v′正逐渐减小;v′正>v′逆,平衡向正反应方向移动 t1时其他条件不变,减小生成物的浓度 2.“断点”类vt图像 图像 分析 结论 t1时v′正、v′逆均突然增大,且v′正>v′逆;平衡向正反应方向进行 t1时其他条件不变,增大反应体系的压强且m+n>p+q(正反应为体积减小的反应) t1时其他条件不变,升高温度且Q>0(吸热反应) t1时v′正、v′逆均突然增大,且v′逆>v′正;平衡向逆反应方向进行 t1时其他条件不变,增大反应体系的压强且m+n<p+q(正反应为体积增大的反应) t1时其他条件不变,升高温度且Q<0(放热反应) t1时v′正、v′逆均突然减小,且v′正>v′逆;平衡向正反应方向进行 t1时其他条件不变,减小反应体系的压强且m+n<p+q(正反应为体积增大的反应) t1时其他条件不变,降低温度且Q< 0(放热反应) t1时v′逆、v′正均突然减小,且v′逆>v′正;平衡向逆反应方向进行 t1时其他条件不变,减小反应体系的压强且m+n>p+q(正反应为体积减小的反应) t1时其他条件不变,降低温度且Q>0(吸热反应) 3.“平台”类vt图像 图像 分析 结论 t1时v′正、v′逆均突然增大且v′正=v′逆,平衡不移动 t1时其他条件不变使用催化剂 t1时其他条件不变增大反应体系的压强且m+n=p+q(反应前后气体体积无变化) t1时v′正、v′逆均突然减小且v′正=v′逆,平衡不移动 t1时其他条件不变,减小反应体系的压强且m+n=p+q(反应前后气体体积无变化) [典例] 对于反应2SO2(g)+O2(g)2SO3(g) ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)( ) [解析] 分析时要注意改变条件瞬间v正、v逆的变化。增加O2的浓度,v正增大,v逆瞬间不变,A正确;增大压强,v正、v逆都增大,v正增大的倍数大于v逆,B正确;升高温度,v正、v逆都瞬间增大,C错误;加入催化剂,v正、v逆同时同倍数增大,D正确。 [答案] C [综合训练] 1.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g) ,达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( ) A.30~40 min间该反应使用了催化剂 B.化学方程式中的x=1,正反应为吸热反应 C.30 min时降低温度,40 min时升高温度 D.8 min前A的平均反应速率为0.08 mol·L-1·min-1 解析:选D A项,若使用催化剂,则化学反应速率加快,故错误;由甲图像可知,A、B的浓度变化相同,故A、B的化学计量数相同,都为1;由乙图像可知,30 min时改变的条件为减小压强,40 min时改变的条件为升高温度,且升高温度平衡向逆反应方向移动,则正反应为放热反应。8 min前A的平均反应速率为=0.08 mol·L-1·min-1。 2.密闭容器中发生反应:A(g)+3B(g)2C(g) ΔH<0,根据vt图像,回答下列问题: (1)下列时刻所改变的外界条件是t1________________________________________; t3______________________;t4___________________________________________。 (2)反应速率最快的时间段是________。 (3)下列措施能增大正反应速率的是________。 A.通入A(g) B.分离出C(g) C.降温 D.增大容器容积 解析:(1)t1时刻,改变条件,v′正、v′逆均增大,且v′逆>v′正,平衡逆向移动,说明改变的条件是升高温度。t3时刻,改变条件,v″正、v″逆同等程度增大,且该反应是反应前后气体物质的量不相等的反应,故改变的条件是加入催化剂。t4时刻,改变条件,v正、v逆均减小,且v逆>v正,平衡逆向移动,说明改变的条件是减小压强。 (2)t3~t4时间段内,反应使用催化剂,由图像可知该时间段内反应速率最快。 (3)降温、增大容器容积均会使正、逆反应速率减小;分离出C(g)时,v正不变,v逆减小,随着反应的进行v正会减小,通入A(g),反应物的浓度增大,v正增大。 答案:(1)升高温度 加入催化剂 减小压强 (2)t3~t4 (3)A 考点二 突破常规图像 1.含量—时间—温度(压强)图像 常见图像形式有如下几种。其中C%指生成物的百分含量,B%指反应物的百分含量。 ① ② ③ ④ ⑤ [析图关键] 表示不同条件下,反应达到平衡的时间快慢、反应速率的快慢以及平衡混合物中某物质的百分含量的关系。解题方法是“先拐先平,数值大”。即曲线先出现拐点的首先达到平衡,反应速率快,以此判断温度或压强的高低。再依据外界条件对平衡的影响分析判断反应的热效应及反应前后气体体积的变化。 2.转化率(或质量分数)与压强—温度图像 (1)恒压线图像 [析图关键] 表示两个外界条件同时变化时,反应物A的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。如:图1中,当压强相等(任意一条等压线)时,升高温度,A的转化率增大,说明升高温度平衡正向移动,即正反应为吸热反应。当温度相等时,在图1中作直线,与三条等压线交于三点,这三点自下而上为增大压强,A的转化率增大,说明增大压强平衡正向移动,即正反应为气体体积减小的反应。 (2)恒温线图像 [析图关键] 图3中,当温度相等(任意一条等温线)时,增大压强,A的转化率增大,说明增大压强平衡正向移动,即正反应是气体体积减小的反应。当压强相等时,在图3中作直线,与两条等温线交于两点,这两点自下而上为降低温度,A的转化率增大,说明降低温度平衡正向移动,即正反应为放热反应。 3.化学平衡中的特殊图像 (1)对于化学反应:mA(g)+nB(g)pC(g)+qD(g),M点前,表示从反应开始,v(正) >v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故ΔH<0。 (2)对于化学反应:mA(g)+nB(g)pC(g)+qD(g),L线上所有的点都是平衡点。L线的上方(E点),A的百分含量大于此压强时平衡体系中A的百分含量,所以E点满足v(正)>v(逆);同理L线的下方(F点)满足v(正)查看更多