- 2021-07-03 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
硅酸盐矿物与硅酸盐产品教案(1)
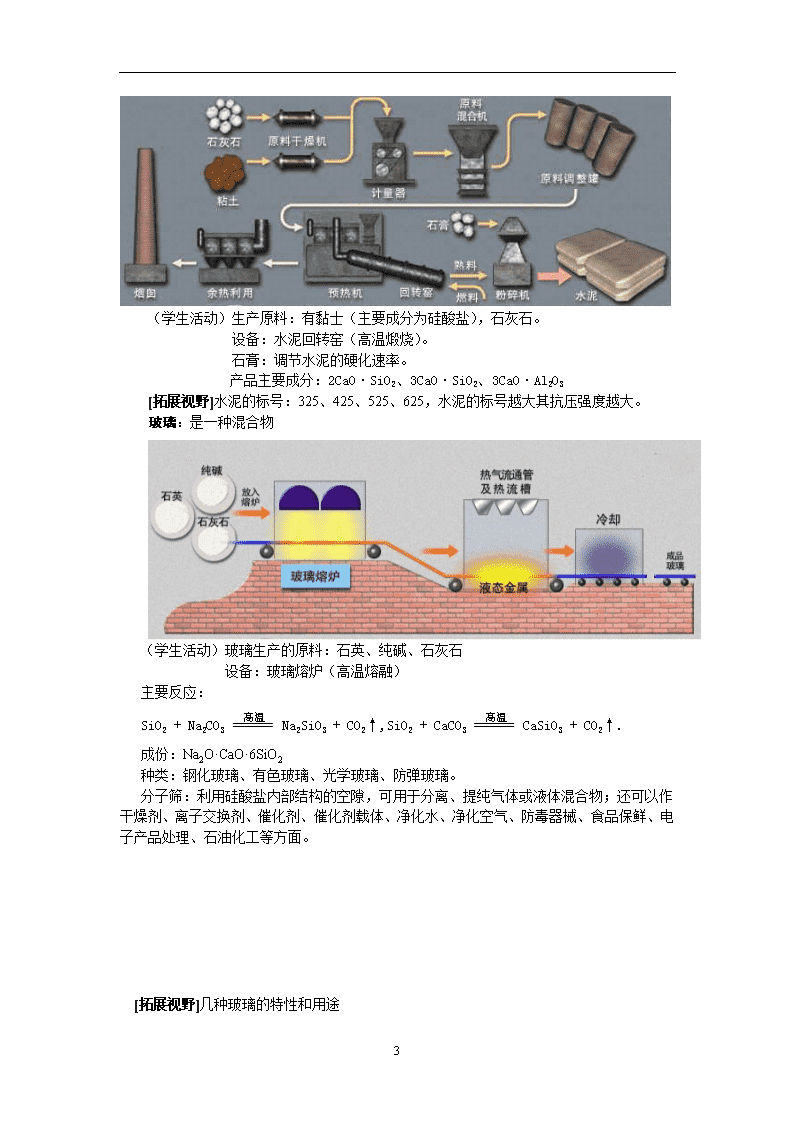
第三单元 含硅矿物与信息材料 ★教学目标 知识技能: 1.了解硅、二氧化硅、硅酸、硅酸盐的存在与性质,认识硅及其化合物在生活实际中的重要应用。 2. 要求学生查阅资料,学会通过查阅资料来获取知识的学习方法,培养对新旧知识进行归纳比较的逻辑思维能力,培养自主学习和创新能力 过程方法: 1.通过对自然界中存在的含硅化合物的学习,使学生了解硅元素在自然界的存在形式及硅酸盐的结构复杂性。 2.通过探究性实验掌握硅酸钠的有关知识;学会将硅酸盐的化学式书写氧化物的形式的方法和技巧。 3.通过对硅酸盐工业产品的了解,使学生了解到硅酸盐矿物的应用与人类文明的发展的密切关系。 4.利用图片、模型、表格、视频、实物、实验及多媒体教学手段等,增强直观性和形象性。 情感态度与价值观: 1. 从传统材料到信息材料的学习,激发学生学习兴趣,增强学生研究、探索、发现新材料的意识;体会“化学――人类进步的关键”这句话的思想内涵,增强学生学习化学的兴趣。 2.了解我国材料科学发展的成就、社会及科学技术的发展对新型材料的要求,激发学生爱国主义热情,提高社会责任感。 ★ 教学重点 硅酸钠 、单质硅 、二氧化硅的性质;硅酸盐的氧化物形式的书写 ★ 教学难点 单质硅和二氧化硅的结构 ★ 教学课时 第一课时:硅酸盐矿物、传统材料与信息材料的介绍。 第二课时:单质硅、二氧化硅的结构和性质及它们的用途。 ★ 教学方法探究式教学,多媒体教学法。 ★ 教学过程 3.3.1 硅酸盐矿物与硅酸盐产品 导入新课 : 在日常生活中,我们经常接触到玻璃、水泥、及陶瓷。同学们知道这些硅酸盐是用什么原料生产的吗?那这节课我们就来研究硅酸盐有关的知识。 提出问题 : (1)硅元素在地壳中的含量怎样? (2)硅元素在自然界主要有哪些存在形式? 解析:(1)地壳中硅元素的含量仅次于氧,约占总质量的四分之一。 (2)硅元素在自然界中主要是以硅酸盐和二氧化硅的形式存在。地壳质量的92%是硅酸盐和二氧化硅。 过渡:硅元素在自然界中广泛存在,主要是硅酸盐和二氧化硅的形式,下面我们先来了解硅酸盐的有关知识。 6 (多媒体展示) 自然界中的一些硅酸盐的图片及其化学式: 结论:硅酸盐的结构复杂 一、常见的硅酸盐 硅酸及其缩水结合而成的各种酸所对应的盐统称硅酸盐。 硅酸盐是构成地壳岩石的主要成分,种类很多,结构复杂,常用氧化物的形式来表示组成。其改写的规律:①各元素写成相应的氧化物,元素的价态保持不变。②顺序按先金属后非金属,金属元素中按金属活动顺序表依次排列,中间用“ · ”间隔。③注意改写后应与原来化学式中的原子个数比不变。 如:滑石Mg3(Si4O10)(OH)2 可表示为3MgO·4SiO2·H2O 硅酸盐组成复杂,一般用氧化物的形式表示它们的组成: (学生活动)锆石:ZrO2·SiO2 红柱石:Al2O3·SiO2 钙铝石榴子石:3CaO·Al2O3·3SiO2 镁橄榄石:2MgO·SiO2 过渡:在硅酸盐中,硅酸钠是极少数溶于水中的一种,用途广泛,下面我们先来学习它的有关知识. 硅酸钠:Na2SiO3固体俗称泡花碱Na2SiO3 能溶于水,其水溶液俗称“水玻璃”,是工业使用的一种黏合剂,耐火、耐腐蚀。 探究① 加水溶解,并检验其溶液酸碱性; (学生活动)(硅酸钠水溶液呈碱性) ②向溶液中通二氧化碳或滴加稀盐酸观察现象; (学生活动)(向溶液通二氧化碳有白色沉淀生成,滴加稀盐酸也有白色沉淀生成) Na2SiO3 + 2H2O + CO2 == H4SiO4↓+Na2CO3 Na2SiO3 + 2HCl + H2O == H4SiO4↓+ 2NaCl(制取Na2SiO3) ③再向②中滴加氢氧化钠溶液观察现象。 (学生活动)(白色沉淀溶解) H4SiO4 + 2NaOH == Na2SiO3 + 3H2O 深化理解:实验室保存Na2SiO3溶液的方法 因为硅酸的酸性比碳酸还弱,所以空气中的CO2可以和Na2SiO3水溶液发生如下反应Na2SiO3 + H2O + CO2 == H2SiO3↓+Na2CO3从而使硅酸钠变质,因此保存硅酸钠要密封保存。同时,又由于硅酸钠为矿物胶,有较强的粘性,也不能用磨口的玻璃瓶和玻璃塞,以免瓶口粘结。 过渡:在丰富的硅酸盐中,除硅酸钠外,其它的在工农业生产中的作用如何?下面我们来了解传统的硅酸盐产品的有关知识。 水泥 : 6 (学生活动)生产原料:有黏士(主要成分为硅酸盐),石灰石。 设备:水泥回转窑(高温煅烧)。 石膏:调节水泥的硬化速率。 产品主要成分:2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3 [拓展视野]水泥的标号:325、425、525、625,水泥的标号越大其抗压强度越大。 玻璃:是一种混合物 (学生活动)玻璃生产的原料:石英、纯碱、石灰石 设备:玻璃熔炉(高温熔融) 主要反应: SiO2 + Na2CO3 Na2SiO3 + CO2↑,SiO2 + CaCO3 CaSiO3 + CO2↑. 成份:Na2O·CaO·6SiO2 种类:钢化玻璃、有色玻璃、光学玻璃、防弹玻璃。 分子筛:利用硅酸盐内部结构的空隙,可用于分离、提纯气体或液体混合物;还可以作干燥剂、离子交换剂、催化剂、催化剂载体、净化水、净化空气、防毒器械、食品保鲜、电子产品处理、石油化工等方面。 [拓展视野]几种玻璃的特性和用途 6 种 类 特 性 用 途 普通玻璃 在较高温度下易软化 窗玻璃、玻璃瓶、玻璃杯等 石英玻璃 膨胀系数小,耐酸碱,强度大,滤光 化学仪器;高压水银灯、紫外灯等的灯壳;光导纤维、压电晶体等 光学玻璃 透光性能好,有折光和色散性 眼镜片;照相机、显微镜、望远镜用凹凸透镜等光学仪器 玻璃纤维 耐腐蚀、不怕烧、不导电、不吸水、隔热、吸声、防虫蛀 太空飞行员的衣服、玻璃钢等 钢化玻璃 耐高温、耐腐蚀、强度大、质轻、抗震裂 运动器材;微波通讯器材;汽车、火车窗玻璃等 瓷器: 主要原料 :黏土、石英沙 板书设计: 第一课时 硅酸盐矿物与硅酸盐产品 一、 硅酸盐矿物、硅酸盐产品(传统材料) 1.硅酸盐的结构: (1)硅酸盐的结构复杂,常用氧化物的形式表示比较方便。硅酸盐结构稳定,在自然界中稳定存在。 (2)氧化物形式书写的规律: ①各元素写成相应的氧化物,元素的价态保持不变。 ②顺序按先金属后非金属,金属元素中按金属活动顺序表依次排列,中间用“•”间隔。 ③注意改写后应与原来化学式中的原子个数比不变。 2.Na2SiO3的性质:Na2SiO3易溶于水,水溶液俗称“水玻璃” 化学性质:(1)水溶液呈碱性(用PH试纸测),通CO2有白色沉淀:Na2SiO3 + CO2 +2 H2O == Na2CO3 + H4SiO4↓(原硅酸,白色胶状沉淀),离子方程式:SiO32- + CO2 +2 H2O == CO32- + H4SiO4↓。 原硅酸不稳定,易失水成硅酸:H4SiO4 == H2SiO3 + H2O(硅酸在方程式中可代替原硅酸书写。) 硅酸受热分解:H2SiO3 H2O + SiO2 , 原硅酸和硅酸都是难溶于水的弱酸,酸性:H2CO3强于H4SiO4或H2SiO3。 (2)硅酸钠溶液中滴加稀盐酸有白色沉淀: 6 Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓, 离子方程式:SiO32- + 2H+ == H2SiO3↓. (3)硅酸和氢氧化钠反应:H2SiO3 + 2NaOH == Na2SiO3 + 2H2O. 离子方程式:H2SiO3 + 2OH- ==SiO32- +2H2O 。 3. 硅酸盐产品(传统材料) 水泥 普通玻璃 制玻璃的主要反应: SiO2 + Na2CO3 Na2SiO3 + CO2↑,SiO2 + CaCO3 CaSiO3 + CO2↑. 陶瓷 【随堂练习】 一、选择题 1.下列不属于硅酸盐工业产品的是 ( ) A.水泥 B.陶瓷 C.砖瓦 D.石英玻璃 2.下列物质不属于硅酸盐的是 ( ) A.粘土 B.硅藻土 C.Al2(Si2O5)(OH)4 D.Mg2SiO4 3.生产水泥的主要设备是 ( ) A.熔炉 B.回转窑 C.沸腾炉 D.合成塔 4.某硅酸盐样品中锌的质量分数为58.6%,其化学组成用氧化物形式可表示为nZnO·SiO2,则n值等于 ( ) A.0.5 B.1 C.2 D.3 5.在天然环境中用自然界中的物质,且在常温下必须在空气中才能硬化的是 ( ) A.石灰抹墙后变硬不再溶于水 B.熟石膏调水后灌入模中变硬 C.水玻璃抹在蛋皮上不久变硬呈玻璃状 D.水泥砂浆浇灌后变硬 6.在水泥中加石膏的目的是 ( ) A.调节水泥的机械强度 B.调节水泥的硬化速度 C.降低水泥的成本 D.扩大水泥的使用范围 7.下列物质有固定熔点的是 ( ) A.玻璃 B.水泥 C.水玻璃 D.Na2O·SiO2 8.在实验室熔化NaOH固体,不能选用的坩锅是 ( ) A.铁坩锅 B.瓷坩锅 C.铝坩锅 D.石墨坩锅 二、填空题 9.制造普通水泥的主要原料有 和 .普通水泥的主要成分有(写名称) 、 和 ,它们的化学式分别是 、 和 .水泥的主要性能是 10.工业上制造普通玻璃的主要原料是 、 、 ,主要设备 是 ,主要原料熔化后,发生的主要化学反应是 、 .普通玻璃的成分是 . 三、计算题 11.SiO2和CaCO3的混合物26g,在高温下加热到质量不再改变,冷却后称质量为17.2g. (1)写出可能发生反应的化学方程式; (2)求产生的气体在标准状况时的体积; (3)求原混合物中的SiO2的质量. 6 答案:1.D 2.B 3.B 4.C 5.AC 6.B 7.C 8.BC 9-10 略 11.(1)4.48L(2)6克 6查看更多