- 2021-07-02 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习鲁科版专题二十八化学与技术考点二化学与资源开发学案
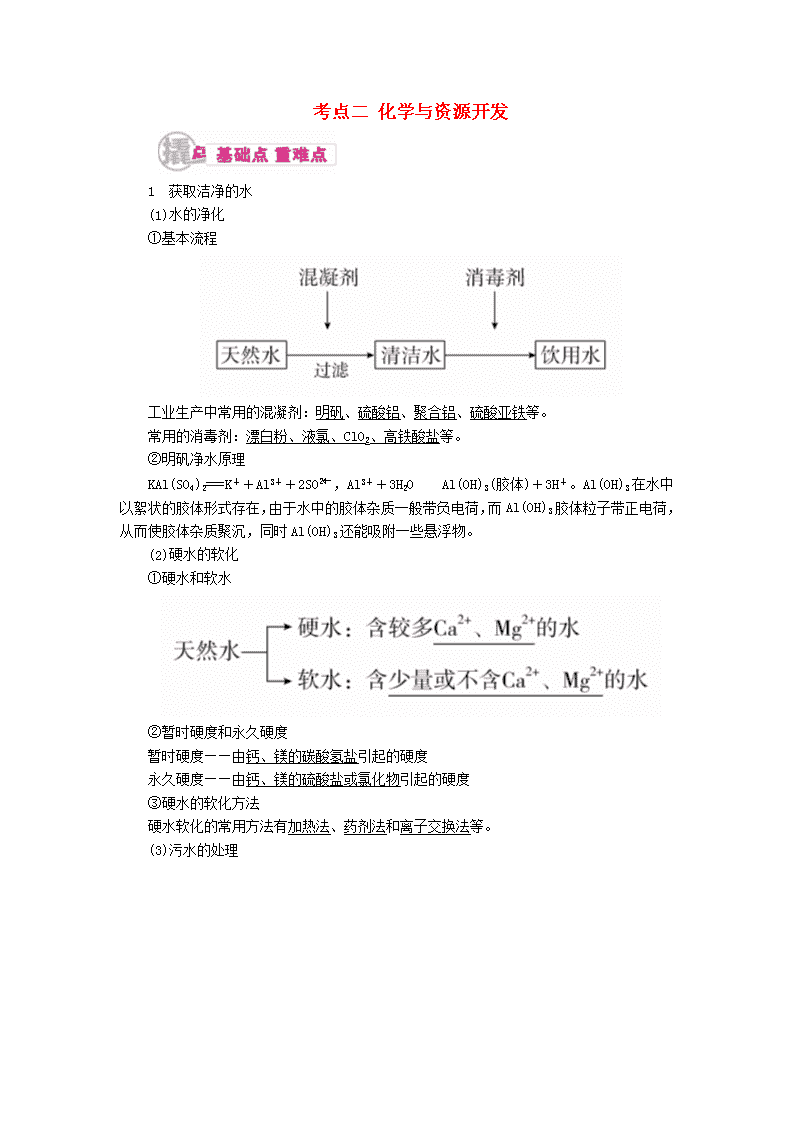
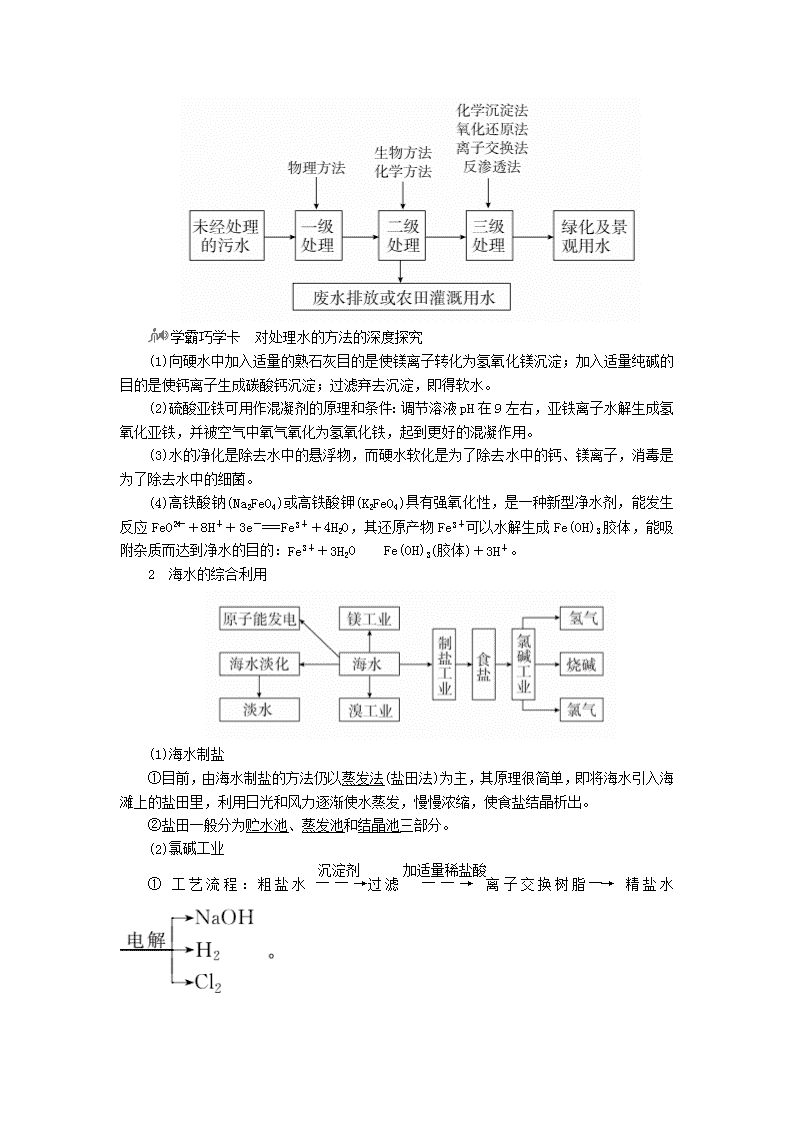
1 获取洁净的水 (1)水的净化 ①基本流程 工业生产中常用的混凝剂:明矾、硫酸铝、聚合铝、硫酸亚铁等。 常用的消毒剂:漂白粉、液氯、ClO2、高铁酸盐等。 ②明矾净水原理 KAl(SO4)2===K++Al3++2SO,Al3++3H2OAl(OH)3(胶体)+3H+。Al(OH)3在水中以絮状的胶体形式存在,由于水中的胶体杂质一般带负电荷,而Al(OH)3胶体粒子带正电荷,从而使胶体杂质聚沉,同时Al(OH)3还能吸附一些悬浮物。 (2)硬水的软化 ①硬水和软水 ②暂时硬度和永久硬度 暂时硬度——由钙、镁的碳酸氢盐引起的硬度 永久硬度——由钙、镁的硫酸盐或氯化物引起的硬度 ③硬水的软化方法 硬水软化的常用方法有加热法、药剂法和离子交换法等。 (3)污水的处理 学霸巧学卡 对处理水的方法的深度探究 (1)向硬水中加入适量的熟石灰目的是使镁离子转化为氢氧化镁沉淀;加入适量纯碱的目的是使钙离子生成碳酸钙沉淀;过滤弃去沉淀,即得软水。 (2)硫酸亚铁可用作混凝剂的原理和条件:调节溶液pH在9左右,亚铁离子水解生成氢氧化亚铁,并被空气中氧气氧化为氢氧化铁,起到更好的混凝作用。 (3)水的净化是除去水中的悬浮物,而硬水软化是为了除去水中的钙、镁离子,消毒是为了除去水中的细菌。 (4)高铁酸钠(Na2FeO4)或高铁酸钾(K2FeO4)具有强氧化性,是一种新型净水剂,能发生反应FeO+8H++3e-===Fe3++4H2O,其还原产物Fe3+可以水解生成Fe(OH)3胶体,能吸附杂质而达到净水的目的:Fe3++3H2OFe(OH)3(胶体)+3H+。 2 海水的综合利用 (1)海水制盐 ①目前,由海水制盐的方法仍以蒸发法(盐田法)为主,其原理很简单,即将海水引入海滩上的盐田里,利用日光和风力逐渐使水蒸发,慢慢浓缩,使食盐结晶析出。 ②盐田一般分为贮水池、蒸发池和结晶池三部分。 (2)氯碱工业 ①工艺流程:粗盐水过滤离子交换树脂―→精盐水 ②反应原理:2NaCl+2H2OH2↑+Cl2↑+2NaOH。 ③产品应用 a.Cl2:有机合成、制农药等; b.NaOH:造纸、制玻璃、肥皂; c.H2:有机合成、金属冶炼。 (3)海水提溴 ①工艺流程 ②反应原理 Cl2+2NaBr===2NaCl+Br2 a.3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑ 5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O b.Br2+SO2+2H2O===2HBr+H2SO4 2HBr+Cl2===Br2+2HCl 学霸巧学卡 海水提溴注意事项 (1)通氯气前要先将海水酸化,使其pH约为3.5,此时氯气的氧化效果最好。 (2)用空气或水蒸气将溴吹出,而不用四氯化碳萃取,原因是后者工艺复杂,设备投资大,经济效益低且对环境污染严重。 (4)海水提镁 3 煤化工和天然气化工的发展——一碳化学 一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4、CH3OH等)为原料,合成一系列化工原料和燃料的化学。 1.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水资源开发利用的部分过程。 下列有关说法正确的是( ) A.用澄清石灰水可鉴别NaHCO3和Na2CO3 B.制取NaHCO3的反应是利用其溶解度小于NaCl的溶解度 C.在步骤③、④、⑤中,溴元素均被氧化 D.工业上通过电解饱和MgCl2溶液制取金属镁 答案 B 解析 A项,Na2CO3、NaHCO3和Ca(OH)2均能发生反应产生白色沉淀,所以用澄清石灰水不可鉴别NaHCO3和Na2CO3,错误;B项,向饱和食盐水中通入NH3和CO2,溶解度较小的NaHCO3会先析出,正确;C项,步骤③中,溴元素化合价从-1升高到0,被氧化,步骤④中,溴元素化合价从0降低到-1,被还原,步骤⑤中,溴元素化合价从-1升高到0,被氧化,错误;D项,工业上通过电解熔融的氯化镁来制取金属镁,电解饱和MgCl2溶液得到的是氢氧化镁,错误。 2.水处理技术在生产、生活中应用广泛。 (1)含有较多________的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为______________________(写出一个即可)。 (2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过________(填“RH”或“ROH”)型离子交换树脂,原因是____________。 (3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为________。电渗析法净化水时,使离子通过半透膜的推动力是______________。 (4)检验蒸馏水的纯度时,最简单易行的方法是测定水的__________________。 答案 (1)Ca2+、Mg2+ Ca2++2HCOCaCO3↓+H2O+CO2↑(或Mg2++2HCOMgCO3↓+H2O+CO2↑) (2)RH 先通过阴离子交换树脂可能产生Mg(OH)2等沉淀而影响树脂交换效果 (3)反渗透法 电势差(或电场力) (4)电导率(或电阻率) 解析 本题主要考查化学技术在水处理方面的应用,离子交换法净水用的RH型阳离子交换树脂可以将水中的阳离子用H+交换出来,ROH型阴离子交换树脂可以将水中的阴离子用OH-交换出来。明白此原理第(2)问即可解答出来。 [考法综述] 化学与资源的综合开发利用是“化学与技术”模块的重要内容,也是绝大多数省份高考选考的组成部分。涉及的内容有化石燃料、海水与矿石等资源的综合利用,在高考试题中常结合工农业生产对资源的开发利用进行综合考查。 命题法1 氯碱工业 典例1 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: 依据上图完成下列问题: (1)在电解过程中,阴极上生成气体的电子式为____________。 (2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为______________________。 (3)精制过程要除去SO,可选择下列溶液中的________(填字母序号)。 a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 (4)在实际生产中也可以用BaCO3除去SO(已知溶解度BaSO4查看更多