- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学理卷·2018届安徽省蚌埠市高二上学期期末考试(2017
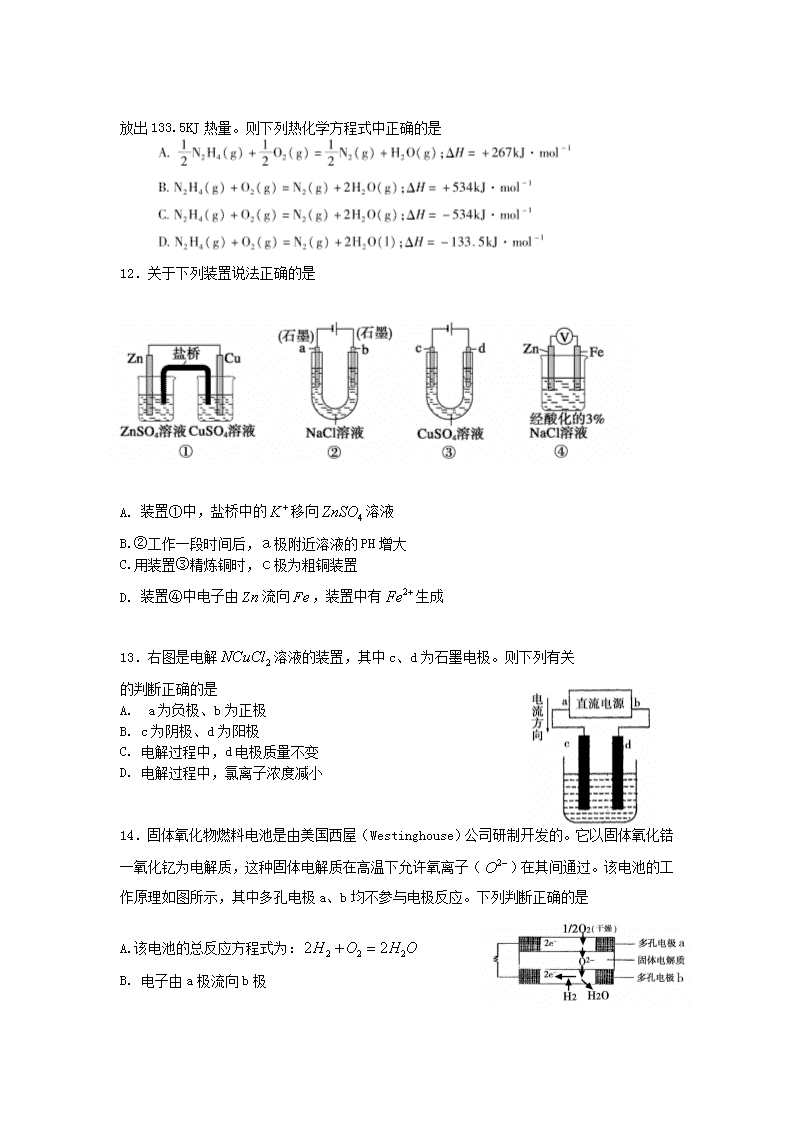
埠市2016—2017学年度第一学期期末学业水平监测 高二化学(理科) 可能用到的相对原子质量:H-1 C-12 O-16 Na-23 N-14 Al-27 S-32 Cu-64 Ag-108 一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个选项符合题意,答案填写在答题卡上) 1.化学与生产、生活密切相关,下列叙述错误的是 A. 用热的纯碱溶液清除灶具上的油污 B. 用作沉淀剂,除去废水中的和 C. 用硫酸清洗锅炉中的水垢 D. 用明矾作净水剂,除去水中悬浮的杂质 2.在蒸发皿中加热蒸干再加热下列物质的溶液,可以得到该物质固体的是 A. B. C. D. 3.下列离子既能电离又能水解,且能与强碱溶液反应的是 A. CH3COO- B. C. D. 4.在加入铝粉能产生H2的溶液中,下列各组离子可能大量共存的是 A. B C. D. 5.下列水解反应离子方程式书写正确的是 A. B. C. D. 6.下列有关实验的说法正确的是 A. 用干燥的PH试纸测定新制氯水的PH B. 中和滴定实验中,洗净后的锥形瓶不需要干燥 C. 用溶液与溶液混合制取 D. 向白色沉淀上滴加溶液,沉淀变为黑色,说明 7.下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是 8.往含和的稀溶液中滴入溶液,沉淀的质量与加入溶液体积的关系如右图所示。则原溶液中c()/c()的比值约为 A. B. C. D. 9.下列溶液一定呈中性的是 A. PH=7的溶 B. 使石蕊试液呈紫色的溶液 C. 的溶液 D. 酸与碱恰好完全反应生成正盐的溶液 10.时,有关水的电离平衡,叙述正确的是 A. 向水中加入稀氨水,平衡逆向移动,降低 B.向水中加入少量固体硫酸氢钠,增大,不变 C. 向水中加入少量冰,平衡逆向移动,降低 D. 将水加热, 增大,PH不变 11.是一种高效清洁的火箭燃料。完全燃烧生成氮气和气态水时, 放出133.5KJ热量。则下列热化学方程式中正确的是 12.关于下列装置说法正确的是 A. 装置①中,盐桥中的移向溶液 B.②工作一段时间后,a极附近溶液的PH增大 C.用装置③精炼铜时,c极为粗铜装置 D. 装置④中电子由流向,装置中有生成 13.右图是电解溶液的装置,其中c、d为石墨电极。则下列有关 的判断正确的是 A. a为负极、b为正极 B. c为阴极、d为阳极 C. 电解过程中,d电极质量不变 D. 电解过程中,氯离子浓度减小 14.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子()在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是 A.该电池的总反应方程式为: B. 电子由a极流向b极 C. a极对应的电极反应式为 D. 有参加反应的a极为电池的阳极 15.反应的,下列说法正确的是 A. 升高温度,正反应速率增加,逆反应速率减小 B.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 C. 升高温度有利于反应速率增加,从而缩短达到平衡的时间 D. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 16.一定条件下,溶液的酸碱性对光催化染料R降解反应的影 响如右图所示。下列判断正确的是 A. 在0-50min之间,PH=2和PH=7时R的降解百分率相等 B 溶液酸性越强,R的降解速率越小 C.R的起始浓度越小,降解速率越大 D. 在20-25min之间,PH=10时R的平均降解速率为 17.可逆反应在一定温度下的密闭容器内达到平衡后,时 改变某一外界条件,化学反应速率-时间图象如下图。下列说法正确的是 A. 若a+b=c,则时只能是增大反应体系的压强 B. 若a+b=c,则时只能是加入催化剂 C. 若,则时只能是加入催化剂 D. 若,则时只能是增大反应体系的压强 18..时,水溶液中与的变化关系如图中曲线 ac所示,下列判断错误的是 A. ac曲线上的任意一点都有×= B. 溶液不可能位于c点 C. d点对应溶液的温度高于,PH<7 D. bd线段上任意一点对应的溶液都呈中性 二、问答题(共46分) 19..(8分)写出下列反应的热化学方程式。 (1),下,硫粉在氧气中充分燃烧放出热量,写出表示硫燃烧热的热化学方程式_________。 (2)用和的混合溶液可溶出印刷电路板金属粉末中的铜。已知: 在 溶液中与 反应生成和的热化学方程式为_________________________________________________。 (3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是__________(填序号) 20.(8分)盐溶液受盐的水解影响,导致性质具有一定的复杂性。在的重铬酸钾溶液中存在如下平衡: (1)重铬酸钾溶液呈____________性,在强碱溶液中,铬元素的主要存在形式为______(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中将_____(填“增大”、“减小”或“不变”)。 (2)向溶液中加入 溶液,发生离子互换反应,生成砖红色沉淀且溶液 PH减小,则生成的砖红色沉淀的化学式为__________________________。 21.(14分) 1.时,下图烧杯中各盛有的溶液。 (1)甲溶液PH=___________ (2)若将甲溶液全部倒入乙中,所得的混合溶液的PH_____________丙溶液的PH(填“>”、“<”或“=”)。 (3)若将乙溶液全部倒入丙中,所得的混合溶液PH>7,所得溶液中离子浓度大小顺序是 __________________________________________________。 Ⅱ.已知:在水中的电离方程式为: (1)常温下,PH=5的溶液中水的电离程度___________PH=9的氨水中水的电离 程度。(填“>”、“=”或“<”) (2)等体积等物质的量浓度的与氨水混合后,溶液呈酸性的原因为___________(用离子方程式表示); 若一定量的溶液与氨水混合后,溶液PH=7,则_____ (填“>”、“=”或“<”不同);常温下用硫酸氢钠与氢氧化钡溶液制取硫酸钡, 若溶液中 完全沉淀,则反应后溶液的pH_________7(填“>”、“=”或“<”) 22..(16分)“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以和为主的合成气,合成气有广泛应用。试回答下列问题: (1)高炉炼铁是气体的重要用途之一,其基本反应为: 。 已知在时,该反应的化学平衡常数。 ①温度升高,平衡移动后达到新平衡,此时平衡常数值_______(填“增大”“减小”“不变”); ②时测得高炉中,,则在这种情 况下,该反应这一时刻向_______进行(填“左”或“右”)。 (2)目前工业上也可用来生产燃料甲醇,有关反应为: ,某温度下, 向体积为1L的密闭容器中,充入和, 反应过程中测得和的浓度随时间的 变化如图所示。 ①反应开始至平衡,氢气的平均反应速率 ___________________________,的转化率为______。 该温度下上述反应的平衡常数K=_______________。 ②反应达到平衡后,下列能使的值增大的措施是_________填符号 a 升高温度 b 再充入 c 再充入 d 将从体系中分离 e.充入 ③新型高效的甲醇燃料电池采用Pt为电极材料,两个电极上分别通入 和, 溶液为电解质,是写出上述电池负极的电极反应式 __________________________________________________________________。 若电池工作一段时间后,消耗标准状况下的氧气,则该过程转移电子____。查看更多