- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习弱电解质的电离作业(全国通用)
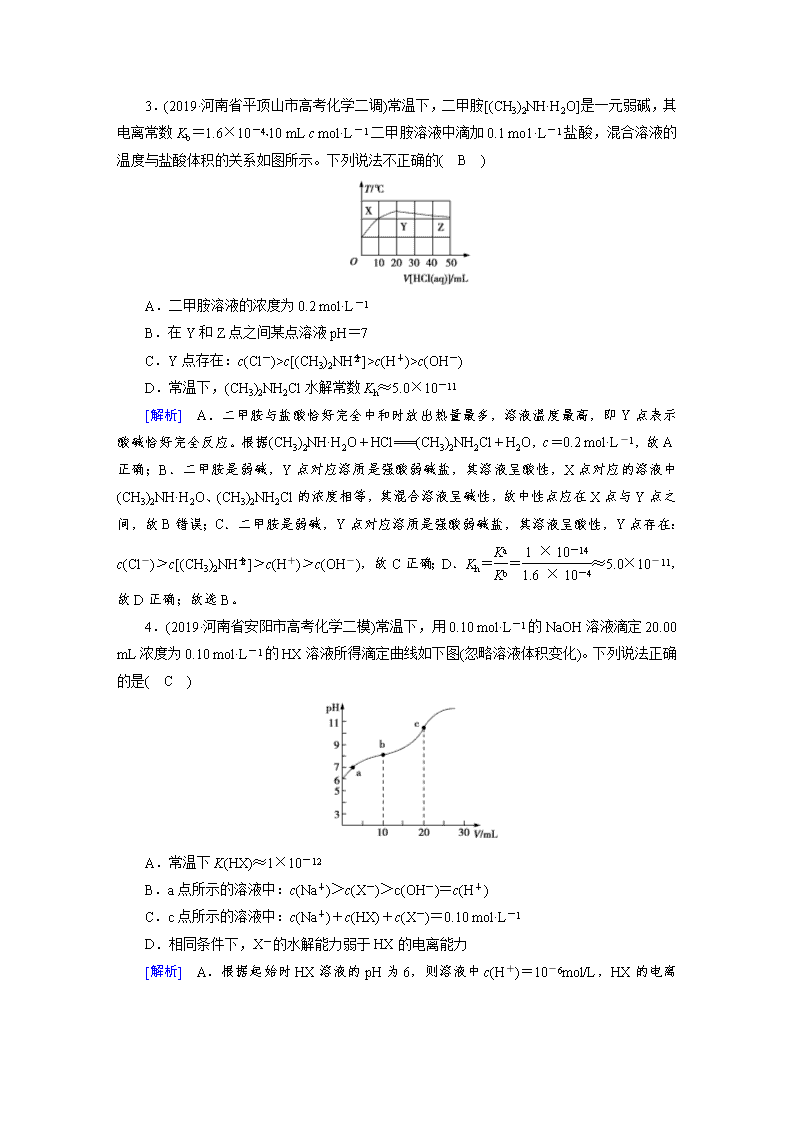
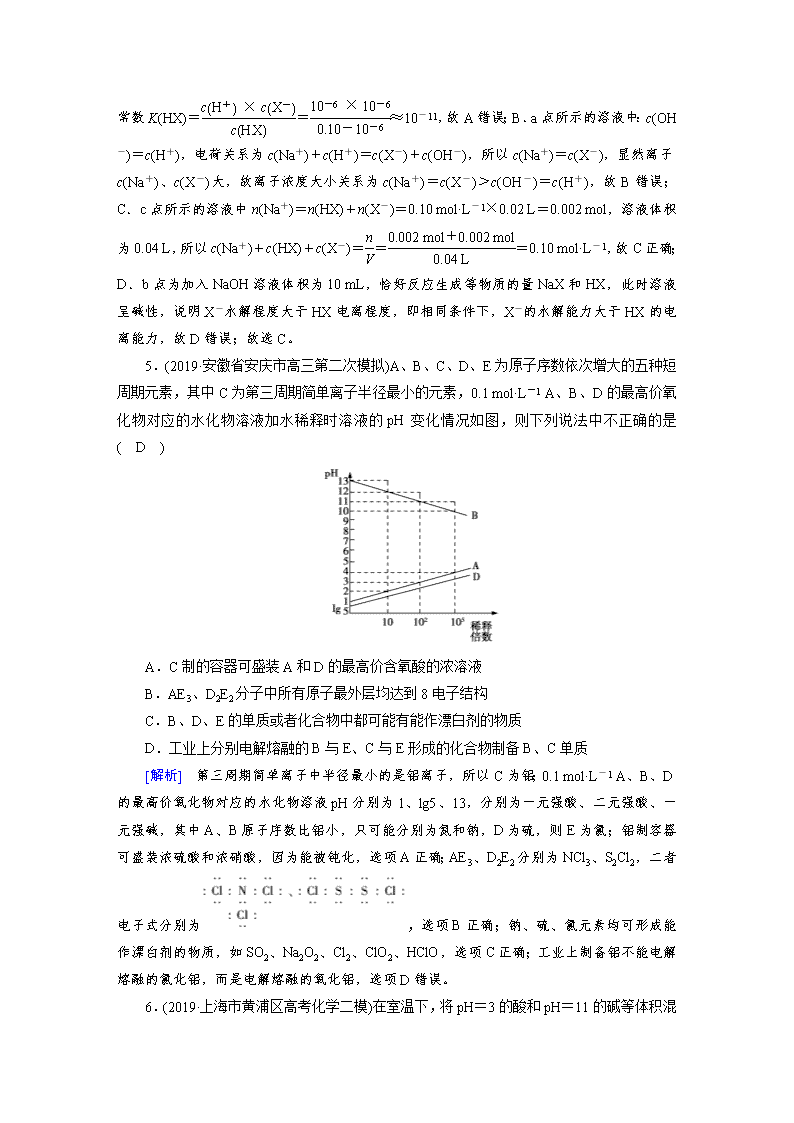
弱电解质的电离 1.(2019·上海市嘉定区高三一模)常温下0.1 mol/L氨水溶液的pH=a,下列能使溶液pH=(a-1)的措施是( B ) A.将溶液稀释到原体积的10倍 B.加入适量的氯化铵固体 C.加入等体积0.1 mol/L烧碱溶液 D.加入等体积0.1 mol/L盐酸 [解析] A.常温下0.1 mol/L氨水的pH=a,将溶液稀释到原体积的10倍,由于溶液中存在NH3·H2ONH+OH-,加水促进电离,所以溶液的pH>(a-1),故A错误; B.加入适量的氯化铵固体,NH3·H2ONH+OH-,平衡向逆方向移动,则OH-的浓度减小,pH减小,所以pH有可能等于(a-1),故B正确; C.0.1 mol/L氨水中加入等体积的0.1 mol/L NaOH溶液,氢氧化钠为强碱完全电离,溶液中OH-的浓度增大,pH增大,故C错误; D.加入等体积0.1 mol/L盐酸,和氨水恰好完全反应,得到的氯化铵溶液显示酸性,故D错误; 故选B。 2.(2019·河南八市重高联盟高三第三次测评)常温下,将pH均为11,体积均为V0的AOH和BOH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示。下列说法不正确的是( D ) A.碱性强弱:AOH>BOH B.水的电离程度:a=b>c C.稀释相同倍数时:c(A+)<c(B+) D.中和盐酸的能力:a=b<c [解析] 由图知当lg =2时,AOH的pH下降了2个单位,故AOH为强碱,同理BOH为弱碱,故A正确;B项水的电离程度受溶液中c(OH-)的影响,溶液中的氢离子为水电离的,所以根据pH的大小分析水电离程度,故a=b>c,B正确;C.起始溶液中两种离子B+和A+的浓度相同,稀释相同倍数时,弱碱BOH电离程度增大,c(B+)>c(A+),C项正确;D.起始弱碱的浓度比强碱浓度大,等体积的两种溶液中和盐酸的能力:b=c>a,D不正确。故选D。 3.(2019·河南省平顶山市高考化学二调)常温下,二甲胺[(CH3)2NH·H2O]是一元弱碱,其电离常数Kb=1.6×10-4,10 mL c mol·L-1二甲胺溶液中滴加0.1 mo1·L-1盐酸,混合溶液的温度与盐酸体积的关系如图所示。下列说法不正确的( B ) A.二甲胺溶液的浓度为0.2 mol·L-1 B.在Y和Z点之间某点溶液pH=7 C.Y点存在:c(Cl-)>c[(CH3)2NH]>c(H+)>c(OH-) D.常温下,(CH3)2NH2Cl水解常数Kh≈5.0×10-11 [解析] A.二甲胺与盐酸恰好完全中和时放出热量最多,溶液温度最高,即Y点表示酸碱恰好完全反应。根据(CH3)2NH·H2O+HCl===(CH3)2NH2Cl+H2O,c=0.2 mol·L-1,故A正确;B.二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,X点对应的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的浓度相等,其混合溶液呈碱性,故中性点应在X点与Y点之间,故B错误;C.二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,Y点存在:c(Cl-)>c[(CH3)2NH]>c(H+)>c(OH-),故C正确;D.Kh==≈5.0×10-11,故D正确;故选B。 4.(2019·河南省安阳市高考化学二模)常温下,用0.10 mol·L-1的NaOH溶液滴定20.00 mL浓度为0.10 mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。下列说法正确的是( C ) A.常温下K(HX)≈1×10-12 B.a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+) C.c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10 mol·L-1 D.相同条件下,X-的水解能力弱于HX的电离能力 [解析] A.根据起始时HX溶液的pH为6,则溶液中c(H+)=10-6mol/L,HX的电离常数K(HX)==≈10-11,故A错误;B.a点所示的溶液中:c(OH-) =c(H+),电荷关系为c(Na+)+c(H+)=c(X-)+c(OH-),所以c(Na+)=c(X-),显然离子c(Na+)、c(X-)大,故离子浓度大小关系为c(Na+)=c(X-)>c(OH-)=c(H+),故B错误;C.c点所示的溶液中n(Na+)=n(HX)+n(X-)=0.10 mol·L-1×0.02 L=0.002 mol,溶液体积为0.04 L,所以c(Na+)+c(HX)+c(X-)===0.10 mol·L-1,故C正确;D.b点为加入NaOH溶液体积为10 mL,恰好反应生成等物质的量NaX和HX,此时溶液呈碱性,说明X-水解程度大于HX电离程度,即相同条件下,X-的水解能力大于HX的电离能力,故D错误;故选C。 5.(2019·安徽省安庆市高三第二次模拟)A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1 mol·L-1 A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是( D ) A.C制的容器可盛装A和D的最高价含氧酸的浓溶液 B.AE3、D2E2分子中所有原子最外层均达到8电子结构 C.B、D、E的单质或者化合物中都可能有能作漂白剂的物质 D.工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质 [解析] 第三周期简单离子中半径最小的是铝离子,所以C为铝;0.1 mol·L-1 A、B、D的最高价氧化物对应的水化物溶液pH分别为1、lg5、13,分别为一元强酸、二元强酸、一元强碱,其中A、B原子序数比铝小,只可能分别为氮和钠,D为硫,则E为氯;铝制容器可盛装浓硫酸和浓硝酸,因为能被钝化,选项A正确;AE3、D2E2分别为NCl3、S2Cl2,二者电子式分别为,选项B正确;钠、硫、氯元素均可形成能作漂白剂的物质,如SO2、Na2O2、Cl2、ClO2、HClO,选项C正确;工业上制备铝不能电解熔融的氯化铝,而是电解熔融的氧化铝,选项D错误。 6.(2019·上海市黄浦区高考化学二模)在室温下,将pH=3的酸和pH=11的碱等体积混合,混合后溶液的pH>7,则该酸和碱的组合可以是( D ) A.醋酸和氢氧化钡 B.硝酸和氢氧化钠 C.硫酸和氢氧化钾 D.盐酸和氨水 [解析] 室温下,将pH=3的酸和pH=11的碱等体积混合,若对应的酸碱均为强电解质,则溶液混合后恰好呈中性;若酸为弱酸、碱为强碱,由于弱电解质部分电离,则弱酸的浓度远远大于10-3mol/L,即弱酸的浓度远远大于碱的浓度,等体积混合时,酸过量,因此溶液显酸;若酸为强酸、碱为弱碱,由于弱电解质部分电离,则弱碱的浓度远远大于10-3mol/L,即弱碱的浓度远远大于酸的浓度,等体积混合时,碱过量,因此溶液显碱性,据此进行解答。A.醋酸为弱酸,氢氧化钡强碱,则弱酸的浓度远远大于10-3mol/L,即弱酸的浓度远远大于碱的浓度,等体积混合时,酸过量,因此溶液显酸性,混合液的pH小于7,故A错误;B.室温下,将pH=3的硝酸和pH=11的氢氧化钠等体积混合,对应的酸碱均为强电解质,则溶液混合后恰好呈中性,溶液的pH=7,故B错误;C.硫酸和氢氧化钾都是强电解质,则混合液中酸碱恰好反应,溶液为中性,溶液的pH=7,故C错误;D.盐酸为强酸,氨水为弱碱,氨水浓度远远大于10-3mol/L,混合液中氨水过量,溶液的pH大于7,故D正确;故选D。 7.(2019·安庆市高三二模)298 K时,用0.1 000 mol/L NaOH溶液滴定20.00 mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=1.0×10-4.0), 下列有关叙述正确的是( D ) A.该滴定过程应该选择甲基橙作为指示剂 B.图中a、b两点氷的电离程度:b>a C.当加入10.00 mL NaOH 溶液时,溶液中:c(HCOO-)>c(H+)>c(Na+)>c(0H-) D.当加入20.00 mL NaOH溶液时,溶液pH>8.0 [解析] 甲酸为弱酸,NaOH溶液滴定甲酸溶液生成强碱弱酸盐,滴定终点溶液呈碱性,为减小滴定误差,在该滴定过程中应该选择酚酞作为指示剂,A项错误;图中a点酸过量,溶液pH为3,b为碱过量,溶液pH为12,两处溶液水的电离都受到抑制,b点c(OH)大于a点c(H+),故水的电离程度:a>b,B项错误;由图象可知,当加入10.00 mL NaOH溶液时,溶液中的溶质为等浓度的HCOOH和HCOONa,且溶液呈酸性,但HCOOH是弱酸,因而溶液中离子浓度大小应为:c(HCOO-)>c(Na+)>c(H+)>c(OH-),C项错误;当加入20.00 mL NaOH溶液时,恰好完全反应生成0.0500 mol/L HCOONa溶液,结合HCOO- 的水解平衡HCOO-+H2OHCOOH+OH-可得出水解平衡常数Kh==1010.0,故可计算出此时溶液中的c(OH-)==×10-6,溶液pH>8,D项正确。 8.(2019·安徽省蚌埠市高考化学二模)常温下在25 mL 0.1 mol·L-1某一元碱中,逐滴加入0.1 mol·L-1醋酸,滴定曲线如图所示。则下列说法不正确的是( D ) A.该碱溶液可以溶解Al(OH)3 B.a点对应的体积值大于25 mL C.C点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.D点时,c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) [解析] A.起始时0.1 mol·L-1一元碱的PH=13,溶液中c(OH-)=0.1 mol/L,说明一元碱为强碱,Al(OH)3为两性氢氧化物,能与强碱反应,故A正确;B.25 mL 0.1 mol·L-1一元强碱和25 mL 0.1 mol·L-1醋酸恰好反应时,溶液呈碱性,a点溶液呈中性,则酸过量,所以醋酸的体积大于25ml,故B正确;C.C点溶液中c(H+)>c(OH-),电荷关系为c(CH3COO-)+c(OH-)=c(H+)+c(Na+),所以离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;D.D点为等量CH3COOH和CH3COONa的混合溶液,物料关系为c(CH3COO-)+c(CH3COOH)=2c(Na+),电荷关系为c(CH3COO-)+c(OH-)=c(H+)+c(Na+),消去c(Na+)有c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故D错误;故选D。 9.(2019·四川省乐山市高考一模)常温下向20 mL 0.10 mol/L CH3COOH溶液中滴加0.10 mol/L NaOH溶液时,混合溶液的pH与相关微粒的浓度关系如图所示。已知:pKa=-lg Ka。下列说法不正确的是( C ) A.CH3COOH溶液中存在如下平衡:CH3COOHH++CH3COO- B.b点,加入NaOH溶液的体积小于20 mL C.将等物质的量的CH3COOH和CH3 COONa一起溶于蒸馏水中,得到对应a点的溶液 D.常温下,CH3COOH的电离常数为Ka,则pKa=4.7 [解析] A.醋酸是弱电解质,在水溶液中存在电离平衡CH3COOHH++CH3COO-,故A正确;B. b点溶液的pH=7,溶液呈中性,醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸应该稍微过量,所以b点,加入NaOH溶液的体积小于20 mL,故B正确;C.lg =0时,c(CH3COOH)=c(CH3COO-),Ka=×c(H+)=10-4.7,其水解平衡常数Kh==10-9.3<Ka,则CH3COOH的电离程度大于CH3COONa的水解程度,则混合溶液中c(CH3COOH)<c(CH3COO-),故C错误;D.lg =0时,c(CH3COOH)=c(CH3COO-),Ka=×c(H+)=10-4.7,pKa=4.7,故D正确;故选C。 10.(2019·福建省漳州市高考化学二模)常温下,用0.01 mol·L-1的NaOH溶液滴定20 mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( C ) A.Ka(HCN)的数量级为10-8 B.点①时,向溶液中滴入几滴1 mol·L-1的HCN溶液,溶液中的值增大 C.点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+) D.在标示的四种情况中,水的电离程度最大的是② [解析] A.由图象可知,①时为HCN溶液,CH+约为10-6 mol/L,Ka(HCN)==,故A错误;B.①时,向溶液中滴入几滴1 mol·L-1的HCN溶液,HCN浓度增大,其电离程度减小,因为浓度增大导致溶液中c(CN-)增大,温度不变电离平衡常数不变,则溶液中==减小,故B错误;C.②点溶液中溶质为等物质的量浓度的NaCN、HCN,溶液pH>7,溶液呈碱性则c(OH-)>c(H+),由此得出NaCN水解程度大于HCN电离程度,所以c(HCN)>c(CN-),根据物料守恒得c(Na+)>c(CN-),所以溶液中存在c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+),故C正确;D.酸或碱抑制水电离,含有弱离子的盐促进水电离,①溶质为HCN、②溶质为等物质的量浓度的HCN和NaCN、③溶质为NaCN、④溶质为等物质的量浓度的NaOH、NaCN,①④抑制水电离且抑制水电离程度①<④,所以水电离程度①>④,②③都促进水电离但水电离程度②<③ ,则水电离程度:③>②>①>④,故D错误;故选C。 11.(2019·陕西省宝鸡高考二模)25 ℃时,改变0.1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( B ) A.图中M、N两点对应溶液中的c(OH-)比较:前者>后者 B.丙酸的电离常数K=10-4.88 C.等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者 D.将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+) [解析] A.图中M、N两点对应溶液中N点的pH大于M点的pH,即cM(H+)>cN(H+),温度一定水的离子积常数一定,则溶液中的c(OH-)比较:前者<后者,故A错误;B.pH=4.88时,溶液中c(H+)=10-4.88mol/L,丙酸分子的分布分数为50%,则c(CH3CH2COOH)=0.05mol/L,所以K===10-4.88,故B正确;C.当pH相同时,酸分子的含量越高,电离平衡常数越小,酸性越弱,根据图象,当pH相同时,丙酸的含量较高,则酸性较弱,丙酸的酸性比甲酸弱,所以等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者<后者,故C错误;D.将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,溶液呈酸性,故c(H+)>c(OH-),故D错误,故选B。 12.(2019·湖南省株洲市高考一模)常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。下列叙述正确的是( D ) A.HA为弱酸,MOH为强碱 B.水的电离程度:X>Y=Z C.若升高温度,Y、Z点对应溶液的pH均减小 D.将Y点与Z点对应溶液以体积比为1∶10混合,所得溶液中:c(M+)>c(A-)>c(OH-)>c(H+) [解析] A.根据图象可知,稀释过程中,HA溶液的体积变化10n倍,溶液的pH变化n个单位,说明HA为强酸;而MOH溶液的体积变化10n倍,溶液的pH变化小于n个单位,说明MOH为弱碱,故A错误; B.X点水电离出的氢离子浓度是10-9 mol/L,Y点水电离出的氢离子浓度是10-10 mol/L,Z点水电离出的氢离子浓度是10-9 mol/L,所以水的电离程度X=Z>Y,故B错误; C.升高温度,水的离子积增大,Y点氢离子浓度基本不变,则其pH不变,故C错误; D.Y点pH=4,氢离子浓度为10-4 mol/L,HA的浓度为10-4 mol/L;Z点pH=9,氢氧根离子浓度为10-5 mol/L,MOH为弱碱,则MOH的浓度大于10-5 mol/L,将Y点与Z点对应溶液以体积比为1∶10混合,由于MOH过量,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(M+)>c(A-),溶液中离子浓度大小为:c(M+)>c(A-)>c(OH-)>c(H+),故D正确; 故选D。 13.(2019·新疆高考化学一诊)已知:pKa=-lg Ka,25 ℃时,H2SO3的pKa1 =1.85,pKa2=7.19。用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法不正确的是( A ) A.a点所得溶液中: 2c(H2SO3)+c(SO)=0.1 mol·L-1 B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO)+c(OH-) C.c点所得溶液中:c(Na+)>3c(HSO) D.d点所得溶液中:c(Na+)>c(SO)>c(HSO) [解析] A.用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,pH=1.85=PKa1,电离平衡常数表达式得到c(H2SO3)=c(HSO),溶液体积大于20 mL,a点所得溶液中:c(H2SO3)-c(SO)+c(HSO)=2c(H2SO3)+c(SO)<0.1 mol·L-1,故A错误;B.b点是用0.1 mol·L-1 NaOH溶液20 mL滴定20 mL 0.1 mol·L-1 H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSO)+c(OH-)+2c(SO),物料守恒c(Na+)=c(HSO)+c(SO)+c(H2SO3),得到:c(H2SO3)+c(H+)-c(SO)=c(OH-),故B正确;C.c点pH=7.19=PKa2 ,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO+H2OHSO+OH-,Kh==,c(OH-)=,带入计算得到:c(HSO)=c(SO),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO)+c(H2SO3)+c(HSO)]=3[c(H2SO3)+2c(HSO)],c(Na+)>3c(HSO),故C正确;D.加入氢氧化钠溶液40 mL,NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液恰好反应生成Na2SO3,d点溶液中主要是Na2SO3和少量NaHSO3,溶液中离子浓度c(Na+)>c(SO)>c(HSO),故D正确;故选A。 14.(2019·昆明市一模)乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。 (1)某同学在做“研究温度对化学反应速率的影响”实验时,他往A、B两支试管中均加入4 mL 0.01 mol·L-1的酸性KMnO4溶液和2 mL 0.1 mol·L-1 H2C2O4(乙二酸)溶液,写出该反应的离子方程式__2MnO+5H2C2O4+6H+===10CO2↑+2Mn2++8H2O__。 (2)实验室有一瓶混有泥沙的乙二酸样品(杂质不与酸性KMnO4溶液反应),利用上述反应的原理来测定其含量,具体操作如下: ①配制250 mL溶液:准确称量5.000 g乙二酸样品,配成250 mL溶液。配制溶液需要的计量仪器有_电子天平、250_mL容量瓶__。 ②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.100 0 mol·L-1 KMnO4标准溶液装入_酸式__(填“酸式”或“碱式”)滴定管,进行滴定操作。在滴定过程中发现,刚滴下少量KMnO4标准溶液时,溶液紫红色并没有马上褪去。将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪去,可能的原因是_反应生成的Mn2+对反应有催化作用__;判断滴定达到终点的现象是_滴入最后一滴溶液,溶液由无色变成浅紫色,且半分钟内不褪色__。 ③计算:重复上述操作两次,记录实验数据如表所示。则消耗KMnO4标准溶液的平均体积为_20.00__mL,此样品的纯度为__90.00%__。 序号 滴定前读数 滴定后读数 1 0.00 20.01 2 1.00 20.99 3 0.00 21.10 [解析] (1)酸性KMnO4溶液能将草酸氧化为CO2,MnO被还原为Mn2+。(2)①准确称量5.000 g样品需要电子天平,配制250 mL的溶液需要250 mL容量瓶。②酸性高锰酸钾溶液有强氧化性,应置于酸式滴定管中。反应一段时间后反应速率加快,可能是反应生成的Mn2+对反应有催化作用。③第三次实验数据的误差太大,应舍去。前两次实验消耗KMnO4标准溶液的平均体积为20.00 mL。25.00 mL所配草酸溶液中,n(H2C2O4)=n(MnO)=2.5×0.100 0 mol·L-1×20.00×10-3 L=0.005 000 mol,则250 mL溶液中含0.050 00 mol草酸,其质量为0.050 00 mol×90 g·mol-1=4.500 g,此样品的纯度为×100%=90.00%。查看更多