- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年湖南省师范大学附属中学高二上学期期末考试化学(理)试题(Word版)
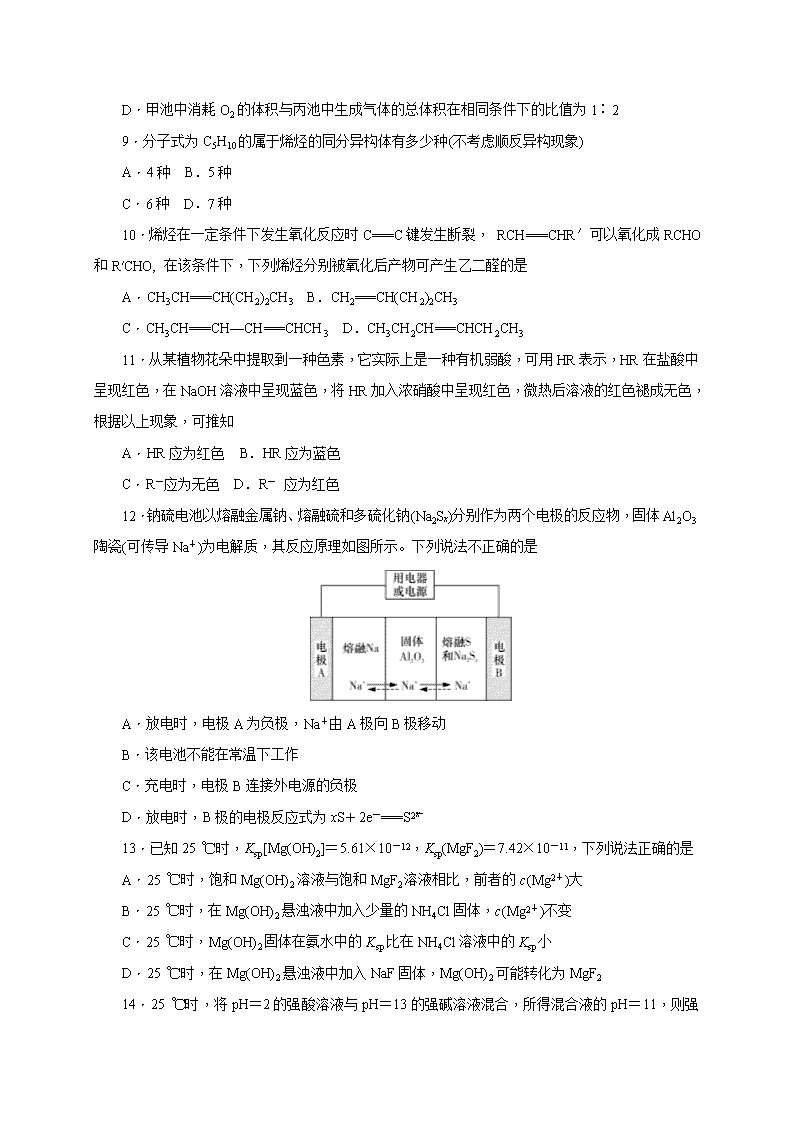
湖南师大附中2017-2018学年度高二第一学期期末考试 化 学(理科) 时量:90分钟 满分:150分 得分:________ 可能用到的相对原子质量:H~1 C~12 O~16 S~32 Cl~35.5 Cu~64 Pb~207 第Ⅰ卷(共100分) 一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意) 1.下列说法正确的是 A.需要加热才能发生的化学反应都是吸热反应 B.应用盖斯定律可以计算某些难以测量的反应焓变 C.任何能使熵值增大的过程都能自发进行 D.化学平衡发生移动,平衡常数一定发生变化 2.乙烷中混有少量乙烯气体,欲除去乙烯并得到纯净干燥的乙烷气体,选用的试剂最好是 A.氢氧化钠溶液,浓硫酸 B.酸性高锰酸钾溶液,浓硫酸 C.溴水,浓硫酸 D.饱和碳酸钠溶液,浓硫酸 3.下列有关石油的炼制工艺中,属于获得汽油的主要途径的是 A.裂化 B.裂解 C.常压分馏 D.减压分馏 4.可逆反应A(s)+B(g)2C(g) ΔH<0,在密闭容器中达到平衡后,改变条件,能使B的转化率提高的是 A.保持温度不变,增大容器体积使压强减小 B.保持恒温恒容,充入氦气 C.其他条件不变时,升高温度 D.保持恒温恒容,加入一定量A物质 5.恒定温度下,反应CO(g)+2H2(g)CH3OH(g)在一个体积可控的密闭容器中进行,达到平衡后,充入一定量H2,并适当增大容器体积使H2的浓度维持不变,则CO的转化率跟原平衡状态相比 A.增大 B.不变 C.减小 D.无法判断 6.下列热化学方程式中,正确的是 A.标准状态下,甲烷的燃烧热为890.3 kJ·mol-1,则该条件下甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 B.500 ℃、30 MPa下,将0.5 mol N2和 1.5 mol H2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,则该条件下上述反应的热化学方程式可表示为: N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1 C.常温下,稀盐酸和稀氢氧化钠溶液混合, 反应的热化学方程式可表示为:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 D.标准状态下,1 mol H2完全燃烧放热 142.9 kJ ,反应的热化学方程式可表示为:2H2(g)+O2(g)===2H2O(l) ΔH=+285.8 kJ·mol-1 7.下列离子在水溶液中能大量共存的是 选项 离子 A K+、SO、Cl-、HS- B Na+ 、Al3+ 、Cl- 、HCO C H+、Ba2+、NO、CH3COO- D Fe2+、Na+、NO、ClO- 8.如图,甲池发生的化学反应为CH4+2O2+2KOH===K2CO3+3H2O,下列说法正确的是 A.甲池是电能转化为化学能的装置,乙、丙两池是化学能转化为电能的装置 B.甲池中正极的电极反应式是O2+4e-+4H+===2H2O C.反应过程中,乙池的pH减小 D.甲池中消耗O2的体积与丙池中生成气体的总体积在相同条件下的比值为1∶2 9.分子式为C5H10的属于烯烃的同分异构体有多少种(不考虑顺反异构现象) A.4种 B.5种 C.6种 D.7种 10.烯烃在一定条件下发生氧化反应时C===C键发生断裂, RCH===CHR′可以氧化成RCHO和R′CHO, 在该条件下,下列烯烃分别被氧化后产物可产生乙二醛的是 A.CH3CH===CH(CH2)2CH3 B.CH2===CH(CH2)2CH3 C.CH3CH===CH—CH===CHCH3 D.CH3CH2CH===CHCH2CH3 11.从某植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸中呈现红色,在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪成无色,根据以上现象,可推知 A.HR应为红色 B.HR应为蓝色 C.R-应为无色 D.R- 应为红色 12.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法不正确的是 A.放电时,电极A为负极,Na+由A极向B极移动 B.该电池不能在常温下工作 C.充电时,电极B连接外电源的负极 D.放电时,B极的电极反应式为xS+2e-===S 13.已知25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11,下列说法正确的是 A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 B.25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体,c(Mg2+)不变 C.25 ℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 D.25 ℃时,在Mg(OH)2悬浊液中加入NaF固体,Mg(OH)2可能转化为MgF2 14.25 ℃时,将pH=2的强酸溶液与pH=13的强碱溶液混合,所得混合液的pH=11, 则强酸溶液与强碱溶液的体积比是(忽略混合后溶液的体积变化) A.11∶1 B.9∶1 C.1∶11 D.1∶9 15.常温下,将乙酸溶液与NaOH溶液混合,所得溶液的pH=7,则此溶液中 A.c(CH3COO-)>c(Na+) B.c(CH3COO-)查看更多