- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河南省周口市扶沟县高级中学高一下学期第一次月考化学试题
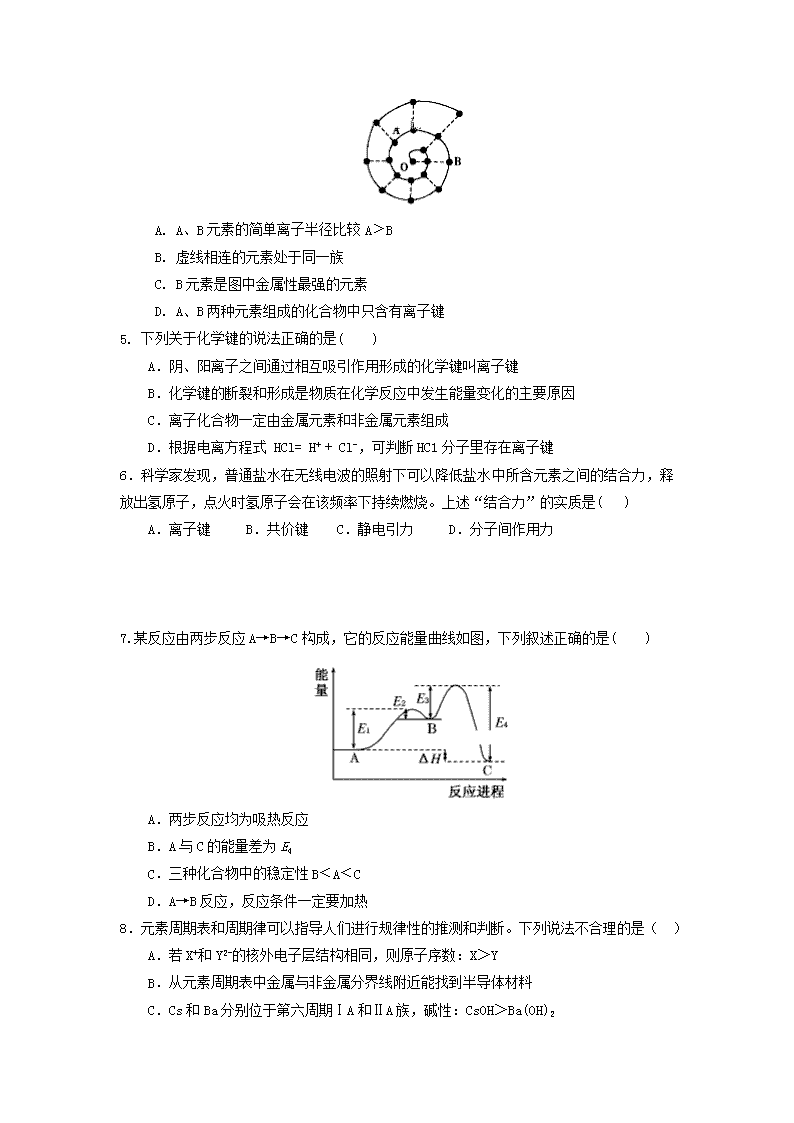
2018-2019学年河南省周口市扶沟县高级中学高一下学期第一次月考化学试题 可能用到的相对原子质量:H-1 N-14 O-16C-12S-32 Ag-108 Al-27 P-31 第Ⅰ卷(选择题 共50分) 一、 选择题(本题包括20小题,1-10每小题2分,11-20每小题3分,共50分。每小题只有一个选项符合题意) 1.物质从宏观方面看是由元素组成的,从微观方面是由粒子构成的。下列有关说法不正确的是( ) A.元素原子的多样性是由构成原子的质子和中子数目引起的 B.元素的化学性质主要取决于元素原子的最外层电子数 C.质子数等于电子数的微粒,可能是一种分子和一种离子 D.只由一种分子构成的物质一定是纯净物 2.钚(Pu)作为热源材料,常用来驱动太空船。下列关于Pu的说法正确的是( ) A.Pu与Pu具有相同的化学性质 B.Pu与Pu互为同素异形体 C. Pu与U互为同位素 D.Pu与U含有的中子数相同 3.下列化学用语正确的是( ) A. HCl的电子式: B. 中子数为20的氯原子:2017Cl C. 18O的原子结构示意图: D. MgCl2的形成: 4.门捷列夫周期表是常见的经典形式,人们在研究前18号元素时发现,还可以将它们排成如图所示的“海螺”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( ) A. A、B元素的简单离子半径比较A﹥B B. 虚线相连的元素处于同一族 C. B元素是图中金属性最强的元素 D. A、B两种元素组成的化合物中只含有离子键 5. 下列关于化学键的说法正确的是( ) A.阴、阳离子之间通过相互吸引作用形成的化学键叫离子键 B.化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 C.离子化合物一定由金属元素和非金属元素组成 D.根据电离方程式 HCl= H+ + Cl-,可判断HC1分子里存在离子键 6.科学家发现,普通盐水在无线电波的照射下可以降低盐水中所含元素之间的结合力,释放出氢原子,点火时氢原子会在该频率下持续燃烧。上述“结合力”的实质是( ) A.离子键 B.共价键 C.静电引力 D.分子间作用力 7.某反应由两步反应A→B→C构成,它的反应能量曲线如图,下列叙述正确的是( ) A.两步反应均为吸热反应 B.A与C的能量差为E4 C.三种化合物中的稳定性B﹤A﹤C D.A→B反应,反应条件一定要加热 8.元素周期表和周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( ) A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y B.从元素周期表中金属与非金属分界线附近能找到半导体材料 C.Cs和Ba分别位于第六周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 D.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S X Y Z W 9. 短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍。下列说法不正确的是( ) A. 原子半径:W>Z>Y>X B. 最高价氧化物对应水化物的酸性:X>W>Z C. 最简单气态氢化物的热稳定性:Y>X>W>Z D. 元素X、Z、W的最高化合价分别与其主族序数相等 10.下列说法正确的是( ) A.氯化铵受热固体消失和干冰升华只需克服分子间作用力 B.NaF、H2SO4中所含化学键类型相同 C.I2、Br2、Cl2、F2熔沸点逐渐降低 D.HCl气体溶于水和NaOH熔化破坏的化学键类型相同 11.可能存在的第119号未知元素,有人称为“类钫”,它位于碱金属族,根据周期表结构及元素性质变化趋势,下列判断错误的是( ) ①锂与水反应比钠剧烈 ②碱金属单质都需要密封保存在煤油中 ③锂的氧化物暴露在空气中易吸收二氧化碳④锂的阳离子的最外层电子数和钠的相同 ⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中是+1价 ⑦“类钫”单质的密度大于1 g·cm-3 ⑧“类钫”的单质有较高的熔点 A.①②④⑧ B.①②③⑦ C.③④⑤⑧ D.①③④⑦ 12.已知aK(n-1)+、bLn+、cWn-、dD(n+1)-具有相同的电子层结构,关于K、L、W、D四种元素的叙述正确的是 ( ) A.气态氢化物的稳定性:D>W B.四种元素一定属于短周期元素 C.最高价氧化物对应水化物的碱性:L>K D.原子序数:L>K>W>D 13.已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为( ) A.B.C.D. 14. 下列叙述正确的是( ) A. F比S的非金属性强,故F的最高价氧化物对应的水化物的酸性大于硫酸 B. 因为H2O比H2S稳定,所以H2O比H2S的沸点要高一些 C. 如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于第ⅢA族或ⅢB族 D. 含有共价键的化合物可能是离子化合物,含有离子键的化合物可能是共价化合物 15.航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生 成N2和水蒸气时放出20.05 kJ热量,化学方程式如下:N2H4+2H2O2===N2↑+4H2O。 下列说法中错误的是( ) A.该反应中肼作还原剂 B.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ C.肼(N2H4)分子中只存在极性共价键 D.该反应的反应物总能量高于生成物的总能量 16. a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子 次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( ) A.4种元素中b的金属性最强 B.c的氧化物对应水化物是强碱 C.原子半径:d>c>b>a D. d单质的氧化性比a单质的氧化性强 17.ICl (氯化碘)化学性质跟氯气相似,常称为类卤素,有关它的说明正确的是( ) A. 与水反应生成HI和HClO B. 分子内部存在的是极性共价键 B. 沸点比I2的高 D. 属于一种单质 18. 已知碳有三种常见的同位素:12C、13C、14C,氧也有三种同位素:16O、17O、18O,由这六种微粒构成的二氧化碳分子最多有 ( ) A.8种 B.12种 C.18种 D.24种 19.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法中正确的是( ) A.CO和O生成了具有共价键的CO2 B.在该过程中,CO断键形成C和O C.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程 D. CO和O生成CO2是吸热反应 20.三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( ) A.该物质中磷元素的化合价为+3 B.该物质22 g含硫原子的数目约为1.806×1023 C.该物质分子结构中S、P最外层电子数均不为8 D.该物质分子中不含非极性共价键 第II卷(50分) 21.(13分) (1)微粒铵根14N2H4+ 中的中子数是_______,核外电子数是_______。 (2)写出N2的电子式________________,CO2的结构式___________________; 用电子式表示H2S的形成过程 ; (3) 已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘反应生成1 mol HI需要_______(填“放出”或“吸收”) __________kJ的热量。 22.(11分) 下表为周期表前20号元素中某些元素的有关数据: 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 原子半径(10-10m) 1.86 1.52 0.66 0.53 0.77 1.10 0.99 2.31 0.70 0.64 最高价态 +1 +1 —— +1 +4 +5 +7 +1 +5 —— 最低价态 —— —— -2 -1 -4 -3 -1 —— -3 -1 试回答下列问题:(用对应的元素符号或物质的化学式表示) (1)写出⑧的原子结构示意图: ; (2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是_____________、__________________; (3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是______________。 (4)以上10种元素的原子中,还原性最强的的是__________(元素符号)。 (5)③、⑦、①、⑩四种元素形成的离子,其半径由小到大的顺序为___________。 23.(12分) 元素X、Y、Z、M、N、O均为短周期主族元素,且原子序数依次增大。已知X常见离子相当于一个裸露的质子,Y元素原子最外层电子数与核外电子总数之比为3∶ 4,N元素原子的最外层电子数与次外层电子数之比为3∶4,Z、M、O位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水. 据此回答下列问题: (1)写出下列元素的符号:X________; Z________;M_________;N___________。 (2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:________________________________________(分解反应)。 (3)X、Z可以形成一种离子化合物,在该化合物中Z为+1价,可以和水反应生成氢气,写出该化合物和水反应的化学方程式:____________________________ ___________。 (4) Z、M两种元素最高价氧化物的水化物之间反应的化学方程式为 ___________________________________________________________________。 (5)下列事实能说明元素O的非金属性比元素N的非金属性强的是____________。 a.元素O形成的单质比元素N形成的单质的熔点低 b.O和N两元素的简单氢化物受热分解,前者的分解温度高 c.O2通入到X2N的溶液中出现浑浊 24.(14分)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。 实验操作步骤: Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞,滴加盐酸。 Ⅱ.A中看到白色沉淀时,…,关闭活塞。 请回答: (1)仪器a的名称:___________________。 (2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。 A.挥发性 B.还原性C.氧化性 D.酸性 (3)C装置的作用是______________,X是____________________(写化学式)。 (4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是_______________,D中反应的化学方程式是__________________________________。 (5)碳、硅的非金属性逐渐减弱的原因是______________(从原子结构角度加以解释)。 2018-2019学年度下期高一第一次质量检测 化学参考答案 一、 选择题:(1—10,每题2分 ;11-20,每题3分) C、 A、C、、D、B; B、C、D、A、C; A、D、B、C、C; A、B、C、A、B 非选择题:(除标注外,每空2分) 21. (1)11; 10 (2) 、 (3) 放出(1分); 5.5 22. (1)(2)CCl4 PCl3 (3) 第三周期第VIA族 (4)K (1分) (5)r(Na+)查看更多
相关文章
- 当前文档收益归属上传用户