- 2021-07-02 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版晶体结构与性质学案(7)
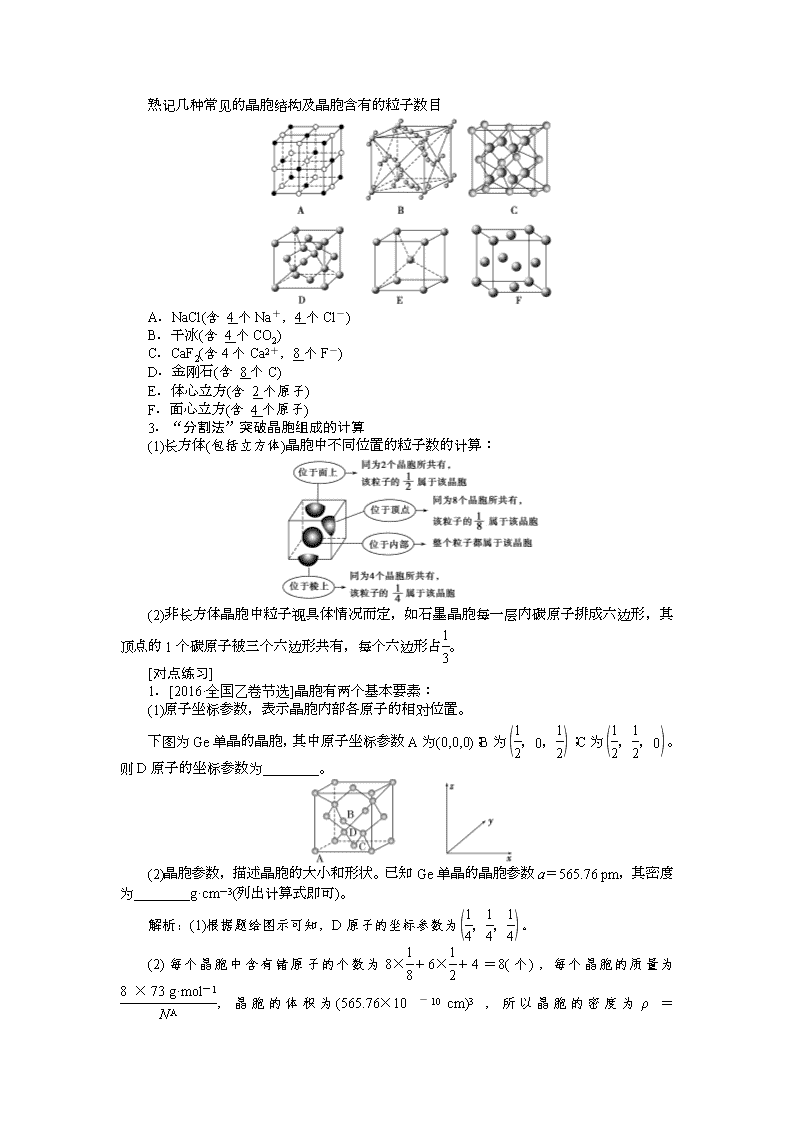
第三节 晶体结构与性质 本节共设计1个学案 [高考导航] 1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。 2.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 3.理解金属键的含义,能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。 4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。 5.能根据晶胞确定晶体的组成并进行相关的计算。 6.了解晶格能的概念及其对离子晶体性质的影响。 1.晶体与非晶体 (1)晶体与非晶体的比较 (2)获得晶体的三条途径 ①熔融态物质凝固。 ②气态物质冷却不经液态直接凝固(凝华)。 ③溶质从溶液中析出。 2.晶胞 (1)概念:晶胞是描述晶体结构的基本单元。 (2)晶体中晶胞的排列——无隙并置 ①无隙:相邻晶胞之间没有任何间隙。 ②并置:所有晶胞平行排列、取向相同。 (3)晶胞中粒子数目的计算——均摊法 晶胞任意位置上的一个原子如果是被n个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是 。 熟记几种常见的晶胞结构及晶胞含有的粒子数目 A.NaCl(含 4个Na+,4个Cl-) B.干冰(含 4个CO2) C.CaF2(含4个Ca2+,8个F-) D.金刚石(含 8个C) E.体心立方(含 2个原子) F.面心立方(含 4个原子) 3.“分割法”突破晶胞组成的计算 (1)长方体(包括立方体)晶胞中不同位置的粒子数的计算: (2)非长方体晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点的1个碳原子被三个六边形共有,每个六边形占。 [对点练习] 1.[2016·全国乙卷节选]晶胞有两个基本要素: (1)原子坐标参数,表示晶胞内部各原子的相对位置。 下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为;C为。则D原子的坐标参数为________。 (2)晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。 解析:(1)根据题给图示可知,D原子的坐标参数为。 (2)每个晶胞中含有锗原子的个数为8×+6×+4=8(个),每个晶胞的质量为,晶胞的体积为(565.76×10-10 cm)3,所以晶胞的密度为ρ=。 答案:(1) (2)×107 2.氧原子和钠原子所形成的一种离子化合物Na2O晶体的晶胞如图所示,则图中黑球代表的离子是________(填离子符号)。 解析:如图所示的Na2O晶胞中,黑球数是8,白球数是8×+6×=4,则黑球代表Na+。 答案:Na+ 二、四类晶体比较 1.四类晶体的比较 分子晶体 原子晶体 金属晶体 离子晶体 构成 粒子 分子 原子 金属阳离子、自由电子 阴、阳 离子 粒子间的相互作用力 范德华力 (某些含氢键) 共价键 金属键 离子键 硬度 较小 很大 有的很大,有的很小 较大 熔、 沸点 较低 很高 有的很高,有的很低 较高 溶解性 相似相溶 难溶于任 何溶剂 常见溶剂 难溶 大多易溶于水等极性溶剂 导电性或传热性 一般不导电, 溶于水后有 的导电 一般不具 有导电性 电和热的 良导体 晶体不导电, 水溶液或熔融 状态下导电 物质类 别及 实例 大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外) 部分非金属单质(如金刚石、硅、晶体硼),部分非金属化合物(如SiC、SiO2) 金属单质与 合金(如 Na、Al、Fe、 青铜) 金属氧化物 (如K2O、 Na2O)、强碱 (如KOH、 NaOH)、绝大 多数盐(如 NaCl) 2.判断晶体类型的5种方法 (1)依据构成晶体的粒子和粒子间的作用力判断 ①离子晶体的构成粒子是阴、阳离子,粒子间的作用力是离子键。 ②原子晶体的构成粒子是原子,粒子间的作用力是共价键。 ③分子晶体的构成粒子是分子,粒子间的作用力为分子间作用力(某些含氢键)。 ④金属晶体的构成粒子是金属阳离子和自由电子,粒子间的作用力是金属键。 (2)依据物质的分类判断 ①金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐是离子晶体。 ②大多数非金属单质(除金刚石、石墨、晶体硅等外)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。 ③常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有SiC、SiO2等。 ④金属单质是金属晶体。 (3)依据晶体的熔点判断 ①离子晶体的熔点较高(有的很低)。 ②原子晶体熔点很高。 ③分子晶体熔点低。 ④金属晶体多数熔点高,但也有少数熔点相当低。 (4)依据导电性判断 ①离子晶体溶于水及熔融状态时能导电。 ②原子晶体一般为非导体。 ③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。 ④金属晶体是电的良导体。 (5)依据硬度和机械性能判断 ①离子晶体硬度较大、硬而脆。 ②原子晶体硬度大。 ③分子晶体硬度小且较脆。 ④金属晶体多数硬度大,但也有较低的(如汞),且具有延展性。 3.离子晶体的晶格能 (1)定义 气态离子形成 1_mol离子晶体释放的能量,通常取正值,单位:kJ·mol-1。 (2)影响因素 ①离子所带电荷数:离子所带电荷数越多,晶格能越大。 ②离子的半径:离子的半径越小,晶格能越大。 (3)与离子晶体性质的关系 晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。 4.晶体熔、沸点高低的比较 (1)不同类型晶体熔、沸点的比较 ①不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。 ②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。 (2)同种类型晶体熔、沸点的比较 ①原子晶体 →→→ 如熔点:金刚石>碳化硅>硅。 ②离子晶体 a.一般规律为离子所带的电荷数越多(主要因素)、离子半径越小,熔、沸点就越高,如熔点:Al2O3>MgO>NaCl>CsCl。 b.衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。 ③分子晶体 a.具有氢键的分子晶体熔、沸点反常的高。如熔、沸点H2O>H2Te>H2Se>H2S。 b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4。 c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如熔、沸点CO>N2。 d.对于有机物的同分异构体,支链越多,熔、沸点越低。 如熔、沸点:CH3—CH2—CH2—CH2—CH3> CH3CHCH3CH2CH3>CCH3CH3CH3。CH3 ④金属晶体 金属原子半径越小,价电子数越多,其金属键越强,金属熔、沸点越高,如熔、沸点:Na<Mg<Al。 5.熟识五类晶体结构模型 [对点练习] 1.有下列八种晶体: A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石 上述晶体中(答案用字母编号表示): (1)属于原子晶体的化合物是__________,直接由原子构成的晶体是____________,直接由原子构成的分子晶体是________。 (2)由极性分子构成的晶体是__________,含有共价键的离子晶体是__________,属于分子晶体的单质是________。 (3)在一定条件下能导电而不发生化学变化的是________;受热熔化后化学键不发生变化的是________,需克服共价键的是________。 解析:在题中属于原子晶体的有金刚石和水晶(由硅原子和氧原子构成);属于分子晶体的有冰醋酸、白磷和晶体氩;属于离子晶体的有MgO(由Mg2+和O2-组成)、NH4Cl(由NH和Cl-组成);而Al属于金属晶体,金属的导电是靠自由电子的移动,并不发生化学变化,但金属熔化时金属键就被破坏。分子晶体的熔化只需要克服分子间作用力,而原子晶体、离子晶体熔化时分别需要克服共价键、离子键。 答案:(1)A A、E、H E (2)B F D、E (3)G B、D、E A、H 2.(2017·大同质检)下列物质的熔、沸点高低顺序正确的是( ) A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CF4 C.MgO>H2O>N2>O2 D.金刚石>生铁>钠>纯铁 解析:选B A项,物质全部为原子晶体,判断其熔、沸点高低可比较其原子半径:Si>C>O,故键长关系为Si—Si>Si—C>Si—O>C—C,键长越长,键能越小,故A项中的熔、沸点顺序错误;B项,为同种类型的分子晶体,可比较其相对分子质量大小,相对分子质量越大,熔、沸点越高;C项,N2与O2为同种类型的分子晶体,O2的熔、沸点比N2高;D项,熔、沸点关系为金刚石>纯铁>生铁>钠,合金的熔、沸点比纯金属低。 3. (1)(2016·全国乙卷节选)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________________________________________________。 GeCl4 GeBr4 GeI4 熔点/℃ -49.5 26 146 沸点/℃ 83.1 186 约400 (2)(2013·重庆高考节选)BN、MgBr2、SiCl4的熔点由高到低的顺序为_____________________。 (3)(2013·浙江高考节选) NaF的熔点________(填“>”“=”或“<”)BF的熔点,其原因是_______________________________________________________________。 解析:(2)BN为原子晶体,MgBr2为离子晶体,SiCl4 为分子晶体,因而熔点:BN>MgBr2>SiCl4。 答案:(1)GeCl4、GeBr4、GeI4熔沸点依次升高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强 (2)BN>MgBr2>SiCl4 (3)> 两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低 4.(2016·全国甲卷节选) 某镍白铜合金的立方晶胞结构如图所示。 (1)晶胞中铜原子与镍原子的数量比为________。 (2)若合金的密度为d g·cm-3,晶胞参数a=________nm。 解析:(1)由晶胞结构图可知,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,根据均摊法,每个晶胞中含有Cu原子的个数为6×=3,含有Ni原子的个数为8×=1,故晶胞中Cu原子与Ni原子的数量比为3∶1。 (2)根据m=ρV可得, 1 mol晶胞的质量为(64×3+59)g=a3×d g·cm-3×NA,则a= cm=×107 nm。 答案:(1)3∶1 (2)×107 [学案验收·块块过] 1.(2017·宁波模拟)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2NF3+3NH4F。上述化学方程式中的5种物质没有涉及的晶体类型为( ) A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体 解析:选C 在反应中NH3、F2、NF3的晶体类型为分子晶体,Cu为金属晶体,NH4F为离子晶体。 2.如表给出几种氧化物的熔沸点: NaCl MgCl2 CaCl2 SiCl4 熔点(℃) 801 712 782 -68 沸点(℃) 1 465 1 418 1 600 57 对此有下列说法,错误的是( ) A.CaCl2是离子晶体 B.SiCl4是分子晶体 C.KCl的熔沸点比NaCl的高 D.MgCl2水溶液不能导电 解析:选D 从表格中的熔沸点可以看出,前三者为离子晶体,后者为分子晶体,由表格中MgCl2和CaCl2的熔沸点比较可知,下一周期元素的离子键较强,熔沸点高,故C项正确。D项MgCl2水溶液能够导电。 3.下列各组物质中,按熔点由低到高的顺序排列正确的是( ) ①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb ④Na、Mg、Al A.①③ B.①④ C.②③ D.②④ 解析:选D ①中Hg在常温下为液态,而I2为固态,故①错误;②中SiO2为原子晶体,其熔点最高,CO是分子晶体,其熔点最低,故②正确;③中Na、K、Rb价电子数相同,其原子半径依次增大,金属键依次减弱,熔点逐渐降低,故③错误;④中Na、Mg、Al价电子数依次增多,原子半径逐渐减小,金属键依次增强,熔点逐渐升高,故④正确。 4.已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法中正确的是( ) A.C3N4是分子晶体 B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长长 C.C3N4晶体中每个碳原子连接4个氮原子,而每个氮原子连接3个碳原子 D.C3N4晶体中微粒间通过分子间作用力相结合 解析:选C 根据C3N4的性质可知其为原子晶体,A项错误;C—N键为极性共价键,由于原子半径r(N)查看更多