- 2021-07-02 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版第3讲物质的组成学案
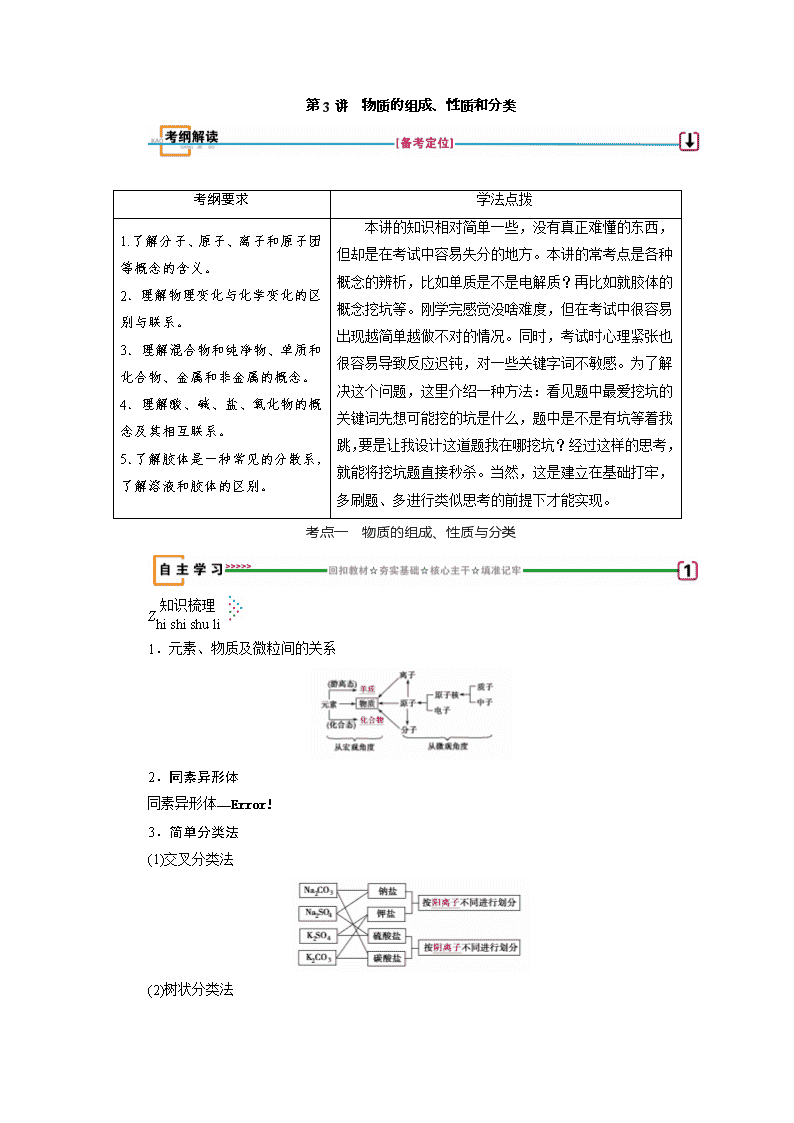
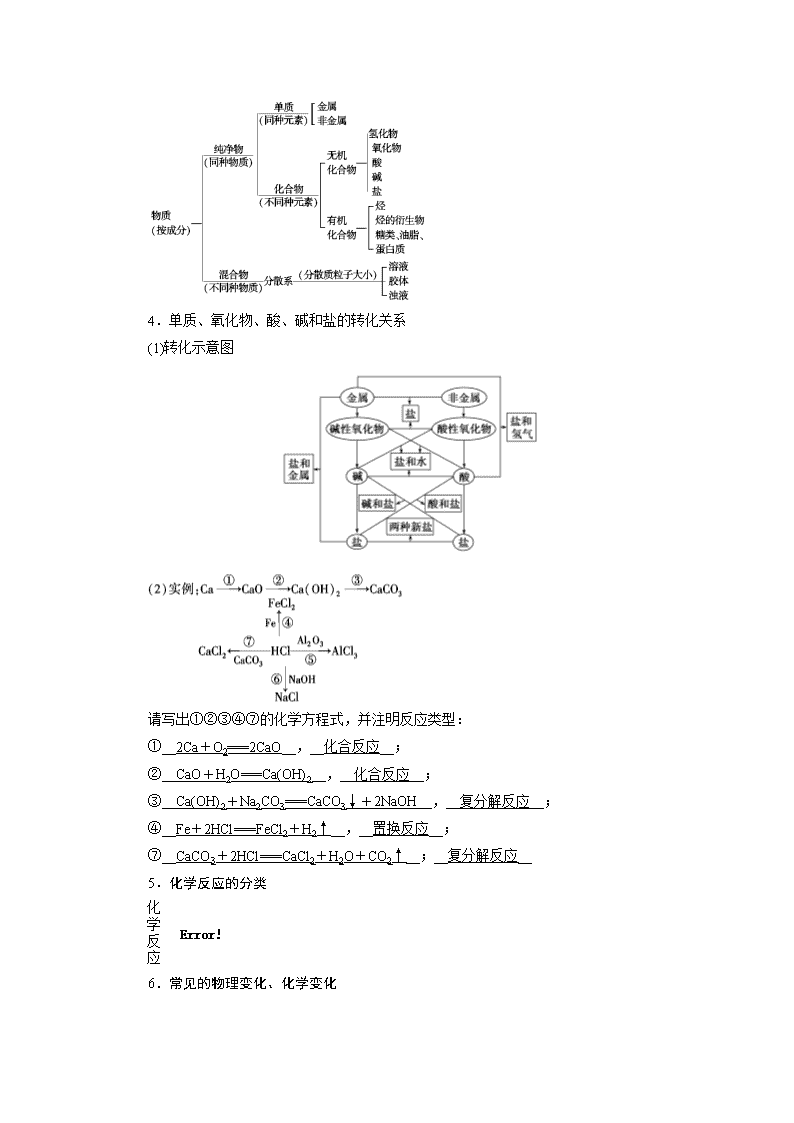
第3讲 物质的组成、性质和分类 考纲要求 学法点拨 1.了解分子、原子、离子和原子团等概念的含义。 2.理解物理变化与化学变化的区别与联系。 3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。 4.理解酸、碱、盐、氧化物的概念及其相互联系。 5.了解胶体是一种常见的分散系,了解溶液和胶体的区别。 本讲的知识相对简单一些,没有真正难懂的东西,但却是在考试中容易失分的地方。本讲的常考点是各种概念的辨析,比如单质是不是电解质?再比如就胶体的概念挖坑等。刚学完感觉没啥难度,但在考试中很容易出现越简单越做不对的情况。同时,考试时心理紧张也很容易导致反应迟钝,对一些关键字词不敏感。为了解决这个问题,这里介绍一种方法:看见题中最爱挖坑的关键词先想可能挖的坑是什么,题中是不是有坑等着我跳,要是让我设计这道题我在哪挖坑?经过这样的思考,就能将挖坑题直接秒杀。当然,这是建立在基础打牢,多刷题、多进行类似思考的前提下才能实现。 考点一 物质的组成、性质与分类 Z 1.元素、物质及微粒间的关系 2.同素异形体 — 3.简单分类法 (1)交叉分类法 (2)树状分类法 4.单质、氧化物、酸、碱和盐的转化关系 (1)转化示意图 请写出①②③④⑦的化学方程式,并注明反应类型: ①__2Ca+O2===2CaO__,__化合反应__; ②__CaO+H2O===Ca(OH)2__,__化合反应__; ③__Ca(OH)2+Na2CO3===CaCO3↓+2NaOH__,__复分解反应__; ④__Fe+2HCl===FeCl2+H2↑__,__置换反应__; ⑦__CaCO3+2HCl===CaCl2+H2O+CO2↑__;__复分解反应__ 5.化学反应的分类 6.常见的物理变化、化学变化 物质变化 物理变化 化学变化 三馏 蒸馏、分馏 干馏 四色 焰色反应 显色反应、颜色反应、指示剂变色反应 五解 潮解 分解、电解、水解、裂解 十八化 熔化、汽化、液化、酸化 氢化、氧化、水化、风化、炭化、钝化、催化、皂化、歧化、卤化、硝化、酯化、裂化、油脂的硬化 X 1.判断正误,正确的画“√”,错误的画“×”。 (1)只含一种元素的物质一定是纯净物,只用同一化学式表示的物质也一定是纯净物( × ) (2)与水反应可生成酸的氧化物都是酸性氧化物( × ) (3)既能与酸反应又能与碱反应的物质是两性氧化物或是两性氢氧化物( × ) (4)非金属氧化物不一定是酸性氧化物,金属氧化物不一定是碱性氧化物( √ ) (5)溶于水呈酸性的物质是酸,呈碱性的物质是碱( × ) (6)HCOOH含有两个氢,所以是二元酸( × ) (7)盐一定由金属离子和酸根离子组成( × ) (8)煤的气化、液化、干馏都是物理变化( × ) (9)臭氧变成氧气是物理变化( × ) (10)将蓝色的硫酸铜晶体放入浓硫酸中属于物理变化( × ) (11)胆矾(CuSO4·5H2O)、明矾[ KAl(SO4)2·12H2O]属于混合物( × ) (12)Cu(OH)2·CuCO3属于碱式盐。( √ ) 2.(2018·山东淄博检测)如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( D ) 选项 W X Y Z A N2 NH3 NO2 HNO3 B Na Na2O2 NaOH NaCl C Fe FeCl3 Fe(OH)2 FeCl2 D Al AlCl3 NaAlO2 Al2(SO4)3 解析:常温下N2不能直接转化为NH3、NO2、HNO3,A项错误;常温下Na与O2反应生成Na2O而不是Na2O2,B错误;常温下Fe不能一步转化为Fe(OH)2,Fe 和氯气在点燃时发生反应生成FeCl3,C项错误;Al与盐酸反应转化为AlCl3,与NaOH溶液反应转化为NaAlO2,与硫酸反应转化为Al2(SO4)3,AlCl3与过量NaOH溶液反应转化为NaAlO2,NaAlO2与过量硫酸反应转化为Al2(SO4)3,Al2(SO4)3与BaCl2溶液反应转化为AlCl3,D项正确。 3.金属和盐反应时是否一定生成金属和盐?请举例说明。 答案:不一定。 如Fe+2FeCl3===3FeCl2、Cu+2FeCl3===CuCl2+2FeCl2。 题组一 物质组成的正确理解 1.(2018·山东济南高三模拟)物质分类的依据通常有组成和性质。下列物质分类中,只考虑组成的是( A ) A.Na2SO4是钠盐、硫酸盐、正盐 B.HNO3是一元酸、强酸、挥发性酸 C.Mg(OH)2是二元碱、难溶性碱、中强碱 D.Al2O3是两性氧化物、金属氧化物、最高价氧化物 2.(2018·山东滨州检测)有资料表明:火星表面富含硫酸盐和硅酸盐。火星上的水可能以冰块和霜冻的形式存在于南北两极,下列说法正确的是 ( B ) A.火星上的水中肯定不含SiO B.水是共价化合物 C.Al2O3·2SiO2·2H2O属于氧化物 D.硅酸钠、硫酸钡和水分别属于强电解质、弱电解质、非电解质 [解析] 大部分硅酸盐难溶于水,但也有一些硅酸盐能溶于水,如Na2SiO3,所以火星上的水中可能存在SiO,A错误;Al2O3·2SiO2·2H2O属于硅酸盐,不属于氧化物,C错误;尽管BaSO4难溶于水,但BaSO4属于强电解质,水属于弱电解质,D错误。 题组二 物质分类的正误判断 3.(2018·江西南昌二模)我国《汉书》中记载:“高奴县有洧水可燃”,沈括在《梦溪笔谈》对洧水的使用有如下描述:“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也”,对上述史实记载分析正确的是( D ) A.该物质可能属于纯净物 B.该物质可能属于无机化合物 C.该物质是由同一类烃组成的混合物 D.烟是该物质不完全燃烧的产物 4.下列分类或归类正确的是( C ) ①液氯、氨水、干冰、碘化银均为纯净物 ②CaCl2、NaOH、HCl、IBr均为化合物 ③明矾、水银、烧碱、硫酸均为强电解质 ④C60、C70、金刚石、石墨均为碳的同素异形体 ⑤碘酒、淀粉、水雾、纳米材料均为胶体 A.①③④ B.②③ C.②④ D.②③④⑤ 萃取精华: (1)物质分类题的解题思路 ①一般采用“概念对比法”或“反例否定法”等。化学基本概念的有关知识比较零碎,容易混淆。 ②要注意关键字的理解和记忆、一般中的特殊情况,这是解这类化学题的关键。 (2)特例反驳法速解分类正误判断型选择题 当碰到一些似是而非且迷惑性极强的选项时,若直接运用有关概念往往难以辨清是非,这时可以借助一些正面特例或反面特例进行反驳,逐一消除干扰选项,从而快速得到正确答案。列举正面特例或反面特例是一种重要的论证方法,这种技巧适用于从正面获取答案有困难的一类化学选择题。 题组三 物质的性质与变化 5.判断下列说法是否正确,正确的画“√”,错误的画“×”。 (1)物质的化学性质一定是由分子保持的。( × ) (2)碘的升华、煤的液化都是物质状态的改变,都属于物理变化。( × ) (3)两种盐反应一定生成两种新盐。( × ) 提示:FeCl3与KI可反应生成I2。 (4)232Th转化成233U是化学变化。( × ) (5)Na2CO3·10H2O的风化属于化学变化,NaOH的潮解属于物理变化。( √ ) (6)电离、电解均有新物质生成,所以它们均是化学变化。( × ) (7)分馏、蒸馏、蒸发、萃取、分液、过滤都属于物理变化( √ ) (8)加热NH4Cl晶体,固体从试管底部跑到上部属于物理变化( × ) 提示:NH4Cl加热时分解成NH3和HCl,遇冷又化合成NH4Cl。 (9)向蛋白质溶液中滴加CuSO4溶液产生沉淀属于化学变化( √ ) 提示:蛋白质遇重金属盐发生变性。 (10)向蛋白质溶液中滴加Na2SO4溶液产生沉淀属于化学变化( × ) 提示:盐析属于物理变化。 (11)紫色石蕊试液中加入活性炭褪色是化学变化( × ) (12)用铂丝蘸取NaCl溶液进行焰色反应是化学变化( × ) 提示:焰色反应属于物理变化。 (13)“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化( √ ) (14)“落汤螃蟹着红袍”肯定发生了化学变化( √ ) (15)纯碱属于盐、甘油属于油脂( × ) 提示:纯碱属于盐,甘油属于醇类物质不属于油脂。 (16)有化学键破坏的变化一定属于化学变化( × ) 提示:NaCl的溶化,虽然破坏化学键但属于物理变化。 (17)发生了颜色变化的一定是化学变化( × ) 提示:活性炭吸附有机色素,属于物理变化。 (18)用糯米、酒曲和水制成甜酒,一定是化学变化( √ ) (19)用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化( √ ) (20)将蓝色的硫酸铜晶体放入浓硫酸属于物理变化( × ) 提示:浓硫酸具有吸水性,使硫酸铜晶体失去结晶水,属于化学变化。 6.(2018·经典习题选萃)现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2、SOCl2等物质,根据它们的组成及性质进行如下分类: 请回答下列问题: (1)图中所示的分类方法叫__树状分类法__。 (2)淡黄色固体最终位于__Ⅰ__组,它的电子式为 __Na+[· ·· ·]2-Na+__。 (3)C组有一种气体常用作工业上冶炼的还原剂,写出高温下该气体还原Fe2O3的化学方程式: __3CO+Fe2O32Fe+3CO2__。 (4)Ⅱ组中的某种常见物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为__2∶1__。 (5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子发生转移,则有__168__g该物质参加反应。 (6)Ⅱ 组中加有一种物质滴入水中后与水剧烈反应,常用于某些盐的脱水以制取无水盐。写出该物质与AlCl3·6H2O反应的化学方程式: __AlCl3·6H2O+6SOCl2===AlCl3+12HCl+6SO2↑__。 [解析] (1)由分类图知,该分类方法为树状分类法,结合相关信息可知分类如下: (2)淡黄色固体是Na2O2,其电子式为Na+[· ·· ·]2-Na+。 (3)CO为还原性气体,在高温下还原Fe2O3,反应的化学方程式为3CO+Fe2O32Fe+3CO2。 (4)3NO2+H2O===2HNO3+NO,NO2发生了自身的氧化还原反应,被氧化和被还原的氮元素的质量比为2∶1。 (5)铁在高温下能够与水蒸气发生反应:3Fe+4H2O(g)Fe3O4+4H2。根据化学方程式可知转移8 mol电子时,有3 mol Fe参加反应,质量为168 g。 (6)SOCl2遇水发生剧烈水解,可以起到脱水的作用,反应的化学方程式为AlCl3·6H2O+6SOCl2===AlCl3+12HCl+6SO2↑。 题组四 单质、氧化物、酸碱盐之间的关系 7.(2018·淄博高三检测)下列说法在一定条件下可以实现的是( A ) ①酸性氧化物与碱发生反应 ②弱酸与盐溶液反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应 ⑥两种氧化物反应的产物有气体 A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥ [解析] ①如CO2+Ca(OH)2=CaCO3↓+H2O,正确。②如H2S+CuSO4=CuS↓+H2SO4,正确。③如:CH3COONa+HCl=NaCl+CH3COOH,正确。④如:2H2S+H2SO3=3S↓+3H2O,正确。⑤同素异形体之间的转化属于非氧化还原反应,如3O22O3,正确。⑥如:3NO2+H2O===2HNO3+NO,正确。故选A。 8.(2018·河北衡水检测)已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图框图进行反应。 回答下列问题: (1)组成单质A、B、C的三种元素中的任意两种元素形成的化合物所属物质类别一定不是__③⑤__(填序号)。 ①氢化物 ②酸 ③碱 ④盐 ⑤氧化物 (2)A、B、C三种单质中有一种是金属,则这种单质是A、B、C中的__A__,理由是__B、C为气体,不可能为金属__。 (3)如果E溶液是一种强酸,则E的化学成为__HCl__,写出E作为还原剂参加反应的常见离子方程式: __MnO2+4H++2Cl-Mn2++2H2O+Cl2↑__。 [解析] 由于“E溶液+A→D溶液+C”,A为固体,C为气体,再结合框图中转化关系可以确定E溶液是一种酸,A是金属,C是H2。继而判断出B是Cl2或F2,A是Al、Mg或Na等金属。(1)两种元素不能形成碱,且A、B、C三种单质的组成元素中没有氧元素,所以形成的化合物不能是氧化物。 (2)A为固体,B和C为气体,金属只能为A。 (3)E是一种强酸,且只含有两种元素,所以E为HCl;HCl作还原剂,最常见的是其与MnO2反应。 萃取精华: 1.物理变化与化学变化的判断方法 从宏观上判断:有新物质生成是化学变化,反之为物理变化。 从微观上判断:有旧化学键断裂,同时有新化学键形成的是 化学变化;有化学键断裂的不一定是化学变化,如NaCl晶体的熔化。 非化学变化 2.常考易错的几个物质的转化 (1)结晶水合物失去结晶水的过程属于化学变化。 (2)浓硫酸的吸水性属于物理性质,脱水性属于化学性质。 (3)煤的干馏、煤的气化以及煤的液化都属于化学变化,石油的分馏属于物理变化,石油的裂化和裂解都属于化学变化。 (4)同素异形体之间的转化属于化学变化。 (5)常见物质间转化的几个误区 ①S燃烧不能直接生成SO3而是生成SO2。 ②Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为 Al(OH)3、H2SiO3、Fe(OH)3。 ③NH3催化氧化不能直接生成NO2。 ④Fe与Cl2反应不能生成FeCl2。 ⑤Fe与H+、Cu2+、S、I2反应不能生成Fe3+。 考点二 分散系 胶体 Z 1.分散系 (1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。 (2)分类 a.把分散系分为溶液、胶体和浊液的标准是分散质__粒子直径大小__。 可用如下方式直观地表示: b.若按分散质、分散剂的状态分类,可分为9种分散系,如图: 如烟属于__气固__分散系;雾属于__气液__分散系;悬浊液属于__液固__分散系;合金属于__固固__分散系。 (3)理清三种分散系的差异 分散系 溶液 胶体 浊液 分散质粒子 单个小分子或离子 高分子或多分子集合体 巨大数目的分子集合体 性质 外观 均一、透明 均一 不均一、不透明 稳定性 稳定 较稳定 不稳定 能否透过滤纸 能 __能__ 不能 能否透过半透膜 能 __不能__ 不能 鉴别 __无__丁达尔效应 __有__丁达尔效应 静置分层或沉淀 2.胶体的性质与应用 3.Fe(OH)3胶体的制备 有关反应的方程式为: __FeCl3+3H2OFe(OH)3(胶体)+3HCl__。 特别提醒: (1)胶体区别于其他分散系的本质特征是胶体粒子的直径在1~100 nm之间,而不是丁达尔效应。 (2)胶体粒子的直径决定了胶体的性质,因胶体粒子较大不能透过半透膜,可用渗析法提纯胶体。 (3)丁达尔效应是物理变化而不是化学变化。 (4)胶体不带电,胶体中的胶粒能够吸附体系中的带电粒子而使胶粒带电荷,但整个分散系仍是电中性的。 (5)Fe(OH)3胶体粒子是“分子”的集合体,因此,1 mol Fe3+完全水解得到Fe(OH)3胶体粒子数小于NA。 X 1.判断正误,正确的画“√”,错误的画“×”。 (1)稀豆浆、硅酸、氯化铁溶液均为胶体( × ) (2)明矾溶于水产生Al(OH)3胶体:Al3++3H2O===Al(OH)3↓+3H+( × ) (3)丁达尔效应是胶体与溶液的本质区别( × ) (4)含0.1 mol FeCl3的饱和溶液配制成胶体后,将得到胶体粒子0.1 mol( × ) (5)FeCl3溶液和Fe(OH)3胶体都呈红褐色( × ) (6)可用过滤的方法将胶体粒子与分散剂分开( × ) (7)沸水中滴加少量饱和FeCl3溶液形成带电的胶体,导电能力增强( × ) (8)通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体( × ) 提示:稀豆浆属于胶体。 (9)明矾净水时发生了化学及物理变化,能起到杀菌、消毒作用( × ) 提示:明矾净水只是把浑水变为清水,无杀菌消毒的作用,错误。 (10)按照分散质和分散剂所处的状态,可分为9种分散系( √ ) 2.下列叙述中不正确的是__③⑥__。 ①使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血,与胶体的性质有关 ②利用丁达尔效应可以区别溶液与胶体 ③电泳现象可证明胶体带电 ④用过滤的方法不能分离胶体与溶液 ⑤有色玻璃属于胶体 ⑥在饱和氯化铁溶液中逐滴加入NaOH溶液,生成Fe(OH)3胶体 ⑦清晨,在茂密的树林中,常常可以看到从树叶间透过的一道道光柱,与胶体的性质有关 ⑧热电厂用高压电除去黑烟中的炭粒,使黑烟变成白烟,减少污染,利用了胶体的性质 ⑨明矾净水是利用胶体的吸附性 解析:①利用了胶体的聚沉;③胶体不带电,是胶粒带电,错误;④胶体粒子和溶液中的溶质均能透过滤纸;⑤有色玻璃是固溶胶(将固体作为分散剂所形成的溶胶),属于胶体;⑥制取的是Fe(OH)3沉淀,错误;⑧利用了胶粒带电、能产生电泳现象的性质。⑨明矾净水是利用Al3+水解生成的Al(OH)3胶体的吸附性。 题组一 分散系类型的判断与比较 1.(2018·天津高三检测)下列液体中,不会出现丁达尔效应的分散系是( D ) ①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液 ⑤Fe(OH)3溶胶 ⑥肥皂水 A.①③ B.⑤⑥ C.② D.④ [解析] ②中水属于纯净物,不属于分散系;④中物质属于溶液,剩余物质均属于胶体。 2.(2018·山东淄博高三检测)关于胶体和溶液的区别,下列叙述错误的是( D ) A.FeCl3溶液与Fe(OH)3胶体的外观都是澄清、透明、均匀的 B.溶液中溶质粒子能通过半透膜,胶体中分散质粒子不能通过半透膜 C.光束通过淀粉溶液时,可以看到一条光亮的“通路”,光束通过蔗糖溶液时,则无此现象 D.溶液最稳定,放置后不会生成沉淀;胶体很不稳定,放置后很快生成沉淀 [解析] A项,FeCl3溶液与Fe(OH)3胶体均为澄清、透明、均匀的分散系;B项,半透膜允许溶液中溶质粒子通过,不允许胶体中分散质粒子通过;C项,蔗糖溶液不具有丁达尔效应,而淀粉溶液具有丁达尔效应;D项,溶液最稳定,胶体属于介稳体系,在一定条件下,能长时间稳定存在。 萃取精华: 分散系认识的2个易错点 (1)丁达尔效应是胶体特有的,溶液和浊液没有。 (2)三种分散系的本质区别是分散质微粒直径大小。 题组二 胶体的性质及应用 3.(2018·河北衡水高三检测)将饱和FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐色液体,此液体不具有的性质是( C ) A.光束通过该液体时形成光亮的“通路” B.插入石墨电极通直流电后,有一极附近液体颜色加深 C.向该液体中加入硝酸银溶液,无沉淀产生 D.向该液体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 [解析] FeCl3溶液滴入到沸水中可得到Fe(OH)3胶体,光线通过胶体时会形成光亮的通路,即产生了丁达尔效应、故A正确;Fe(OH)3胶体粒子吸附正电荷,通入直流电后,在阴极附近液体颜色加深,故B正确;该液体中还含有Cl-,会产生AgCl沉淀,结合Fe(OH)3胶体中加入电解质溶液,会发生聚沉现象,故C错误;在Fe(OH)3胶体中滴入稀硫酸,先发生聚沉,再发生Fe(OH)3与H+的反应而溶解,故D正确。 4.(2018·广东高三检测)近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚,杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,但在198 ℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有( B ) ①胶体的吸附 ②盐类水解 ③焰色反应 ④氧化还原反应 A.①②③④ B.①②④ C.②③④ D.①③④ [解析] K2FeO4具有强氧化性,能杀菌消毒。FeO的还原产物是Fe3+,Fe3+水解生成Fe(OH)3胶体,胶体具有很强的吸附性,故能起到净化水的作用。因此,K2FeO4在水处理过程中涉及了①②④的变化过程。 5.(2017·梅州模拟)下列说法不正确的是( C ) A.利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液 B.将饱的FeCl3溶液滴入沸水中,继续煮沸至溶液呈红褪色即生成氢氧化铁胶体 C.用过滤法可以除去Fe(OH)3胶体中的FeCl3 D.向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质 [解析] 蛋白质溶液为胶体分散系,则用丁达尔效应可区分蛋白质溶液与葡萄糖溶液,A正确;氢氧化铁胶体的制备是将饱和FeCl3溶液滴入沸水中,继续煮沸至溶液呈红褐色即可,B正确;胶体与溶液均可透过滤纸,则用过滤法无法除去Fe(OH)3胶体中的FeCl3,C错误;向豆浆中加入硫酸钙制豆腐,发生胶体聚沉,利用了胶体的聚沉性质,D正确。 萃取精华: 胶体净水的原理 (1)胶体粒子的直径一般在1~100 nm之间,它决定了胶体粒子具有较大的表面积,吸附力很强,能在水中吸附悬浮固体或毒素形成沉淀,从而达到净化水的目的,这就是胶体净水的原理。 (2)常用的净水剂:KAl(SO4)2·12H2O、FeCl3·6H2O等,其净水原理是Al3+、Fe3+分别水解成Al(OH)3、Fe(OH)3胶体,从而起到净水的作用。 要点速记 1.一个范围:胶体分散质粒子直径在1~100 nm。 2.二种分类方法:交叉分类法和树状分类法。分类的关键是明确分类标准。 3.三种分散系及本质区别:溶液、浊液和胶体,本质区别是分散质粒子直径的大小。 4.胶体的三性质、聚沉三方法:丁达尔效应、聚沉和电泳;加入电解质溶液、加热或搅拌、与胶粒带相反电荷的胶体混合。 5.八种常见胶体:雾、蛋白质溶液、淀粉溶液、牛奶、豆浆、墨水、Fe(OH)3胶体、Al(OH)3胶体。 6.一个易错问题:胶体是电中性的,但胶体粒子因吸附作用可能带有电荷。查看更多