2019届一轮复习人教版元素周期表、元素周期律学案
2019年全国卷高考化学总复习《元素周期表、元素周期律》专题突破
[题型分析]高考考纲要求“根据图表、数据等所给背景材料,分析有关现象的变化规律”,此类型的考题常受命题者的青睐。解这类试题的关键是:通过观察、比较图表中数据的变化趋势,总结出有关规律,再运用于解题过程中。围绕元素周期表设计的图表数据型信息题不仅是一类情景新颖的能力型考题,也往往是各级考试中的“保留节目”。该类题的特点是:给出一个复杂实验的现象与数据图表,要求演绎其隐匿的化学规律。其解题思路是:依据图表给出的信息结合教材基本概念与基础知识的相应知识来确定。对于信息题,尤其是好像没有见过的新题不要紧张,往往是信息新,所涉及到的知识却比较简单,属于有一定的区分度,但是并没有多大难度,起点好像很高,但落点却非常低,实质上属于比较简单的必得分的题目。通过以上分析我们预测,2017年高考中这类试题的考查方向为:化学用语的运用;原子结构与元素的性质;元素周期表的结构推导元素,然后运用元素周期律进行解题;与元素及化合物知识、化学反应原理的综合应用。
这部分试题以元素周期表、元素周期律为基础,对物质的性质进行综合推断和应用,一般有入下考查方向。
(1)从元素周期表的结构对元素进行推断
(2)以元素周期律为基础,对物质的性质进行分析和应用
(3)“位—构—性”的综合应用
(4)元素及化合物知识与基本原理的综合应用
【例题演练】
☆★考点一:元素周期表的结构
1、元素原子序数的确定
(1)依据主族元素在周期表中的位置
对于主族元素,电子层数=周期数,最外层电子数=主族序数,所以知道元素在周期表中的位置,即能画出其原子结构示意图,从而确定其原子序数。如某元素的位置为第四周期第ⅦA族,其原子结构示意图为 ,则原子序数Z为35。
(2)利用同主族相邻两元素原子序数的关系
①元素周期表中左侧元素(ⅠA、ⅡA族):同主族相邻两元素中,Z(下)=Z(上)+上一周期元素所在周期的元素种类数目。
②元素周期表中右侧元素(ⅢA~ⅦA族):同主族相邻两元素中,Z(下)=Z(上)+下一周期元素所在周期的元素种类数目。
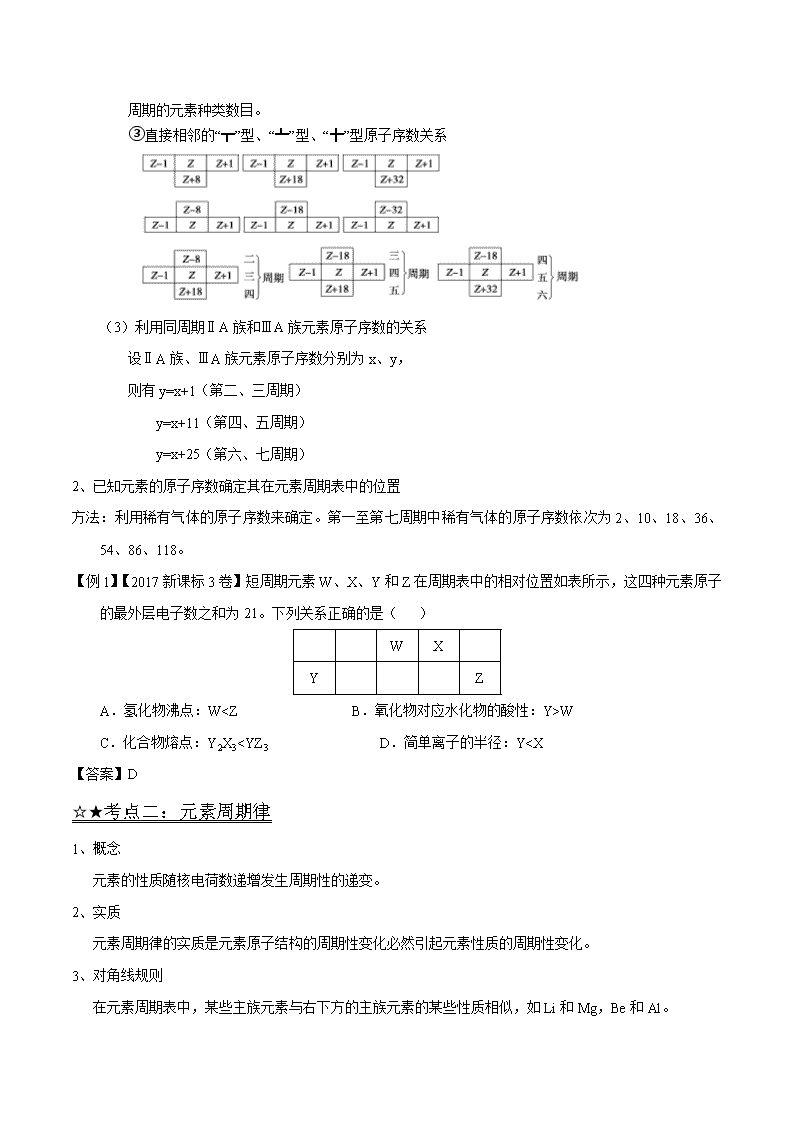
③直接相邻的“┳”型、“┻”型、“╋”型原子序数关系
(3)利用同周期ⅡA族和ⅢA族元素原子序数的关系
设ⅡA族、ⅢA族元素原子序数分别为x、y,
则有y=x+1(第二、三周期)
y=x+11(第四、五周期)
y=x+25(第六、七周期)
2、已知元素的原子序数确定其在元素周期表中的位置
方法:利用稀有气体的原子序数来确定。第一至第七周期中稀有气体的原子序数依次为2、10、18、36、54、86、118。
【例1】【2017新课标3卷】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W
X
Y
Z
A.氢化物沸点:W
W
C.化合物熔点:Y2X3B,N>O,
Mg>Al,P>S)
逐渐减小
电负性
逐渐增大
逐渐减小
5、电离能
(1)第一电离能:气态电中性基态原子 失去一个电子 转化为气态基态正离子所需要的最低能量。
(2)元素第一电离能的意义:元素的第一电离能可以衡量元素的原子失去一个电子的难易程度。
第一电离能数值越小,原子越易失去一个电子,该元素的金属性越强;反之,第一电离能数值越大,原子越难失去一个电子。
(3)变化规律:
①同一周期从左到右元素的第一电离能呈增大的趋势,但某些地方出现曲折变化,如Be >B,N >O, Mg > Al,P >S。
②同一族从上到下元素的第一电离能变小。
6.电负性
(1)键合电子:原子中用于形成 化学键 的电子。
(2)电负性:用来描述不同元素的原子对键合电子吸引力的大小。
(3)意义:电负性越大的原子,对键合电子的吸引力越大,非金属性越强。故电负性的大小可用来衡量元素非金属性和金属性的大小。
(4)变化规律
①同周期从左到右元素的电负性逐渐增大。
②同主族从上到下元素的电负性逐渐变小。
(5)应用
①判断元素的金属性和非金属性的强弱:非金属的电负性>1.8;金属的电负性<1.8;类金属的电负性在1.8左右,它们既有金属性又有非金属性。
②判断化学键的类型:元素的电负性差值大于1.7,它们之间通常形成离子键;元素的电负性差值小于1.7,它们之间通常形成共价键。
【例2】a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
【答案】A
☆★考点三:“位—构—性”综合应用
“位”、“构”、“性”三者的关系可表示如下
(1)原子结构与元素在周期表中的位置关系
①主族元素的最高正化合价=主族序数=最外层电子数。主族元素的最低负化合价=最高正化合价-8。
②核外电子层数=周期数。
③质子数=原子序数=原子核外电子数=核电荷数。
④最外层电子数等于或大于3而小于8的一定是主族元素。
⑤最外层有1个或2个电子,则可能是第ⅠA、第ⅡA族元素,也可能是副族、第Ⅷ族或0族元素氦。
(2)性质与位置互推是解题的关键
熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:
①元素的金属性、非金属性。
②气态氢化物的稳定性。
③最高价氧化物对应水化物的酸碱性。
(3)结构和性质的互推是解题的要素
①电子层数和最外层电子数决定元素原子的氧化性和还原性。
②同主族元素最外层电子数相同,性质相似。
③正确推断原子半径和离子半径的大小及结构特点。
④判断元素金属性和非金属性的方法。
【例3】【2017江苏卷】短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是( )
A.原子半径:r(X) < r(Y) < r(Z) < r(W)
B.W的最高价氧化物的水化物是一种弱碱 [来源:学*科*网]
C.Y的单质的氧化性比Z的强
D.X、Y、Z 三种元素可以组成共价化合物和离子化合物
【答案】D
☆★考点四:晶体的结构与性质
【例4】BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2( )
A.熔融态不导电 B.水溶液呈中性
C.熔点比BeBr2高 D.不与氢氧化钠溶液反应
【答案】A
【真题回访】
1.【2017新课标1卷】
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
【答案】C
2.【2017天津卷】根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
【答案】C
3.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2 倍,X、Y的核电荷数之比为3:4。W−的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X<Y,Z>W
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
【答案】D
4.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:W< XZ
【答案】B
5.甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙和庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
【答案】BC
6.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子充数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A.原子半径:XZ
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
【答案】C
7.短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
X
Y
Z
W
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
【答案】A
8.下列有关性质的比较,不能用元素周期律解释的是( )
A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3
【答案】D
9.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
A.单质氧化性的强弱 B.单质沸点的高低
C.单质与氢气化合的难易 D.最高价氧化物对应的水化物酸性的强弱
【答案】B
10.W、X、Y、Z均为短周期元素,W原子中只有质子,没有中子;X原子最外层电子数与次外层电子数相等,但与内层电子数不相等;Y元素原子在短周期主族元素中原子半径最大,Z元素单质是空气的主要成分之一,且Z元素单质与Y元素单质在不同条件下可生成两种不同原子个数比的物质。下列说法正确的是( )
A.W元素无同位素 B.X单质分子中含共价键
C.离子半径:Y+r(X)>r(Z), 三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
A.X元素位于ⅥA族 B.A难溶于B中
C.A和C不可能发生氧化还原反应 D.B的沸点高于C的沸点
【答案】C
12.【虎林市2017届摸底考试(最后冲刺)】已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族, B、C、D.E同周期,B的核外电子数为C的1/2,D的最外层电子数为C、E之和的一半。 下列说法正确的是( )
A.A、B能形成离子化合物,且A离子半径小于B离子半径
B.A、D能形成离子化合物DA5,与水反应可产生两种气体
C.C、D的简单氢化物中只有D溶于水,其水溶液呈酸性
D.E形成的两种氢化物中所有化学键种类完全相同
【答案】B
13.短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol•L-1 t溶液与0.1 mol•L-1 u溶液的pH 均为1。下列说法不正确的是( )
A.Y、W的最高价氧化物对应的水化物均为强酸
B.元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为
【答案】D
14.【沈阳市2017届第三次模拟】下图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主旅元家下列说法中正确的是( )
A.W的原子序数不可能是X的原子序数的3倍
B.Z元素可能为金属
C.四种元素的原子有可能均能与氢原子形成18电子分子
D.W的气态氢化物的稳定性一定比Y的强
【答案】C
15.X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见气体甲。X、Y、Z 三种元素形成化合物乙。下列说法错误的是( )
A.化合物乙中一定只有共价键
B.气体甲可与Z的某种氢化物反应生成强酸
C.W元素的某种单质可在电子工业用于生产半导体材料
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM
【答案】A
16.下表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素。下列说法正确的是( )
[来源:]
X
Y
Z
R
W
A.五种元素的原子最外层电子数一定都大于2[来源:]
B.X、Z原子序数可能相差18[来源:]
C.Z可能是氯元素
D.Z的氧化物与X单质不可能发生置换反应
【答案】A
17.被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:WZ
D.XR2、WR2两种化合物中R的化合价相同
【答案】D
18
.短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构。下列说法正确的是( )
A.单质的沸点:Y>Z
B.X、Y、Z三种元素不可能形成离子化合物
C.X的最高价氧化物对应的水化物的酸性比W的强
D.Y分别与Z、W形成的化合物中化学键类型不相同
【答案】D
19.短周期元素X、Y、Z,其中X、Z同主族,Y、Z同周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的2倍。下列说法错误的是( )
A.Y位于第3周期 B.含X、Z的酸不只一种
C.原子半径:Y > Z D.气态氢化物稳定性:Z > X
【答案】D
20.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE有相同类型的化学键
【答案】BC
21.在短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.四种元素均可与氢元素形成18电子分子
B.X、Y、Z、W形成的单质最多有6种
C.四种元素中,Z的最高价氧化物对应水化物酸性最强
D.四种元素的原子半径:rZ>rX>rY>rW
【答案】A
22.X、Y、Z、W、R属于短周期主族元素。X的原子半径短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2︰1。 下列叙述错误的是( )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。
【答案】A