- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省武汉市钢城第四中学2019-2020学年高一下学期期中考试化学试题
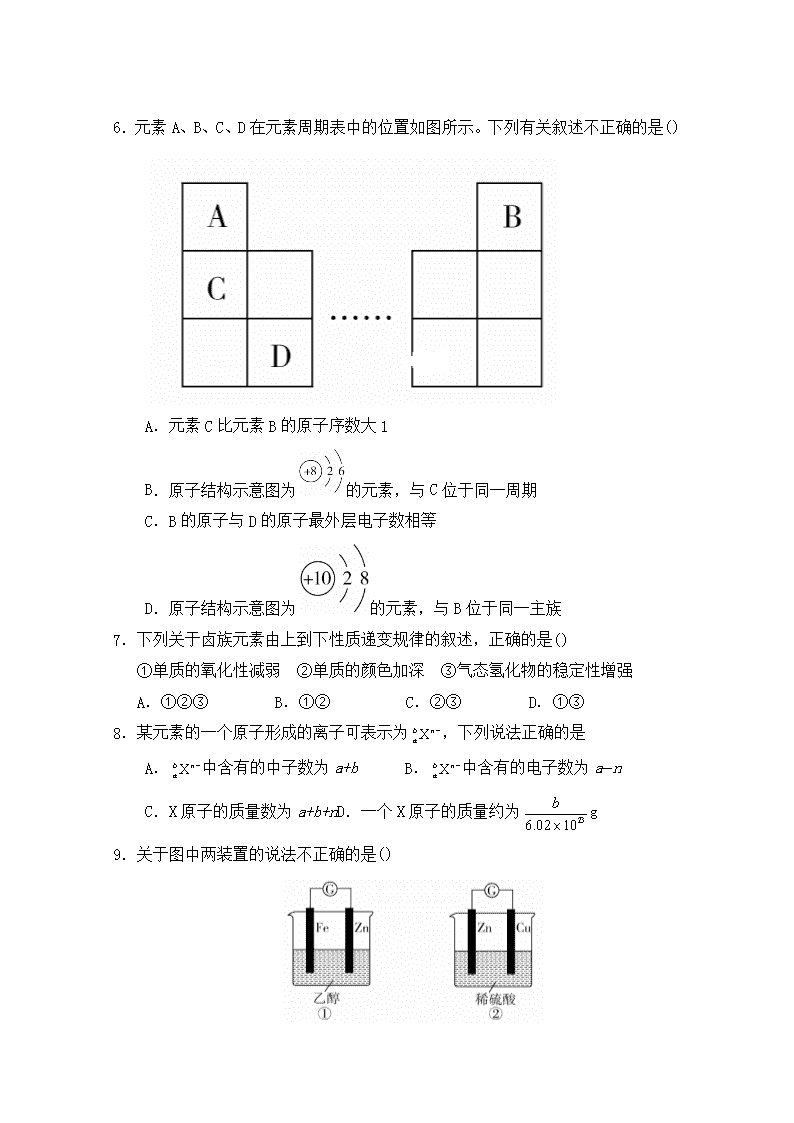
钢城第四中学2019-2020学年高一下学期期中考试 化学试卷 考试时长:75分钟,满分100分 一、选择题(每题3分,共54分) 1.废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是 A.把锌皮取下洗净用于实验室制取氢气 B.碳棒取出洗净用作电极 C.把铜帽取下洗净回收利用 D.电池内部填有NH4Cl等化学物质,将废电池中的黑色糊状物作化肥施用 2.下列有关两种微粒和的叙述正确的是 A.一定都是由质子、中子、电子组成的 B.化学性质几乎完全相同 C.核电荷数和核外电子数一定相等 D.质子数一定相同,质量数和中子数一定不相同 3.把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示。在下列因素中,能影响此反应速率的因素是() ①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度 A.①④ B.仅②③ C.①②③ D.③④ 4.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素位于() A.ⅠB B.ⅣA C. ⅢA或ⅢB D.ⅠA 5.CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( ) A.CO全部转化为乙醇 B.反应体系中乙醇的物质的量浓度不再变化 C.正反应和逆反应的化学反应速率均为零 D.CO和H2以1:2的物质的量之比反应生成乙醇 6.元素A、B、C、D在元素周期表中的位置如图所示。下列有关叙述不正确的是() A.元素C比元素B的原子序数大1 B.原子结构示意图为的元素,与C位于同一周期 C.B的原子与D的原子最外层电子数相等 D.原子结构示意图为的元素,与B位于同一主族 7.下列关于卤族元素由上到下性质递变规律的叙述,正确的是() ①单质的氧化性减弱 ②单质的颜色加深 ③气态氢化物的稳定性增强 A.①②③ B.①② C.②③ D.①③ 8.某元素的一个原子形成的离子可表示为,下列说法正确的是 A.中含有的中子数为a+b B.中含有的电子数为a−n C.X原子的质量数为a+b+nD.一个X原子的质量约为g 9.关于图中两装置的说法不正确的是() A.①②装置都能将化学能转化为电能 B.②中的SO向负极移动 C.②中的电子由Zn经导线流向Cu D.②中电流的方向是由正极经导线流向负极 10.已知某反应aA(g)+bB(g)2C(g)的各物质浓度数据如下,据此可推算出上述方程式中A、B、C三种物质的化学计量数之比是 A B C 起始浓度(mol/L) 3.0 1.0 0 2 s末浓度(mol/L) 1.8 0.6 0.8 A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1 11.锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池, 某种锂离子电池的总反应为Li+MnO2LiMnO2,下列说法中正确的是 A.Li是正极,电极反应式为Li−e−Li+ B.Li是负极,电极反应式为Li−e−Li+ C.MnO2是负极,电极反应式为MnO2+e−MnO2− D.Li是负极,电极反应式为Li−2e−Li2+ 12.(2019·辽宁省实验中学东戴河分校高一月考)在“固体干冰→液体二氧化碳→气体二氧化碳→气体一氧化碳”的变化过程中,被破坏的作用力依次是 A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键 C.范德华力、共价键、共价键 D.共价键、共价键、共价键 13.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是 A.a和b不连接时,铁片上会有金属铜析出 B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu C.无论a和b是否连接,铁片均会溶解 D.a和b用导线连接时,硫酸根离子向铜电极移动 14. 短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是 A. 元素非金属性:Z> Y > X B. 最高价氧化物水化物酸性:Z > Y C.气态氢化物的稳定性:Z < Y < X D. 原子半径:Z < Y < X 15.在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是 A.x=1 B.B的转化率为20% C.平衡时A的浓度为1.50 mol·L-1 D.B的平均反应速率为0.2 mol·L-1·s-1 16.已知四种金属A、B、C、D,根据下列事实:①A+B2+===A2++B;②D+2H2O===D(OH)2+H2↑;③以B、C为电极与C的盐溶液组成原电池,电极反应为C2++2e-===C,B-2e-===B2+,由此可知A2+、B2+、D2+、C2+的氧化性强弱关系是() A.D2+>A2+>B2+>C2+ B.A2+>B2+>D2+>C2+ C.D2+>C2+>A2+>B2+ D.C2+>B2+>A2+>D2+ 17.氨基甲酸铵分解反应为NH2COONH4(s) 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是() A.密闭容器中氨气的体积分数不变 B.1 mol NH2COONH4分解同时有17 g NH3消耗 C.密闭容器中混合气体的密度不变 D.混合气体的平均分子量不变 18.某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构): 下列说法不正确的是 A.HAP能提高HCHO与O2的反应速率 B.HCHO在反应过程中,有C-H键发生断裂 C.根据图示信息,CO2分子中的氧原子全部来自O2 D.该反应可表示为:HCHO+O2CO2+H2O 二、非选择题 19.(每空2分共18分)某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下: 编号 电极材料 电解质溶液 电流计指针偏转方向 1 Mg、Al 稀盐酸 偏向Al 2 Al、Cu 稀盐酸 偏向Cu 3 Al、C(石墨) 稀盐酸 偏向石墨 4 Mg、Al 氢氧化钠溶液 偏向Mg 5 Al、Zn 浓硝酸 偏向Al 试根据表中的实验现象回答下列问题: (1)实验1、2中Al所作的电极(正极或负极)是否相同______(填“相同”或“不相同”)。 (2)根据实验3完成下列填空: ①铝为________极,电极反应式:_____________________。 ②石墨为________极,电极反应式:__________________。 ③电池总反应式:_______________________________________。 (3)实验4中铝作负极还是正极?________,理由是_____________ __。 (4)解释实验5中电流计指针偏向铝的原因: ____________________________________________________________________。 20.(每空2分,共16分)Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下: MnO2 触摸试管情况 观察结果 反应完成所需的时间 粉末状 很烫 剧烈反应,带火星的木条复燃 3.5 min 块状 微热 反应较慢,火星红亮但木条未复燃 30 min (1)写出上述实验中发生反应的化学方程式:_______________________________。 (2)实验结果表明,催化剂的催化效果与________有关。 (3)某同学在10 mL H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是______。 Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。 (4)该反应的的化学方程式为________________。 (5)反应开始至2分钟时,B的平均反应速率为____。 (6)下列措施能使该反应加快的是__(仅改变一个条件)。 a.降低温度 b.缩小容积 c.使用效率更高更合适的催化剂 (7)能说明该反应已达到平衡状态的是___________(填序号)。 ①单位时间内生成n mol B的同时生成2n mol C ②单位时间内生成n mol B的同时生成2n mol A ③容器内压强不再随时间而发生变化的状态 ④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ⑤混合气体的颜色不再改变的状态 ⑥混合气体的密度不再改变的状态 ⑦v逆(A)=v正(C) (8)由图求得平衡时A的转化率为__________。 21.(每空2分,共12分)现有部分短周期元素的性质或原子结构如表: 元素编号 元素的性质或原子结构 X 最外层电子数是次外层电子数的3倍 Y 常温下单质是双原子分子,其氢化物的水溶液显碱性 Z 第三周期元素的简单离子中半径最小 (1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是________,元素Z的离子结构示意图为________。 (2)元素Y与氢元素形成一种离子YH,请写出该离子电子式 ____ ___________。 (3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: ___________________________________。 (4)元素X与元素Y相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。 a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2 b.X的单质比Y的单质更容易与H2化合 c.X与Y形成的化合物中Y元素呈正价态 期中考试答案 选择题(每空3分,共54分) DDCCB DBDAB BBDCB DCC 19(每空2分共18分) 【答案】(1)不相同 (2)①负2Al-6e-===2Al3+②正6H++6e-===3H2↑③2Al+6HCl===2AlCl3+3H2↑ (3)负极铝可与氢氧化钠溶液发生氧化还原反应,而镁不与氢氧化钠溶液发生反应 (4)铝在浓硝酸中被钝化,锌在浓硝酸中被氧化,即在浓硝酸中Zn作原电池的负极,Al作原电池的正极,所以电流计指针偏向铝 20.(每空2分共16分) 【答案】Ⅰ. (1)2H2O2 2H2O + O2↑ (2)催化剂的颗粒大小 (3)C Ⅱ.(4)2A + B2C (5)0.1mol·(L·min)−1 (6)bc (7)①③⑤⑦ (8)40% 21 (每空2分共12分) 【答案】(1)O3 (2)略 (3)Al(OH)3+OH-===AlO+2H2O (4)Oabc查看更多