广东省揭阳市揭西县2020届高三下学期综合测试(六)化学试题
高三化学综合训练6
7.2019年起全国地级及以上城市全面启动生活垃圾分类工作。城市垃圾分类是在源头将垃圾分类投放、清运、回收,使之重新变成资源。以下说法正确的是
A.废旧玻璃属于可回收垃圾,其主要成分为新型无机非金属材料
B.废旧电池属于有害垃圾,因含有重金属,故采用深挖填埋的方式进行处理
C.食品包装塑料袋属于其他垃圾,其主要成分聚氯乙烯为有机高分子化合物
D.茶叶果皮属于厨余垃圾,可通过转化变为有机氮肥
8.设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L二氯甲烷中含有的原子数目为0.5NA
B.常温常压下,46 g C2H6O中含C-H键的数目一定为5NA
C.25℃时,1.0 L pH=12的Na2CO3溶液中由水电离出的OH-的数目为0.01NA
D.1.0 L 0.5 mol·L-1 FeBr2溶液与1 mol Cl2反应时转移的电子数目为2NA
9.人们将连有四个不同基团的碳原子形象地称为手性碳原子。曙红可用作指示剂及染料,其结构简式如图所示。下列有关曙红的说法正确的是
A.曙红不能与盐酸发生反应
B.1个曙红分子中含1个手性碳原子
C.1 mol曙红最多能与3 mol NaOH反应
D.曙红能发生取代、加成、消去反应
10.某研究性学习小组为制备并探究SO2的还原性,设计的 装置如图所示,下列有关叙述不正确的是
A.制备SO2的反应中,氧化剂与还原剂物质的量比为2,1
B.可用稀盐酸酸化的BaCl2溶液验证装置II中是否发生了反应
C.能证明I-的还原性弱于SO2的现象是装置III中溶液蓝色褪去
D.装置Ⅳ的作用是吸收SO2气体,防止污染空气
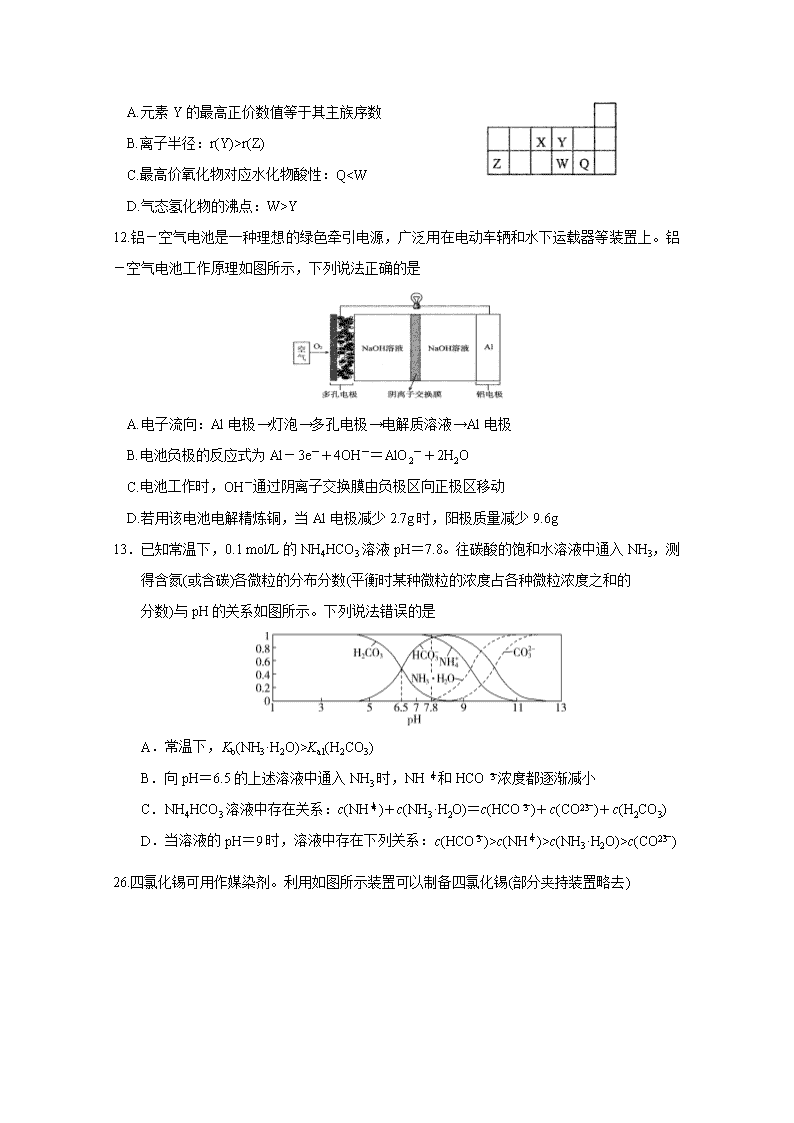
11.短周期主族元素X、Y、Z、W、Q在周期表中的位置如图所示,下列说法正确的是
A.元素Y的最高正价数值等于其主族序数
B.离子半径:r(Y)>r(Z)
C.最高价氧化物对应水化物酸性:Q
Y
12.铝-空气电池是一种理想的绿色牵引电源,广泛用在电动车辆和水下运载器等装置上。铝-空气电池工作原理如图所示,下列说法正确的是
A.电子流向:Al电极→灯泡→多孔电极→电解质溶液→Al电极
B.电池负极的反应式为Al-3e-+4OH-=AlO2-+2H2O
C.电池工作时,OH-通过阴离子交换膜由负极区向正极区移动
D.若用该电池电解精炼铜,当Al电极减少2.7g时,阳极质量减少9.6g
13.已知常温下,0.1 mol/L的NH4HCO3溶液pH=7.8。往碳酸的饱和水溶液中通入NH3,测得含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的
分数)与pH的关系如图所示。下列说法错误的是
A.常温下,Kb(NH3·H2O)>Ka1(H2CO3)
B.向pH=6.5的上述溶液中通入NH3时,NH和HCO浓度都逐渐减小
C.NH4HCO3溶液中存在关系:c(NH)+c(NH3·H2O)=c(HCO)+c(CO)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO)>c(NH)>c(NH3·H2O)>c(CO)
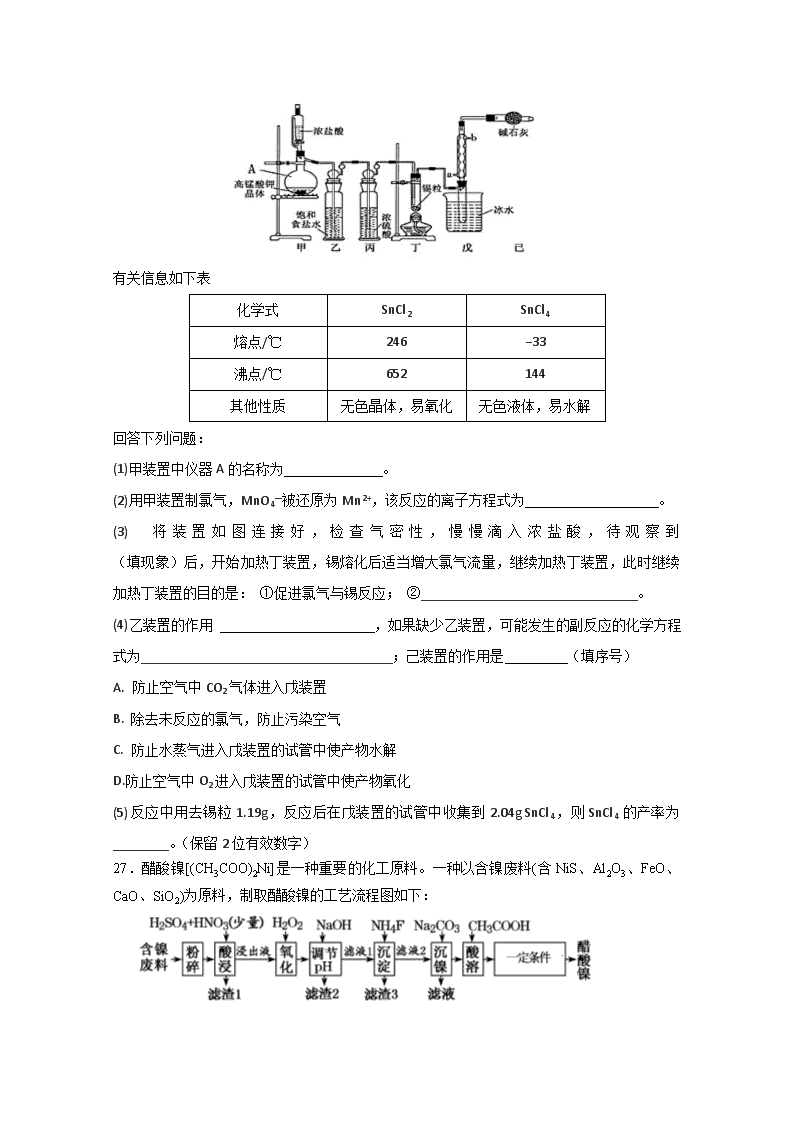
26.四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置略去)
有关信息如下表
化学式
SnCl2
SnCl4
熔点/℃
246
−33
沸点/℃
652
144
其他性质
无色晶体,易氧化
无色液体,易水解
回答下列问题:
(1)甲装置中仪器A的名称为 。
(2)用甲装置制氯气,MnO4—被还原为Mn2+,该反应的离子方程式为 。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到 (填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是: ①促进氯气与锡反应; ②_______________________________。
(4)乙装置的作用 ,如果缺少乙装置,可能发生的副反应的化学方程式为____________________________________;己装置的作用是 (填序号)
A. 防止空气中CO2气体进入戊装置
B. 除去未反应的氯气,防止污染空气
C. 防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.04g SnCl4,则SnCl4的产率为________。(保留2位有效数字)
27.醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
T ℃时相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子
开始沉淀的pH
沉淀完全的pH
物质
T ℃时溶解性(H2O)
Fe3+
1.1
3.2
CaSO4
微溶
Fe2+
5.8
8.8
NiF2
可溶
Al3+
3.0
5.0
CaF2
难溶
Ni2+
6.7
9.5
NiCO3
Ksp=1.00×10-5
(1)“酸浸”前将废料粉碎,其目的是________________________________。
(2)调节pH步骤中,溶液pH的调节范围是____________________________。
(3)滤渣1主要成分的化学式是CaSO4和_______,滤渣3主要成分的化学式_______。
(4)写出氧化步骤中加入H2O2发生反应的离子方程式:___________________________。
(5)酸浸过程中,1 mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应化学方程式:______________________________________。
(6)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全
[c(Ni2+)≤1.0×10-5 mol·L-1],则需要加入Na2CO3(M=106 g·mol-1)固体的质量最少为___ g
(7)加入醋酸进行酸溶得到醋酸镍溶液,一定条件指的是 、 过滤、洗涤、干燥得到醋酸镍产品。
28.甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用 和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图1所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
② 在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图2所示,t0 ℃后CH4的转化率突减的原因可能是__________。
图4
(3) 甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图3所示。
① t1 ℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为___。(保留3位有效数字)
② 在图3中,t3 ℃时,化学反应2CH4(g)C2H2(g)+3H2(g)的压强平衡常数Kp=____。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________________________。
(5)设计如上图4实验探究牺牲阳极的阴极保护法原理。
操作
现象
(i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液
无明显现象
(ii)在U形管铁极附近滴加铁氰化钾溶液
产生蓝色沉淀
得出结论:①锌 保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成 。
36.盐酸巴氯芬是一种用于改善骨骼肌痉挛的口服片剂。下面是它的一种合成路线(具体反应条件和部分试剂略):
已知:①RCOOHRCOCl ②H3C-CHOH3C-CH=CH-COOH
(1)A是一种芳香烃,则B的名称为 ,B→C的反应类型为 。
(2)H中所含官能团的名称为 。
(3)写出F→G反应的化学方程式: 。
(4)C的同分异构体中能与FeCl3溶液发生显色反应的有 种,其中核磁共振氢谱有3种峰且峰面积之比为2:2:1的结构简式为 。
(5)人们将连有四个不同基团的碳原子形象地称为手性碳原子。请你判断盐酸巴氯芬中有
个手性碳原子。
(6)由B开始制取E的合成路线有多种,请将下列合成路线中的相关内容补充完整,有机物写结构简式,无机物写分子式。
高三化学综合训练6参考答案
7 D、8 C、9 C、10 A、11 B、12 B、13 B
26.(1)蒸馏烧瓶
(2)
(3)②使SnCl4气化
(4)利于从混合物中分离出来;;BC
(5)78%
27. (1)加快反应速度,提高镍的浸出率
(2) 5.0≤pH<6.7 (2分,答5.0≤pH或pH<6.7给1分)
(3) SiO2 , CaF2
(4) 2Fe2++H2O2+2H+===2Fe3++2H2O
(5)NiS+H2SO4+2HNO3===NiSO4+SO2↑+2NO↑+2H2O
(6)31.8 (7) 蒸发浓缩、冷却结晶
28. (1)+378 (2) ① A ②温度过高,催化剂活性降低(或催化剂失活)
(3) ① 66.7% ②1.0× 104.7
(4) [Fe(CN)6]4--e-===[Fe(CN)6]3-
(5) ①能 ② Fe2+