- 2021-07-02 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习电化学作业(全国通用)
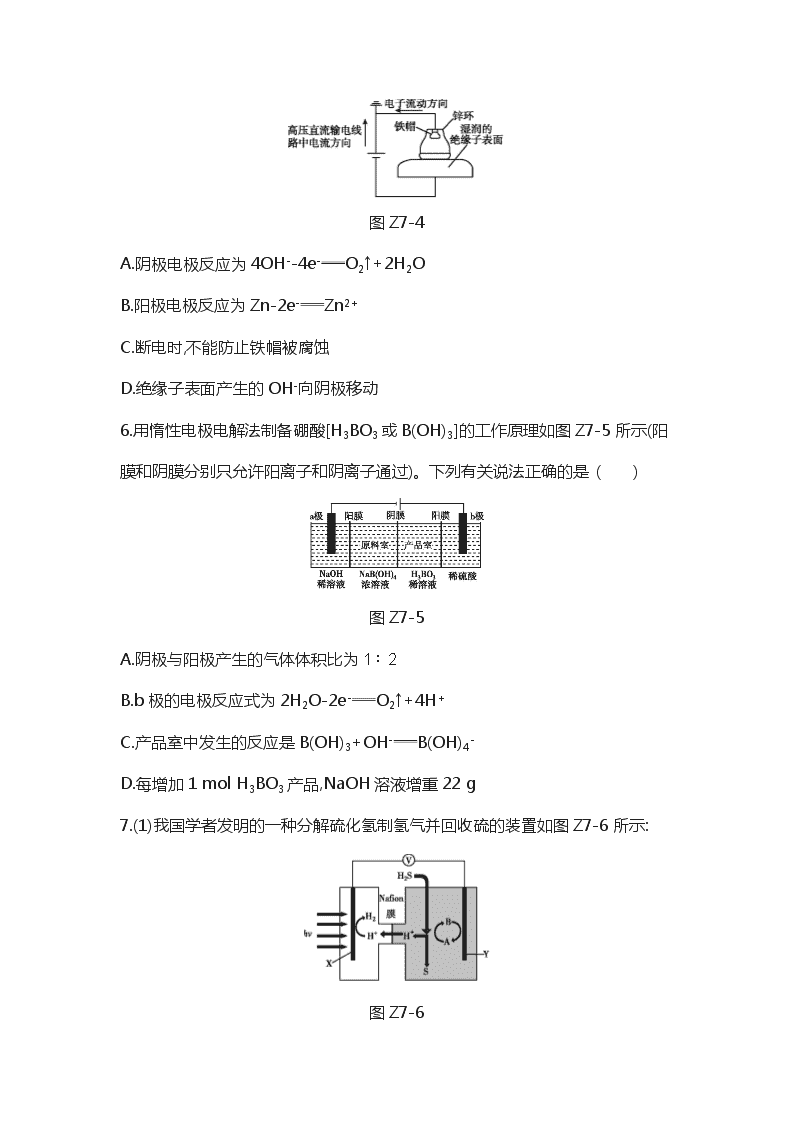
电化学 1.江苏正在建设世界最大的海上风电场,防腐蚀是建设海上风电场需要特别注意的问题,下列说法正确的是 ( ) A.海水的pH一般在8.0~8.5之间,对风电机钢铁支架的腐蚀主要是析氢腐蚀 B.腐蚀总反应4Fe+3O2+2xH2O2[Fe2O3·xH2O](铁锈)的ΔH>0,ΔS<0 C.钢部件镀锌前,可用碱液洗去表面的铁锈 D.热喷涂锌铝合金,可以减缓管道的腐蚀 2.普通电解精炼铜的方法所制备的铜中仍含杂质,利用如图Z7-1中的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是 ( ) 图Z7-1 A.电极a为粗铜,电极b为精铜 B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 D.当电路中通过1 mol电子时,可生成32 g精铜 3.科学家研发出了一种新材料,其工作原理如图Z7-2所示。在外接电源作用下,材料内部发生氧化还原反应导致颜色变化, 从而实现对光的透过率进行可逆性调节。已知WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3 均有颜色。下列说法正确的是 ( ) 图Z7-2 A.当M外接电源正极时,该材料颜色变深使光的透过率降低 B.该材料在使用较长时间后,离子导电层中Li+的量变小 C.当M外接电源负极时,离子导电层中的Li+向变色导电层定向迁移 D.当N外接电源正极时,离子储存层的电极反应式为Fe4[Fe(CN)6]3+4Li++4e-Li4Fe4[Fe(CN)6]3 4.如图Z7-3,利用电解原理将NO转化为NH4NO3,既节约了资源,又保护了环境。下列有关说法正确的是 ( ) 图Z7-3 A.NO转化为NH4NO3的反应属于氮的固定 B.阴极上发生还原反应,电极反应式为NO+5H++5e-NH3·H2O C.电解池两极上分别生成的甲是N,乙是N D.为使电解产物全部转化为NH4NO3,需补充的物质丙为HNO3 5.近年来,我国多条高压直流输电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀(如图Z7-4所示),下列说法正确的是 ( ) 图Z7-4 A.阴极电极反应为4OH--4e-O2↑+2H2O B.阳极电极反应为Zn-2e-Zn2+ C.断电时,不能防止铁帽被腐蚀 D.绝缘子表面产生的OH-向阴极移动 6.用惰性电极电解法制备硼酸[H3BO3或B(OH)3]的工作原理如图Z7-5所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是 ( ) 图Z7-5 A.阴极与阳极产生的气体体积比为1∶2 B.b极的电极反应式为2H2O-2e-O2↑+4H+ C.产品室中发生的反应是B(OH)3+OH-B(OH)4- D.每增加1 mol H3BO3产品,NaOH溶液增重22 g 7.(1)我国学者发明的一种分解硫化氢制氢气并回收硫的装置如图Z7-6所示: 图Z7-6 ①该装置中能量转化的形式为 。 ②若Y极溶液中的电对(A/B)选用/I-,装置工作时Y极上的电极反应式为 ,Y极溶液中发生的离子反应为 ;再列举一种可作为Y极循环液的常见的电对: 。 ③该分解H2S制氢的方法主要优点是 。 (2)过二硫酸钾(K2S2O8)可通过“电解→转化→提纯”方法制得,电解装置示意图如图Z7-7所示。 图Z7-7 ①电解时,铁电极连接电源的 极。 ②常温下,电解液中含硫微粒的主要存在形式与pH的关系如图Z7-8所示。 图Z7-8 在阳极放电的离子主要是HS,阳极区电解质溶液的pH范围为 ,阳极的电极反应式为 。 ③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法为 。 (3)甲烷燃料电池工作原理如图Z7-9所示。a气体是 ,b气体通入电极的反应式为 。用该燃料电池作电源,以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1 mol Cu2(OH)2CO3溶解于该溶液, 恰好使溶液恢复至起始成分和浓度,则燃料电池中理论上消耗CH4的体积(标准状况)为 。 图Z7-9 (4)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用(如图Z7-10所示)。 图Z7-10 ①进入电解池的溶液中,溶质是 。 ②阳极的电极反应式为 。 ③电解总反应的离子方程式是 。 8.KMnO4是一种重要的氧化剂,广泛用于化学分析和化工生产以及水处理工业。工业上可由软锰矿(主要成分为MnO2)制备,目前有两种较为成熟的制法。其模拟流程如图Z7-11所示: 图Z7-11 附表:不同温度下若干常见钾的化合物的溶解度 [单位:g/(100 g H2O)] 化学式 20 ℃ 30 ℃ 40 ℃ 60 ℃ 80 ℃ 100 ℃ CH3COOK 256 283 324 350 381 K2SO4 11.1 13 14.8 18.2 21.4 24.1 KCl 34.2 37.2 40.1 45.8 51.3 56.3 KMnO4 6.34 9.03 12.6 22.1 K2CO3 111 114 117 127 140 156 (1)“熔融”时,可用作坩埚材料的是 (填序号)。 A.氧化铝 B.陶瓷 C.氧化镁 D.石英 (2)写出MnO2和KOH熔融物中通入富氧空气时获得K2MnO4的化学方程式: 。 (3)“酸歧化法”是在pH<6的情况下K2MnO4转化为MnO2和KMnO4,过滤除去MnO2,将滤液经过蒸发浓缩、趁热过滤得到KMnO4粗晶体,再经过重结晶获得较纯净的KMnO4晶体。 ①根据表中的溶解度数据以及上述操作的特点,“酸歧化法”不适宜选择的酸性物质是 。 A.稀硫酸 B.醋酸 C.稀盐酸 D.二氧化碳 ②“蒸发浓缩”时,温度需控制在70 ℃,适宜的加热方式是 。 ③根据相关离子方程式,计算“酸歧化法”的理论产率为 。 (4)“电解法”克服了“酸歧化法”理论产率偏低的问题,同时副产品KOH可用于软锰矿的焙烧。电解法制备高锰酸钾的实验装置示意图如图Z7-12(图中阳离子交换膜只允许K+通过): 图Z7-12 ①a为 (填“正”或“负”)极,右室发生的电极反应式为 。 ②若电解开始时阳极区溶液为1.0 L 0.40 mol·L-1 K2MnO4溶液,电解一段时间后,右室中为6∶5,阴极区生成KOH的质量为 。 答案及解析 1.D [解析] 海水的pH一般在8.0~8.5之间,海水呈弱碱性,对钢铁支架的腐蚀主要是吸氧腐蚀,A错误;钢铁发生吸氧腐蚀的负极电极反应式为Fe-2e-Fe2+、正极电极反应式为O2+2H2O+4e-4OH-,电池总反应为2Fe+O2+2H2O2Fe(OH)2,接着发生的反应有4Fe(OH)2+O2+2H2O4Fe(OH)3、2Fe(OH)3Fe2O3+3H2O,腐蚀的总反应为4Fe+3O2+2xH2O2(Fe2O3·xH2O),该反应为放热反应,ΔH<0,ΔS<0,B错误;铁锈的主要成分为Fe2O3·xH2O,碱液与铁锈不反应,不能洗去钢部件表面的铁锈,C错误;锌铝合金比Fe活泼,锌铝合金为负极,钢铁为正极被保护,减缓管道的腐蚀,此保护法称为牺牲阳极的阴极保护法,D正确。 2.D [解析] 由题意结合电解原理可知,电极a是阴极,为精铜,电极b阳极,为粗铜,A不正确;甲膜为阴离子交换膜,可阻止杂质阳离子进入阴极区,B不正确; 乙膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区,C不正确;当电路中通过1 mol电子时,可生成0.5 mol精铜,其质量为32 g ,D正确。 3.C [解析] 当M外接电源正极时,M为阳极,LiWO3失电子产生WO3,该材料颜色变浅使光的透过率增强,A错误;电极总反应式为4WO3+Li4Fe4[Fe(CN)6]34LiWO3+Fe4[Fe(CN)6]3,该材料在使用较长时间后,离子导电层中Li+的量不变,B错误;当M外接电源负极时变色导电层作为阴极,离子导电层中的阳离子Li+向阴极变色导电层定向迁移,C正确;当N外接电源正极时,离子储存层的电极反应式为Li4Fe4[Fe(CN)6]3-4e-Fe4[Fe(CN)6]3+4Li+,D错误。 4.C [解析] NO属于含氮元素的化合物,转化为NH4NO3的反应不属于氮的固定,A错误;阴极上发生还原反应,根据图像,NO得到电子,化合价降低生成铵根离子,电极反应式为NO+6H++5e-N+H2O,B错误;根据B的分析,电解池阴极上生成的是N,阳极上NO被氧化生成的是N,C正确;阳极上NO被氧化生成的是N,阳极反应为NO-3e-+2H2ON+4H+,阴极上NO得到电子被还原生成铵根离子,阴极反应为NO+5e-+6H+N+H2O,总反应方程式为8NO+7H2O3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,D错误。 5.B [解析] 阴极电极反应为2H2O+2e-H2↑+2OH-,A错误;阳极锌失电子产生锌离子,电极反应为Zn-2e-Zn2+,B正确;断电时,锌环作负极,仍能防止铁帽被腐蚀,C错误;电解池中绝缘子表面产生的OH-向阳极移动,D错误。 6.D [解析] 由图可知,b电极为阳极,电解时阳极上水失电子生成O2和H+,a电极为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过阳膜进入a极室,溶液中c(NaOH)增大,原料室中的B(OH)4-膜进入产品室,b 极室中氢离子通入阳膜进入产品室,B(OH)4-、H+发生反应生成H3BO3;a、b电极反应式分别为2H2O+2e-H2↑+2OH-、2H2O-4e-O2↑+4H+,理论上每生成1 mol产品,b极生成1 mol H+、a极生成0.5 mol H2。由a、b电极反应式可知阴极生成2 mol H2同时阳极生成1 mol O2,A错误; b极为阳极,电极反应为2H2O-4e-O2↑+4H+,B错误; 原料室中的B(OH)4-通过阴膜进入产品室,b极室中氢离子通入阳膜进入产品室,B(OH)4-、H+发生反应生成H3BO3,C错误; 理论上每生成1 mol产品,a极生成0.5 mol H2,质量为1 g,同时原料室中有1 mol钠离子通过阳膜进入a极室,1 mol Na+质量为23 g,所以氢氧化钠溶液增重22 g,D正确。 7.(1)①光能转变为化学能和电能 ②3I--2e- +H2SS↓+2H++3I- Fe3+/Fe2+ ③充分利用太阳能且不产生污染(或可在常温下实现,操作容易等合理答案) (2)①负 ②0~2 2HS-2e-S2+2H+ ③重结晶 (3)O2 CH4+2H2O-8e-CO2+8H+ 1.68 L (4)①FeCl2、HCl ②Fe2+-e- Fe3+ ③2Fe2++2H+2Fe3++H2↑ [解析] (1)②X电极上是H+转化为H2,元素化合价降低,发生还原反应,则Y电极应发生氧化反应,反应式为3I--2e-;Y极溶液中有H2S,具有还原性,而具有氧化性,则二者可以发生氧化还原反应,离子方程式为+H2SS↓+2H++3I-;另一种可作为Y极循环液的常见的电对为Fe3+/Fe2+。③该分解H2S制氢的方法主要优点是充分利用太阳能且无污染,可在常温下实现,操作容易等。(2)①电解时,铁作阴极,铁电极连接电源的负极。②常温下,在阳极放电的离子主要是HS, 电解HS生成S2,由图可知,HS存在的pH范围为-2~2,S2存在的pH范围为0~2,阳极区电解质溶液的pH范围为0~2;S化合价不变,O由-2价升高至-1价,失电子,阳极的电极反应式为 2HS-2e-S2+2H+ 。③往电解产品过二硫酸钠中加入硫酸钾,使其转化为过二硫酸钾粗产品,依据二者的溶解度差异,提纯粗产品的方法为重结晶。(3)根据电子的移动方向可知,右侧电极为负极,通入的气体为甲烷,左侧电极为正极,通入的气体为氧气,甲烷在负极上发生氧化反应生成二氧化碳,电极反应式为CH4+2H2O-8e-CO2+8H+;用该燃料电池作电源,以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1 mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,说明电解生成的物质为:阴极上生成0.2 mol Cu、0.1 mol氢气,阳极上生成0.15 mol氧气,转移电子0.15 mol×4=0.6 mol,则燃料电池中理论上消耗CH4的物质的量为0.075 mol,标准状况下的体积为0.075 mol×22.4 L·mol-1=1.68 L。(4)①反应池中FeCl3与H2S反应生成硫单质、FeCl2、HCl,FeCl2和HCl进入电解池的溶液中,所以溶质为FeCl2、HCl。②电解池的阳极发生氧化反应,二价铁离子失去1个电子生成三价铁离子,电极反应式为Fe2+-e-Fe3+。③电解氯化亚铁时,阴极发生氢离子得电子的还原反应,电极反应式为2H++2e-H2↑,阳极亚铁离子发生失电子的氧化反应,电极反应式为2Fe2+-2e-2Fe3+,根据两极反应可写总的电解反应为2Fe2++2H+2Fe3++H2↑。 8.(1)C (2)2MnO2+O2+4KOH2K2MnO4+2H2O (3)①AC ②水浴加热 ③66.7% (4)①负 Mn-e-Mn ②17.92 g [解析] (1)从流程图可知,软锰矿和KOH(s)的混合物于空气中加热熔融,由于氧化铝和二氧化硅均和KOH反应,所以“熔融”时,可用作坩埚材料的是氧化镁,因此,本题答案为C。(2)软锰矿的主要成分为MnO2,软锰矿和KOH(s)的混合物于空气中加热熔融,得到K2MnO4,反应方程式为2MnO2+O2+4KOH2K2MnO4+2H2O。(3)①根据表中的溶解度数据: CH3COOK和K2CO3的溶解度要比KMnO4大得多,而K2SO4和KCl的溶解度与KMnO4差别不大,且在酸性条件下KMnO4能氧化Cl-,所以“酸歧化法”不适宜选择的酸性物质是稀硫酸、稀盐酸,本题答案为AC。②“蒸发浓缩”时,温度需控制在70 ℃,适宜的加热方式是水浴加热。③根据离子方程式3Mn+4H+2Mn+MnO2↓+2H2O,依据锰原子守恒,3 mol K2MnO4理论上生成2 mol KMnO4,所以理论产率为×100%=66.7%。(4)①右侧Mn失电子生成Mn,为阳极,电极反应式为Mn-e-Mn;故连接阳极的b电极为电源正极,a则为负极。②1.0 L 0.40 mol·L-1 K2MnO4溶液中K2MnO4的物质的量为0.4 mol,=2∶1,n(Mn)=0.4 mol,n(K)=0.8 mol,阳极Mn失电子生成Mn,Mn原子物质的量不变,电解一段时间后,溶液中=6∶5,所以n(K)=0.48 mol,所以阴极区生成KOH的物质的量为n(KOH)=n(K)=0.8 mol-0.48 mol=0.32 mol,质量为m(KOH)=0.32 mol×56 g·mol-1=17.92 g。查看更多