2017-2018学年安徽省宣城市高二下学期期末考试化学试题(Word版)
宣城市2017-2018学年度第二学期期末调研测试
高二化学试题
可能用到的相对原子质量:H -1 O- 16 F-19 Na -23 S-32
一、选择题(每小题3分,共48分。在每小题给出的四个选项中,只有一个选项是符合题目要求的,请将正确选项填涂到答题卷上)
1.我国古代文献中有许多化学知识的记载,如《梦溪笔谈》中的“信州铅山县有苦泉,…,挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜”等,上述描述中没有涉及到的化学反应类型是
A.置换反应 B.复分解反应 C.离子反应 D.氧化还原反应
2.下列化学用语中正确的是
A.2-丁烯的结构简式为: B.NH4Cl的电子式:
C.NH3的比例模型: D.HC10的结构式:H-O-Cl
3.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.在标准状况下,20 g HF所占的体积约为22.4 L
B.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA
C.2.0 g H218O与D2O的混合物中所含中子数为NA
D.标准状况下,2. 24 L Cl2与过量NaOH溶液反应转移电子数为0.2 NA
4.常温下,下列各组离子一定能大量共存的是
A.无色透明溶液中:
B.能与金属铝反应放出氢气的溶液:
C.含有NaOH的溶液:
D.=0.1 mol/L的溶液中:
5.类比推理是化学中常用的思维方法,下列推理正确的是
A.Fe与Br2反应生成FeBr3,推测Fe与I2反应生成Fel3
B.NaCl与浓H2S04加热可制HC1,推测Nal与浓H2S04加热可制HI
C.C02是直线型分子,推测CS2也是直线型分子
D.SiH4的沸点高于CH4,推测HC1的沸点高于HF
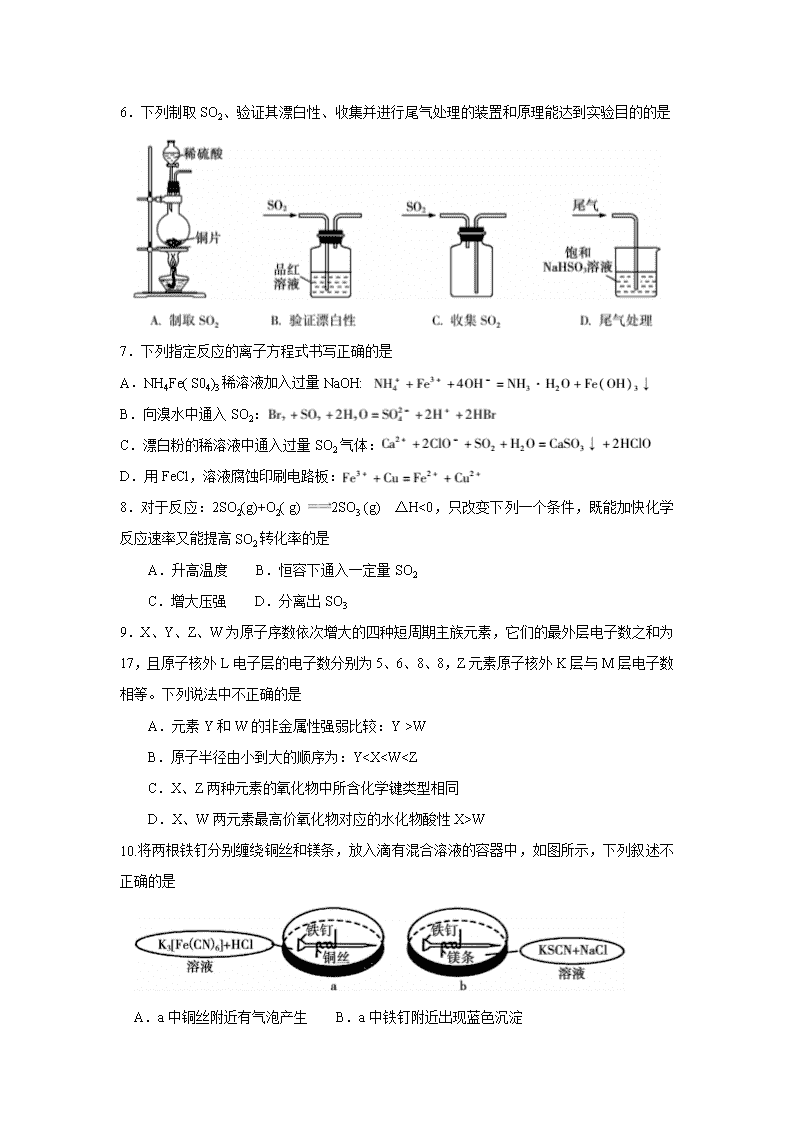
6.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
7.下列指定反应的离子方程式书写正确的是
A.NH4Fe( S04)3稀溶液加入过量NaOH:
B.向溴水中通入SO2:
C.漂白粉的稀溶液中通入过量SO2气体:
D.用FeCl,溶液腐蚀印刷电路板:
8.对于反应:2SO2(g)+O2( g) 2SO3 (g) △H<0,只改变下列一个条件,既能加快化学反应速率又能提高SO2转化率的是
A.升高温度 B.恒容下通入一定量SO2
C.增大压强 D.分离出SO3
9.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,它们的最外层电子数之和为17,且原子核外L电子层的电子数分别为5、6、8、8,Z元素原子核外K层与M层电子数相等。下列说法中不正确的是
A.元素Y和W的非金属性强弱比较:Y >W
B.原子半径由小到大的顺序为:Y
W
10.将两根铁钉分别缠绕铜丝和镁条,放入滴有混合溶液的容器中,如图所示,下列叙述不正确的是
A.a中铜丝附近有气泡产生 B.a中铁钉附近出现蓝色沉淀
C.b中发生吸氧腐蚀 D.b中铁钉附近呈现红色
11.下列说法正确的是
A.植物油氢化过程中发生了加成反应
B.淀粉和纤维素互为同分异构体
C.“天官一号”使用的碳纤维,是一种有机高分子材料
D.做衣服用的蚕丝、棉、麻灼烧时均不会产生特殊气味
12.某有机物的结构如图所示,关于该有机物,下列叙述不正确的是
A.该有机物的分子式为C11H12O3
B.1 mol该有机物与足量H2发生反应,最多消耗H24 mol
C.-定条件下,该有机物既能发生加聚反应又能发生缩聚反应
D.该有机物能使酸性KMn04溶液、溴水褪色,原理相同
13.分子式为C4H11N,对应的同分异构体共有(不含立体异构)
A.6种 B.7种 C.8种 D.9种
14.下列说法正确的是
A.验证乙炔使酸性KMn04褪色,将实验室制取的乙炔先通过CuSO4溶液洗气
B.检验CH2=CHCHO中的碳碳双键方法,加少量溴水,观察溴水是否褪色
C.证明溴乙烷发生消去反应,将产生的气体直接通入到酸性KMn04溶液中
D.除去甲苯中的苯酚,加入过量的浓溴水后过滤
15.常温下,下列有关叙述不正确的是
A.若NH4 Cl溶液的pH =6,则
B.0.2 mol/L的亚硫酸氢钠溶液中:
C.CH3COONa和CaCl2混合溶液中:
D.已知H2A的,则NaHA溶液呈碱性
16.在一定温度下,向一个体积不变的密闭容器中,充入等物质的量的N2和H2,发生反应:
N2+3H2 2NH3,下列不能说明反应一定达到平衡状态的是
A.N2的物质的量分数保持不变 B.H2的物质的量分数保持不变
C.容器的压强保持不变 D.气体的平均相对分子质量保持不变
第Ⅱ卷(非选择题,共52分)
二、非选择题(共4题,52分,请将正确答案填写在答题卷上)
17.(12分)下面是元素周期表的一部分,参照元素①一⑧在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为(填元素符号):________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填酸的分子式):____ 。
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:________。
(4)实验室制取⑧的单质的化学方程式为:____ 。
(5)⑥单质与⑤的最高价氧化物对应的水化物反应的离子方程式为:________。
(6)由①②④组成的甲醛是常见的新装修家庭的主要污染物,可设计原电池将其除去,试写出其在碱性介质中的电极反应式: 。
18.(14分)
(1)巳知:
则N2(g) +3H2(g) 2NH3(g)△H4= kJ/mol。
K4=____ 。(用K1,K2,K3表示)
(2)在一定温度下,某恒容密闭容器中,发生反应:X(g)+Y(g) →Z(g) △H<0,各物质的浓度随时间变化如图所示。
①从反应开始到4min时平衡,X的平均反应速率为____
②根据图中数据,4min时的平衡常数 K=_ ___ 。
③若使重新平衡时体系中c(X)=c(Z),则改变的条件为____(只写一项)。
④若某时刻,v正 (Y) =2v逆(Z),则反应 达到平衡(填“已”或“未”)。
⑤图中a、b点对应的正反应速率大小关系为va vb(填“大于”、“小于”或“等于”)。
19.(12分)实验室以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料制备MgCO3.3H2O。实验过程如下:
(1)酸溶过程中粉碎废渣的目的是:________, 滤渣的主要成分:____
(2)加入H2O2氧化时发生发应的离子方程式为:
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+
①向装有氧化后溶液的仪器A中加入一定量的密度比水小的有机萃取剂,混合振荡、 静置、分液(具体操作)是:____
②如何检验Fe3+萃取完全:取最后一次萃取后的水溶液少量于试管中,
(4)由萃取后得到的水溶液制备MgCO3.3H2O要除去溶液中的Al3+,边搅拌边向溶液中滴加氨水,室温下调节pH =6时,则此时溶液中c(Al3+)为____mol/L。
(已知该溶液中pH=8.5时Mg( OH)2开始沉淀;pH=12时Al(OH)3开始溶解, Ksp[Al(OH)3]=3×10 -34).
20.(14分)1941年从猫薄荷植物中分离出来的荆芥内酯可用作安眠药、抗痉挛药、退热药等。通过荆芥内酯的氢化反应可以得到二氢荆芥内酯,后者是有效的驱虫剂。为研究二氢荆 芥内酯的合成和性质,进行如下反应:
(1)C中官能团名称为: ;
(2)写出A—B的反应方程式:____ ;
(3)D物质的手性碳原子有____个(连有四个不同原子或原子团的碳原子称为手性碳原子),D—E的反应类型: (填“氧化反应”或“还原反应”)。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:____。
①能发生银镜反应;②分子中一个六元环;③分子中只有3种不同化学环境的氢。
(5)参照题干中的反应流程:写出由合成的合成路线图(无机试剂任选,需注明条件)。
已知:而得不到
则合成路线为: 。
宣城市2017-2018学年度第二学期期末调研测试
高二化学参考答案
一、选择题(每小题3分,共48分。在每小题给出的四个选项中,只有一个选项是符合题目要求的,请将正确选项填涂到答题卷上)
二、非选择题(共4题,52分,请将正确答案填写在答题卷上)
17.(12分,每空2分,答案合理即可)
18.(14分,每空2分,答案合理即可)
③适当升高温度、减小压强、加入X、减少Z或Y ④未 ⑤大于
19.(12分,每空2分,答案合理即可)
(1)加快废渣酸溶速率,提高原料的浸取率(回答一条即可) SiO2(或H2SiO3)
(3)①打开分液漏斗上口的塞子(1分),旋转活塞先从下口放出下层液体,再从上口倒出上层液体(1分)
②然后滴加少量的KSCN溶液,如不变红则分离完全(加入NaOH也可)
20.(14分,每空2分,合成4分,答案合理即可)
(1)溴原子,酯基。