- 2022-08-16 发布 |
- 37.5 KB |
- 40页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
大学化学-化学反应速率
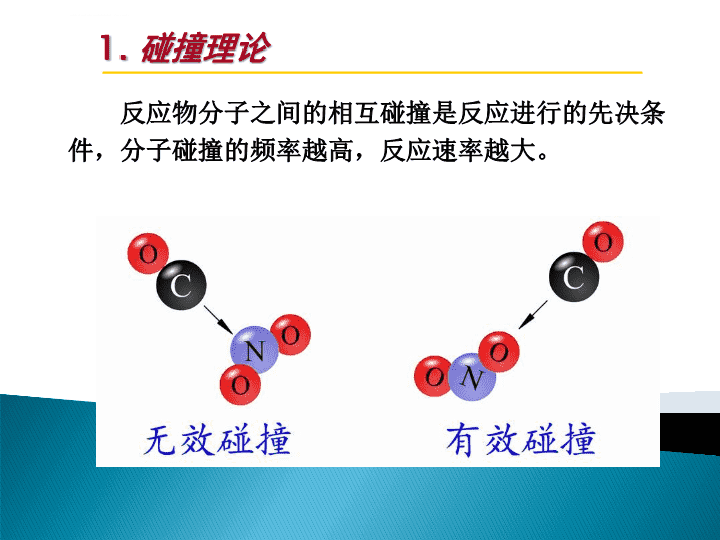
第5章化学反应速率化学动力学研究的内容:研究化学反应,必须研究三个问题:反应的自发性即反应的方向问题;给定条件下反应物的转化率即化学平衡问题;实现转化需要的时间即反应速率问题。化学反应的速率、影响反应速率的因素和控制反应速率的方法以及化学反应的机理,其目的在于促进有用化学反应的快速进行。\n一、反应速率理论简介1.碰撞理论2.过渡态理论1918年路易斯在气体分子运动论的基础上提出化学反应速率的碰撞理论;三十年代艾林等在量子力学和统计力学基础上提出反应速率的过渡态理论。\n1.碰撞理论反应物分子之间的相互碰撞是反应进行的先决条件,分子碰撞的频率越高,反应速率越大。\n1.碰撞理论碰撞的分子必须具备足够高的能量,克服分子间电子云的斥力,导致分子中原子重排,发生化学反应。这些具有足够高能量的分子称为活化分子,这个能量被称为活化能。活化分子只有采取定向碰撞时,反应才能发生。碰撞能发生反应的条件:(1)能量(2)定向碰撞\n1.碰撞理论反应速率的大小取决于单位时间内有效碰撞的次数,有效碰撞的次数又与反应的活化能密切相关,所以,活化能是决定反应速率的内在因素。一定温度下,反应的活化能越大,反应中活化分子的百分数就越小,单位时间内的有效碰撞就越少,反应速率就越慢。反之,反应的活化能越小,活化分子的百分数就越大,反应速率就越快。活化能与反应速率的关系:\n2.过渡态理论碰撞理论直观简便,对结构复杂分子反应不适用;过渡态理论观点:(1)先生成活化络合物具有足够能量的反应物分子相互接近时,分子中化学键重排,形成活化络合物的过渡状态;(2)后分解形成产物活化络合物能量很高,不稳定,易分解,或分解为产物,或分解仍为反应物;\n2.过渡态理论形成活化络合物的过渡状态需要克服一定的活化能,过渡态理论考虑了反应物分子的内部结构及运动状况,从分子角度更为深刻地解释了化学反应速率。活化络合物\n2.过渡态理论NOOCONO2与CO反应过程势能变化图\n2.过渡态理论原有的N-O键部分破裂,新的O···C键部分地形成,然后形成活化络合物[ONOCO],这时,反应分子的大部分动能暂时地转变为势能。活化络合物既可以分解成反应物NO2和CO,也可以生成产物NO和CO2,是一种过渡状态。当活化络合物[ONOCO]的一个N-O键完全断开,新形成的O···C键进一步缩短时,便生成产物,整个体系的势能降低。活化络合物:\n2.过渡态理论正反应活化能为134kJ·mol-1,逆反应活化能为368kJ·mol-1,正反应放热,∆H=–234kJ·mol-1;逆反应吸热,∆H=+234kJ·mol-1。对于很多反应,正反应的活化能减去逆反应的活化能就等于该反应的焓变∆H:∆H=E(正)–E(逆)当E(正)<E(逆)时,∆H<0,反应为放热反应;当E(正)>E(逆)时,∆H>0,反应为吸热反应;活化能与反应热的关系:\n2.过渡态理论例题:下图中哪一点代表反应的中间产物?哪一点代表活化络合物?1234势能反应过程活化络合物中间产物产物反应物\n一、反应速率理论简介小结(1)无论是吸热反应还是放热反应,都要经过一个中间过渡状态,反应物分子必须先爬过一个能峰,即克服反应活化能,反应才能进行。(2)不同的化学反应具有不同的活化能,一定温度下,反应的活化能越大,能峰越高,活化分子数越少,反应速率越慢;反之,活化能越小的反应速率越快。(3)活化络合物极不稳定,可以分解为产物,也可以分解为反应物,反应速率取决于活化络合物的浓度及其分解频率。正逆反应活化能之差为反应的摩尔焓变。\n二、化学反应速率的表示方法1.平均速率2.瞬时速率在一个特定的反应中,反应物或生成物的浓度随时间的变化率,具有“浓度·时间-1”的量纲,常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。其单位是mol·L-1·s-1、mol·L-1·min-1或mol·L-1·h-1。化学反应速率(rateofchemicalreaction)\n1.平均速率式中∆t为时间变化,∆cA、∆cB、∆cD、∆cE分别表示∆t时间内各组分的浓度变化,在同一时间间隔内,以上各自表示反应速率的数值是不相等的;aA+bB=dD+eE可用单位时间内反应物浓度的减少来表示平均速率也可用单位时间内生成物浓度的增加来表示平均速率\n2.瞬时速率一般来说,化学反应都不是等速变化的,只有瞬时速率才能表示化学反应中某时刻的真实反应速率,瞬时速率是∆t趋近于0时平均速率的极限值。\n2.瞬时速率瞬时速率的表达式是浓度对时间t的微分:在浓度-时间曲线上某一时刻的斜率的绝对值代表该时刻的瞬时速率,代表了化学反应的真正速率。\n二、化学反应速率的表示方法反应速率是通过实验测定的,实验中用化学方法或物理方法测定在不同时刻反应物或生成物的浓度,然后通过作图法,即可求得某一时刻的反应速率。①测定一组c-t数据,即测定不同时刻t时某组分的浓度(或分压);②以t为横坐标,c为纵坐标,作c-t曲线;③作任一时刻t时曲线的切线;斜率\n二、化学反应速率的表示方法\n大量实验结果表明:在一定温度下,增加反应物的浓度可以加快反应速率。白磷在纯氧气中燃烧白磷在20%氧气中燃烧三、浓度对反应速率的影响\n三、浓度对反应速率的影响一定温度下,某一化学反应,反应物中活化分子的百分数是一定的。增加反应物浓度,使单位体积内活化分子数目增多,增加了反应物分子有效碰撞的次数,所以反应速率增大。一定温度下,增加反应物的浓度可以增大反应速率。碰撞理论解释:1.基元反应2.速率方程\n1.基元反应多数化学反应不是基元反应,而是由两个或两个以上基元反应构成的,这样的化学反应称为非基元反应或复杂反应。反应物分子在碰撞中一步直接转化为生成物分子的反应称为基元反应,也称为简单反应。如下基元反应:SO2Cl2→SO2+Cl2NO2+CO→NO+CO2\n2.速率方程式中:v为反应速率;k为速率常数;c为浓度;a和b分别为反应物A和B浓度的指数;(a+b)称为该反应的反应级数;一般基元反应的速率方程式:基元反应的化学反应速率与各反应物的浓度以其计量数为指数的幂的连乘积成正比,这就是基元反应的质量作用定律。(5-1)aA+bB=dD+eE\n2.速率方程反应的速率方程一般不能简单地从反应的计量方程式中获得,它与反应机理有关,必须由实验来确定。把反应物浓度同反应速率定量地联系起来的数学表达式称为速率方程。只有基元反应的速率方程可以依据反应方程式直接写出,质量作用定律只适用于基元反应。◆◆◆\n2.速率方程速率常数k取决于反应的本性与浓度无关,它随温度变化,温度升高,速率常数通常增大。不同反应具有不同的速率常数,其它条件相同时可以用速率常数衡量反应速率,快反应具有较大的速率常数。(5-1)\n四、温度对反应速率的影响温度能显著地影响反应速率,绝大多数化学反应,无论是放热反应还是吸热反应,其反应速率都随温度的升高而增大。\n四、温度对反应速率的影响T2>T1温度升高,活化分子百分数增大,有效碰撞的百分数增加,使反应速率大大加快。\n四、温度对反应速率的影响温度对反应速率的影响主要体现在对速率常数k的影响上。1889年瑞典物理化学家阿仑尼乌斯总结了大量实验事实,提出一个较为精确的描述反应速率与温度关系的经验公式。SvanteAugustArrhenius阿仑尼乌斯1859~1927\n四、温度对反应速率的影响k反应速率常数,一个温度函数,随温度而变;A指数前因子或频率因子常数;e自然对数的底(e=2.718);T热力学温度;Ea反应的活化能;R气体常数(8.314J·mol-1·K–1);(5-2)阿仑尼乌斯方程式:\n四、温度对反应速率的影响阿仑尼乌斯方程式:速率常数k与绝对温度T成指数关系,温度的微小变化,将导致k值的较大变化,尤其是活化能Ea较大时更是如此。(5-2)温度与反应速率的关系为:温度升高,速率常数k增大,反应速率加快。\n四、温度对反应速率的影响如果某反应在温度T1和T2时的速率常数分别为k1和k2,活化能Ea在T1至T2的温度范围内可以视为常数,由(5-3)式可以导出:(5-3)(5-4)阿仑尼乌斯方程式的对数形式:\n四、温度对反应速率的影响(1)改变反应温度,改变了反应中活化分子的百分数,但并没有改变反应的活化能。(2)无论吸热反应还是放热反应,温度升高,反应速率都要加快。这两者在反应过程中反应物都必须爬过一个能垒,反应才能进行,升高温度,有利于反应物能量提高,故两者的反应速率都要加快。不过吸热反应速率加快的程度大于放热反应。注意:\n四、温度对反应速率的影响例题反应:C2H5Br(g)→C2H4(g)+HBr(g)在650K时的速率常数是2.0×10–5s–1;在670K时的速率常数是7.0×10–5s–1,求反应的活化能。解:根据公式(5-4)求活化能\n五、催化剂对反应速率的影响催化剂是一种能改变化学反应速率,其本身在反应前后质量和化学组成均不改变的物质。催化剂之所以能改变化学反应速率,是因为它参与了化学变化过程,改变了反应原来的途径,降低了活化能。\n五、催化剂对反应速率的影响催化剂改变了反应途径,反应沿一条活化能低的捷径进行,因而速率加快。\n五、催化剂对反应速率的影响\n五、催化剂对反应速率的影响合成氨反应,没有催化剂时反应的活化能为326.4kJ·mol-1,加Fe作催化剂时,活化能降低至175.5kJ·mol-1。催化剂不影响产物和反应物的相对能量,没有改变反应的始态和终态,所以催化剂只能改变反应途径而不能改变反应发生的方向。从图中还可以看到,加入催化剂后,正、逆反应的活化能降低的数值相等,这意味着催化剂同等程度地加快正、逆反应的速率。\n五、催化剂对反应速率的影响\n五、催化剂对反应速率的影响催化剂同等程度地加快正、逆反应的速率,所以催化剂只能加速化学平衡的到达,不能改变平衡点的位置。催化剂虽然改变了反应原来的途径,降低了活化能,但不能改变反应的G,对一个G>0的反应,想用催化剂改变其反应方向是徒劳的。\n例如:消除汽车尾气的污染,可采用如下的反应反应的可能性足够大,只是反应速率不够快,不能在尾气管中完成,以致散到大气中,造成污染。若能有适当方式加快上述反应,则可大大减小环境污染。又如:橡胶的老化,食品的腐烂等,人们又常常希望它慢一些。所以研究速率理论是完全必要的!研究影响反应速率因素的意义\n汽车尾气净化催化剂的研究进展主要成分:CO、碳氢化合物(HC)、氮氧化物(NOx)、SO2和颗粒物(包括铅化合物、碳黑颗粒和油雾等),严重污染了环境,造成对人体健康的损害。采用催化剂净化汽车尾气,是目前减少汽车排放污染的主要措施。三效催化剂1.贵金属催化剂2.钙钛矿型催化3.其他催化剂污染防治技术,2008,21,p70.查看更多