【物理】2019届一轮复习人教版 理想气体的状态方程学案
第3讲 理想气体的状态方程[目标定位] 1.了解理想气体的概念,并知道实际气体在什么情况下可以看成理想气体. 2.掌握理想气体状态方程的内容和表达式,并能应用方程解决实际问题.一、理想气体1.定义:在任何温度任何压强下都严格遵从三个实验定律的气体.2.实际气体在压强不太大(相对大气压),温度不太低(相对室温)时可当成理想气体处理.3.理想气体是一种理想化的模型,是对实际气体的科学抽象.二、理想气体的状态方程1.内容:一定质量的某种理想气体,在从一个状态(p1、V1、T1)变化到另一个状态(p2、V2、T2)时,尽管p、V、T都可能改变,但是压强(p)跟体积(V)的乘积与热力学温度(T)的比值保持不变.2.理想气体状态方程表达式:=或=C(恒量).3.推导方法:(1)控制变量法.(2)选定状态变化法.4.成立条件:质量一定的理想气体.一、理想气体状态方程1.理想气体(1)理解:理想气体是为了研究问题方便提出的一种理想模型,是实际气体的一种近似,就像力学中质点、电学中点电荷模型一样,突出矛盾的主要方面,忽略次要方面,从而认识物理现象的本质,是物理学中常用的方法.(2)特点:①严格遵守气体实验定律及理想气体状态方程.②理想气体分子本身的大小与分子间的距离相比可以忽略不计,分子可视为质点.
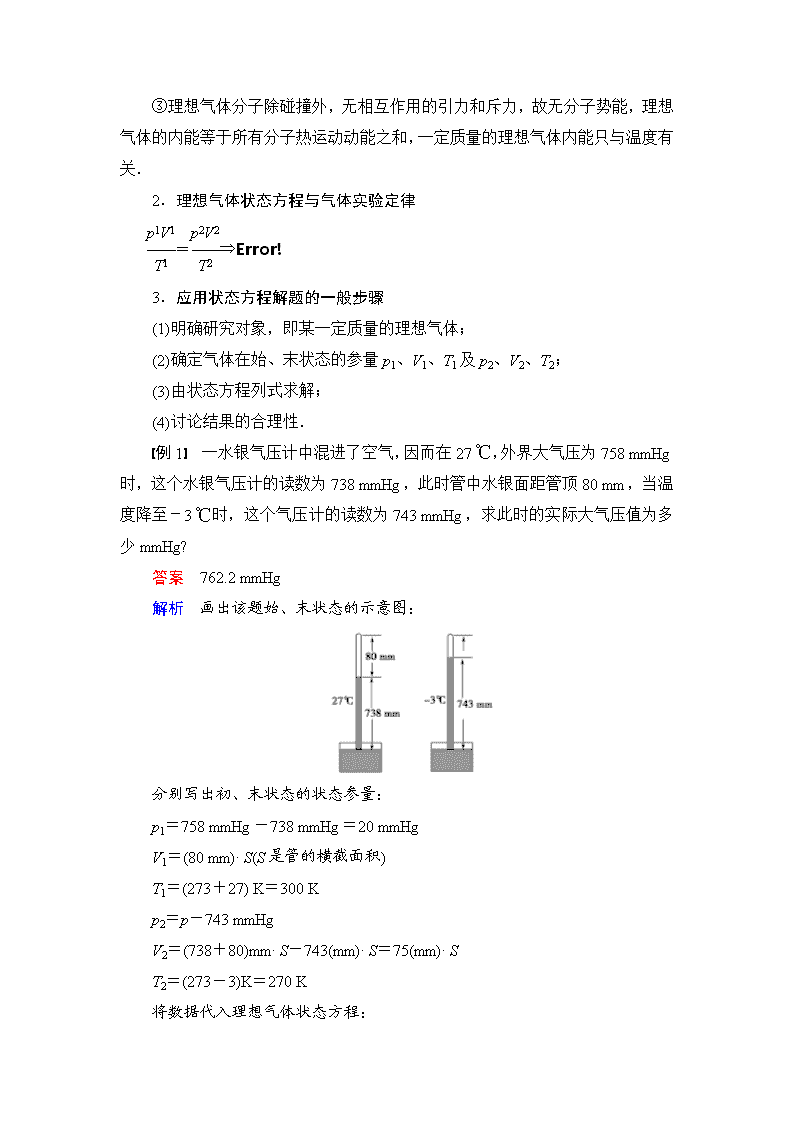
③理想气体分子除碰撞外,无相互作用的引力和斥力,故无分子势能,理想气体的内能等于所有分子热运动动能之和,一定质量的理想气体内能只与温度有关.2.理想气体状态方程与气体实验定律=⇒3.应用状态方程解题的一般步骤(1)明确研究对象,即某一定质量的理想气体;(2)确定气体在始、末状态的参量p1、V1、T1及p2、V2、T2;(3)由状态方程列式求解;(4)讨论结果的合理性.例1 一水银气压计中混进了空气,因而在27℃,外界大气压为758mmHg时,这个水银气压计的读数为738mmHg,此时管中水银面距管顶80mm,当温度降至-3℃时,这个气压计的读数为743mmHg,求此时的实际大气压值为多少mmHg?答案 762.2mmHg解析 画出该题始、末状态的示意图:分别写出初、末状态的状态参量:p1=758mmHg-738mmHg=20mmHgV1=(80mm)·S(S是管的横截面积)T1=(273+27)K=300Kp2=p-743mmHgV2=(738+80)mm·S-743(mm)·S=75(mm)·ST2=(273-3)K=270K将数据代入理想气体状态方程:
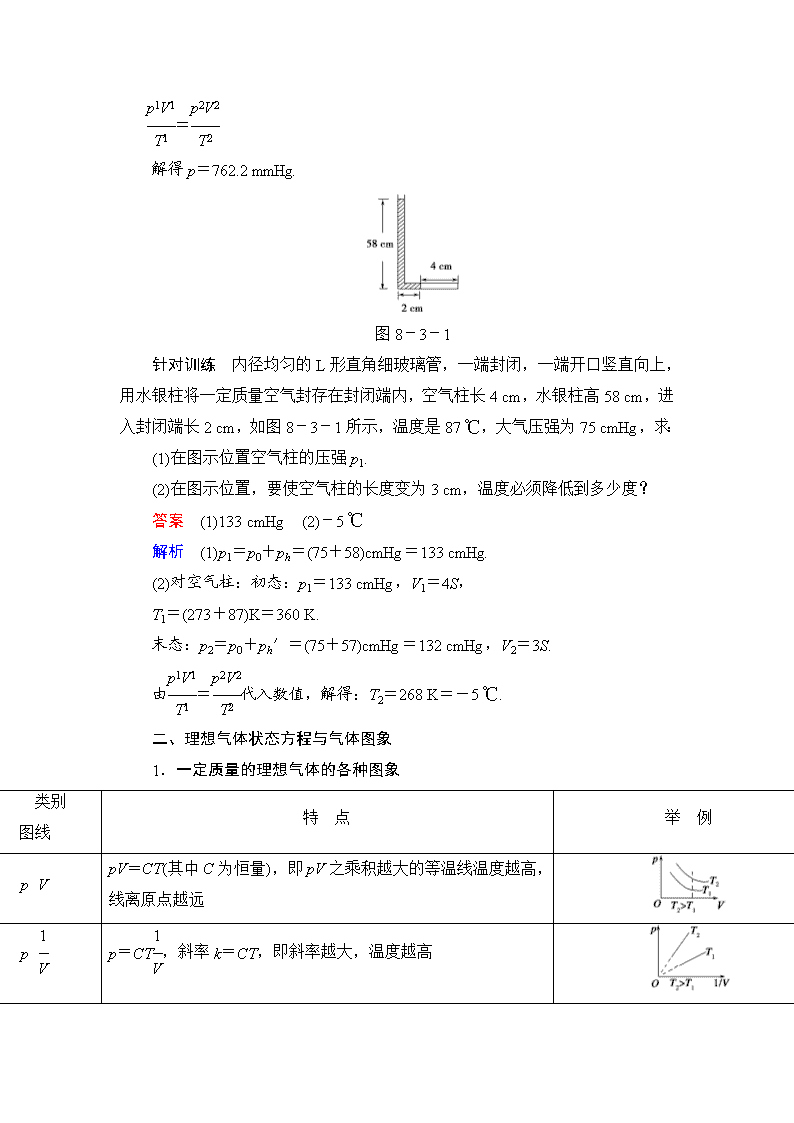
=解得p=762.2mmHg.图8-3-1针对训练 内径均匀的L形直角细玻璃管,一端封闭,一端开口竖直向上,用水银柱将一定质量空气封存在封闭端内,空气柱长4cm,水银柱高58cm,进入封闭端长2cm,如图8-3-1所示,温度是87℃,大气压强为75cmHg,求:(1)在图示位置空气柱的压强p1.(2)在图示位置,要使空气柱的长度变为3cm,温度必须降低到多少度?答案 (1)133cmHg (2)-5℃解析 (1)p1=p0+ph=(75+58)cmHg=133cmHg.(2)对空气柱:初态:p1=133cmHg,V1=4S,T1=(273+87)K=360K.末态:p2=p0+ph′=(75+57)cmHg=132cmHg,V2=3S.由=代入数值,解得:T2=268K=-5℃.二、理想气体状态方程与气体图象1.一定质量的理想气体的各种图象 类别图线 特 点举 例pVpV=CT(其中C为恒量),即pV之乘积越大的等温线温度越高,线离原点越远pp=CT,斜率k=CT,即斜率越大,温度越高
pTp=T,斜率k=,即斜率越大,体积越小VTV=T,斜率k=,即斜率越大,压强越小2.理想气体状态方程与一般状态变化图象基本方法:化“一般”为“特殊”,如图8-3-2是一定质量的某种理想气体的状态变化过程A→B→C→A.图8-3-2在V-T图线上,等压线是一簇延长线过原点的直线,过A、B、C三点作三条等压线分别表示三个等压过程pA′
TA.为确定它们之间的定量关系,可以从p-V图上的标度值代替压强和体积的大小,代入理想气体状态方程=,即=,故TB=6TA.理想气体状态方程的理解1.对于一定质量的理想气体,下列状态变化中可能的实现是( )A.使气体体积增加而同时温度降低B.使气体温度升高,体积不变、压强减小
C.使气体温度不变,而压强、体积同时增大D.使气体温度升高,压强减小、体积减小答案 A解析 由理想气体状态方程=恒量得A项中只要压强减小就有可能,故A项正确;而B项中体积不变,温度与压强应同时变大或同时变小,故B项错;C项中温度不变,压强与体积成反比,故不能同时增大,故C项错;D项中温度升高,压强减小,体积减小,导致减小,故D项错误.2.一定质量的理想气体,初始状态为p、V、T,经过一系列状态变化后,压强仍为p,则下列过程中可以实现的是( )A.先等温膨胀,再等容降温B.先等温压缩,再等容降温C.先等容升温,再等温压缩D.先等容降温,再等温压缩答案 BD解析 根据理想气体状态方程=C,若经过等温膨胀,则T不变,V增加,p减小,再等容降温,则V不变,T降低,p减小,最后压强p肯定不是原来值,A错,同理可以确定C也错,正确选项为B、D.理想气体状态变化的图象图8-3-53.如图8-3-5所示,在p-T坐标系中的a、b两点,表示一定质量的理想气体的两个状态,设气体在状态a时的体积为Va,密度为ρa,在状态b时的体积为Vb,密度为ρb,则( )A.Va>Vb,ρa>ρbB.VaVb,ρa<ρbD.Vaρb
答案 D解析 过a、b两点分别作它们的等容线,由于斜率ka>kb,所以Vaρb,故D正确.4.在下列图中,不能反映一定质量的理想气体经历了等温变化→等容变化→等压变化后,又可以回到初始状态的图是( )答案 D解析 根据p-V、p-T、V-T图象的意义可以判断,其中D项显示的是理想气体经历了等温变化→等压变化→等容变化,与题意不符.(时间:60分钟)题组一 理想气体及其状态方程1.关于理想气体,下列说法正确的是( )A.理想气体能严格遵从气体实验定律B.实际气体在温度不太高、压强不太小的情况下,可看成理想气体C.实际气体在温度不太低、压强不太大的情况下,可看成理想气体D.所有的实际气体在任何情况下,都可以看成理想气体答案 AC解析 理想气体是实际气体的科学抽象,是理想化模型,实际气体在温度不太低、压强不太大的情况下,可看成理想气体.2.关于理想气体的状态变化,下列说法中正确的是( )A.一定质量的理想气体,当压强不变而温度由100℃上升到200℃
时,其体积增大为原来的2倍B.气体由状态1变化到状态2时,一定满足方程=C.一定质量的理想气体体积增大到原来的4倍,可能是压强减半,热力学温度加倍D.一定质量的理想气体压强增大到原来的4倍,可能是体积加倍,热力学温度减半答案 C解析 一定质量的理想气体压强不变,体积与热力学温度成正比,温度由100℃上升到200℃时,体积增大为原来的1.27倍,故A错误;理想气体状态方程成立的条件为质量不变,B项缺条件,故错误;由理想气体状态方程=恒量可知,C正确,D错误.3.一定质量的气体,从初态(p0、V0、T0)先经等压变化使温度上升到T0,再经等容变化使压强减小到p0,则气体最后状态为( )A.p0、V0、T0B.p0、V0、T0C.p0、V0、T0D.p0、V0、T0答案 B解析 在等压过程中,V∝T,有=,V3=V0,再经过一个等容过程,有=,T3=T0,所以B正确.4.分别以p、V、T
表示气体的压强、体积、温度.一定质量的理想气体,其初始状态表示为(p0、V0、T0).若分别经历如下两种变化过程:①从(p0、V0、T0)变为(p1、V1、T1)的过程中,温度保持不变(T1=T0)②从(p0、V0、T0)变为(p2、V2、T2)的过程中,既不吸热,也不放热,在上述两种变化过程中,如果V1=V2>V0,则( )A.p1>p2,T1>T2B.p1>p2,T1p2,T1T2答案 A解析 依据理想气体状态方程==.由已知条件T1=T0,V1>V0,则p1T2,p1>p2,故选项A正确.5.一定质量的理想气体,在某一平衡状态下的压强、体积和温度分别为p1、V1、T1,在另一平衡状态下的压强、体积和温度分别为p2、V2、T2,下列关系中正确的是( )A.p1=p2,V1=2V2,T1=T2B.p1=p2,V1=V2,T1=2T2C.p1=2p2,V1=2V2,T1=2T2D.p1=2p2,V1=V2,T1=2T2答案 D题组二 理想气体状态变化的图象6.如图8-3-6所示为一定质量的理想气体沿着如图所示的方向发生状态变化的过程,则该气体压强的变化是( )图8-3-6A.从状态c到状态d,压强减小
B.从状态d到状态a,压强不变C.从状态a到状态b,压强增大D.从状态b到状态c,压强增大答案 AC解析 在V-T图上,等压线是延长线过原点的倾斜直线,对一定量的气体,图线的斜率表示压强的倒数,斜率大的,压强小,因此A、C正确,B、D错误.7.一定质量的理想气体经历如图8-3-7所示的一系列过程,ab、bc、cd和da这四段过程在pT图上都是直线段,ab和cd的延长线通过坐标原点O,bc垂直于ab,由图可以判断( )图8-3-7A.ab过程中气体体积不断减小B.bc过程中气体体积不断减小C.cd过程中气体体积不断增大D.da过程中气体体积不断增大答案 BD解析 由pT图线的特点可知a、b在同一条等容线上,过程中体积不变,故A错;c、d在同一条等容线上,过程中体积不变,故C错;在pT图线中,图线的斜率越大与之对应的体积越小,因此b→c的过程体积减小,同理d→a的过程体积增大,故B、D均正确.8.图8-3-8所示一定质量的理想气体,从状态1出发经过状态2和3,最终又回到状态1.那么,在下列的pT图象中,反映了上述循环过程的是( )图8-3-8
答案 B解析 从状态1出发经过状态2和3,最终又回到状态1,先后经历了等压膨胀、等容降温、等温压缩三个变化过程,由此判断B项正确.题组三 综合应用9.我国“蛟龙”号深海探测船载人下潜超过七千米,再创载人深潜新记录.在某次深潜试验中,“蛟龙”号探测到990m深处的海水温度为280K.某同学利用该数据来研究气体状态随海水深度的变化,如图8-3-9所示,导热良好的汽缸内封闭一定质量的气体,不计活塞的质量和摩擦,汽缸所处海平面的温度T0=300K,压强p0=1atm,封闭气体的体积V0=3m2.如果将该汽缸下潜至990m深处,此过程中封闭气体可视为理想气体.求990m深处封闭气体的体积(1atm相当于10m深的海水产生的压强).图8-3-9答案 2.8×10-2m3解析 当汽缸下潜至990m时,设封闭气体的压强为p,温度为T,体积为V,由题意知p=100atm.理想气体状态方程为=,代入数据得V=2.8×10-2m3.10.一轻活塞将一定质量的理想气体封闭在水平放置的固定汽缸内,开始时气体体积为V0,温度为27℃.在活塞上施加压力,将气体体积压缩到V0,温度升高到47℃.设大气压强p0=1.0×105Pa,活塞与汽缸壁的摩擦不计.(1)求此时气体的压强;
(2)保持温度不变,缓慢减小施加在活塞上的压力使气体体积恢复到V0,求此时气体的压强.答案 (1)1.6×105Pa (2)1.1×105Pa解析 (1)由理想气体状态方程得:=,所以此时气体的压强为:p1=×=×Pa=1.6×105Pa.(2)由玻意耳定律得:p2V2=p3V3,所以p3==Pa=1.1×105Pa.11.如图8-3-10所示,一根两端开口、横截面积为S=2cm2足够长的玻璃管竖直插入水银槽中并固定(插入水银槽中的部分足够深).管中有一个质量不计的光滑活塞,活塞下封闭着长L=21cm的气柱,气体的温度为t1=7℃,外界大气压取p0=1.0×105Pa(相当于75cm高的汞柱的压强).图8-3-10(1)若在活塞上放一个质量为m=0.1kg的砝码,保持气体的温度t1不变,则平衡后气柱为多长?(g=10m/s2)(2)若保持砝码的质量不变,对气体加热,使其温度升高到t2=77℃,此时气柱为多长?答案 (1)20cm (2)25cm解析 (1)被封闭气体的初状态为p1=p0=1.0×105PaV1=LS=42cm3,T1=280K
末状态压强p2=p0+=1.05×105PaV2=L2S,T2=T1=280K根据玻意耳定律,有p1V1=p2V2,即p1L=p2L2得L2=L=20cm.(2)对气体加热后,气体的压强不变,p3=p2,V3=L3S,T3=350K根据盖—吕萨克定律,有=,即=得L3=L2=25cm.图8-3-1112.如图8-3-11所示,水平放置的汽缸内壁光滑,活塞厚度不计,在A、B两处设有限制装置,使活塞只能在A、B之间运动,B左面汽缸的容积为V0,A、B之间的容积为0.1V0.开始时活塞在B处,缸内气体的压强为0.9p0(p0为大气压强),温度为297K,现缓慢加热汽缸内气体,直至399.3K.求:(1)活塞刚离开B处时的温度TB;(2)缸内气体最后的压强p;(3)在图8-3-12中画出整个过程的pV图线.图8-3-12答案 (1)330K (2)1.1p0 (2)见解析图解析 (1)汽缸内的气体初态时p1=0.9p0,V1=V0,T1=297K.当活塞刚离开B处时,气体的状态参量p2=p0,V2=V0,T2=TB,根据=,得=
,所以TB=330K.(2)随着温度不断升高,活塞最后停在A处时,气体的状态参量p4=p,V4=1.1V0,T4=399.3K.根据=,得=,解得p=1.1p0.(3)随着温度的升高,当活塞恰好停在A处时,气体的状态参量p3=p0,V3=1.1V0,T3=TA,由=得=,解得TA=363K.综上可知,气体在温度由297K升高到330K过程中,气体做等容变化;由330K升高到363K过程中,气体做等压变化;由363K升高到399.3K过程中,气体做等容变化.故整个过程的pV图象如图所示.