- 2021-05-14 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学ABC性质连比和速率探究模型
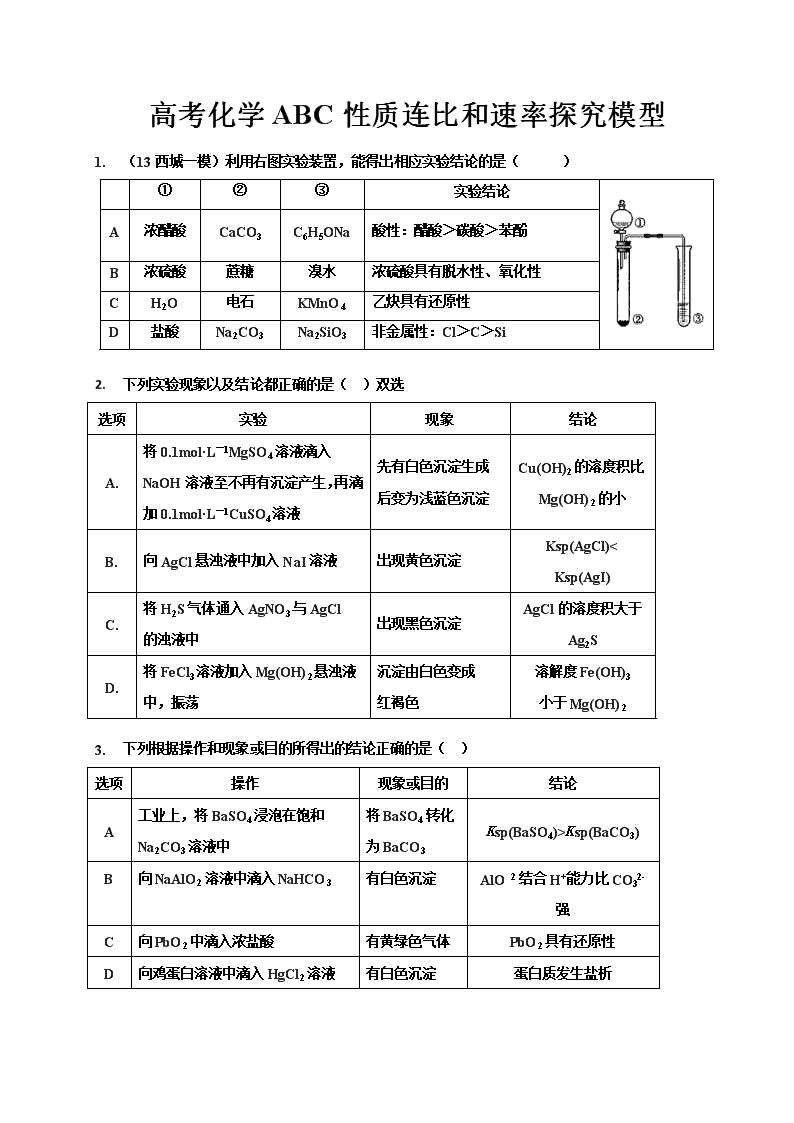
高考化学ABC性质连比和速率探究模型 1. (13西城一模)利用右图实验装置,能得出相应实验结论的是( ) ① ② ③ 实验结论 A 浓醋酸 CaCO3 C6H5ONa 酸性:醋酸>碳酸>苯酚 B 浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性 C H2O 电石 KMnO4 乙炔具有还原性 D 盐酸 Na2CO3 Na2SiO3 非金属性:Cl>C>Si 2. 下列实验现象以及结论都正确的是(AD )双选 选项 实验 现象 结论 A. 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 先有白色沉淀生成后变为浅蓝色沉淀 Cu(OH)2的溶度积比Mg(OH)2的小 B. 向AgCl悬浊液中加入NaI溶液 出现黄色沉淀 Ksp(AgCl)< Ksp(AgI) C. 将H2S气体通入AgNO3与AgCl 的浊液中 出现黑色沉淀 AgCl的溶度积大于 Ag2S D. 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 沉淀由白色变成 红褐色 溶解度Fe(OH)3 小于Mg(OH)2 3. 下列根据操作和现象或目的所得出的结论正确的是( B ) 选项 操作 现象或目的 结论 A 工业上,将BaSO4浸泡在饱和Na2CO3溶液中 将BaSO4转化为BaCO3 Ksp(BaSO4)>Ksp(BaCO3) B 向NaAlO2溶液中滴入NaHCO3 有白色沉淀 AlO结合H+能力比CO32-强 C 向PbO2中滴入浓盐酸 有黄绿色气体 PbO2具有还原性 D 向鸡蛋白溶液中滴入HgCl2溶液 有白色沉淀 蛋白质发生盐析 1. (10北京)为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去, 气密性已检验)。实验过程: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.…… (1)A中产生黄绿色气体,其电子式是 (2)验证氯气的氧化性强于碘的实验现象是 (3)B中溶液发生反应的离子方程式是 (4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 (5)过程Ⅲ实验的目的是 (6)氯、溴、碘单质的氧化性渐弱原因:同主族元素从上到下 ,得电子能力逐渐减弱 2. (13丰台一模)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。 实验过程: Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。 Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。 Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。 Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。 Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。 Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。 (1)过程Ⅰ的目的是 (2)棉花中浸润的溶液为 (3)A中发生反应的化学方程式为 (4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 (5)过程Ⅵ,检验B溶液中是否含有SO42-的操作是 (6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性 Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”) 过程Ⅳ B溶液中含有的离子 过程Ⅵ B溶液中含有的离子 甲 有Fe3+无Fe2+ 有SO42- 乙 既有Fe3+又有Fe2+ 有SO42- 丙 有Fe3+无Fe2+ 有Fe2+ 1B 2A D3 B 4 (1) (2)淀粉KI试纸变蓝 (3)Cl2+2Br - =Br2+2Cl- (4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静置后CCl4层溶液变为紫红色 (5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。 (6)原子半径逐渐增大 5(1)排除装置中的空气,防止干扰 (2)NaOH溶液 (3)MnO2+4HCl(浓)= MnCl2+Cl2↑+2H2O (4)70%的硫酸中c(H+)比98%的硫酸大,因此反应速率更快。 (5)向D试管中加入适量盐酸,再加BaCl2溶液,若有白色沉淀产生,说明溶液中含有SO42-(合理答案均给分) (6)乙、丙 查看更多