- 2021-05-14 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版创新设计高考化学一轮复习 电解池 金属的电化学腐蚀和防护练习 新人教版
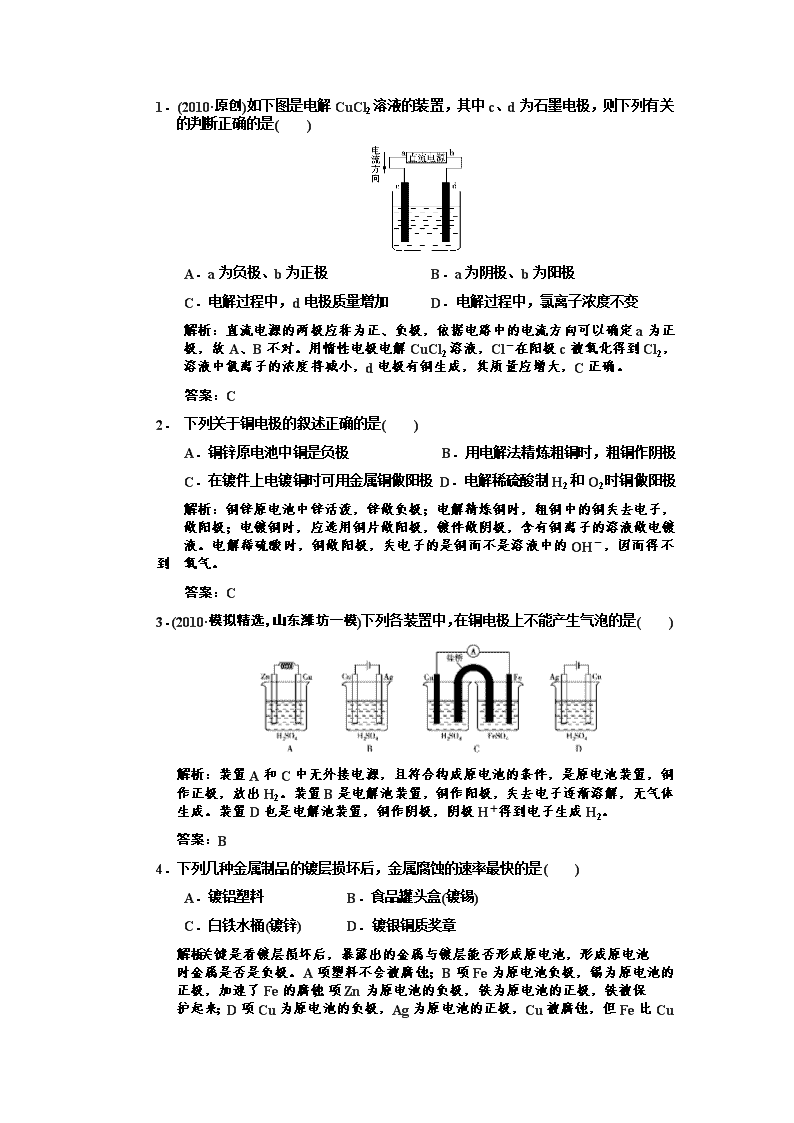
第三节 电解池 金属的电化学腐蚀和防护 1. (2010·原创)关于电解NaCl水溶液,下列叙述正确的是 ( ) A.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 C.电解时在阳极得到氯气,在阴极得到金属钠 D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 解析:电解食盐水时发生的反应: 阳极:2Cl--2e-===Cl2↑, 阴极:2H2O+2e-===H2↑+2OH-,(或2H++2e-===H2↑) 总反应:2NaCl+2H2O2NaOH+H2↑+Cl2↑。 对照分析选项,A错误;阳极附近的溶液中会溶有少量的Cl2,滴加KI溶液后发 生反应:Cl2+2I-===I2+2Cl-,溶液呈棕色,B正确;阴极H2O电离产生的H+ 放电产生H2,不是Na+放电生成钠,C错误;电解后生成NaOH,溶液呈碱性, D错误。 答案:B 2. (2009·浙江理综,12)市场上经常见到的标记为Li—ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: 下列说法不正确的是( ) A.放电时,负极的电极反应式:Li-e-===Li+ B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 C.该电池不能用水溶液作为电解质 D.放电过程中Li+向负极移动 解析:A项,放电时Li为负极,发生氧化反应;B项,充电时Li0.85NiO2既是氧 化剂,又是还原剂;C项,用水作电解质时,Li要与水反应;D项,放电时,正 极上聚集电子而吸引阳离子Li+。 答案:D 3. 电解100 mL含c(H+)=0.30 mol·L-1的下列溶液,当电路中通过0.04 mol电子时理论上析出金属质量最大的是( ) A.0.10 mol·L-1 Ag+ B.0.20 mol·L-1 Zn2+ C.0.20 mol·L-1 Cu2+ D.0.20 mol·L-1 Pb2+ 解析:根据金属活动顺序表可知:排在氢以后的金属为Ag和Cu,而Zn和Pb排 在H以前,所以Ag+、Cu2+的氧化性比H+强,应优先于H+放电而析出,因为0.01 mol Ag的质量小于0.02 mol Cu的质量,所以C项正确。 答案:C 4.(2009·北京理综,6)下列叙述不正确的是( ) A.铁表面镀锌,铁作阳极 B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-===4OH- D.工业上电解饱和食盐水的阳极反应:2Cl--2e-===Cl2↑ 解析:A项,铁表面镀锌是应用电解原理,镀件铁与电源的负极相连作阴极,镀 层金属锌与电源的正极相连作阳极,A项错误;B项,船底镶嵌锌块是应用原电 池原理,活泼金属作负极被氧化,铁作正极得到保护。 答案:A 5. (2010·模拟精选,盐城模拟)用惰性电极电解某溶液时,发现两极只有H2和O2生 成。则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中,正确的有 ( ) (1)该溶液的pH值可能增大;(2)该溶液的pH值可能减小;(3)该溶液的pH值可 能不变;(4)该溶液的浓度可能增大;(5)该溶液的浓度可能不变;(6)该溶液的浓度 可能减小 。 A.三种 B.四种 C.五种 D.六种 解析:若电解的是不饱和的强碱(如NaOH)溶液,则电解后溶液的pH增大,浓度 增大;若电解的是不饱和的非还原性的含氧酸(如H2SO4),则对应溶液的pH将降 低,浓度增大;若电解的是活泼金属的含氧酸盐(如Na2SO4)的饱和溶液,则溶液 pH保持不变,浓度不变。 答案:C 6.(2010·原创)如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试 管倒插入水中,将这个装置这样放置约一周后,观察到铁丝发生的变化 是________________,原因是____________________________。试管内水面会上 升,最终上升高度大约是________,原因是 _____________________________________。 解析:在潮湿的空气中,铁丝发生吸氧腐蚀,引起一系列反应。 答案:铁丝表面形成一层红棕色的铁锈 铁丝发生吸氧腐蚀 试管体积的 铁和 氧气反应,时间较长时耗尽全部O2,而空气中O2约占总体积的,所以试管内水 面上升高度大约是试管体积的 一、选择题 1.(2010·原创)如下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关 的判断正确的是( ) A.a为负极、b为正极 B.a为阴极、b为阳极 C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变 解析:直流电源的两极应称为正、负极,依据电路中的电流方向可以确定a为正 极,故A、B不对。用惰性电极电解CuCl2溶液,Cl-在阳极c被氧化得到Cl2, 溶液中氯离子的浓度将减小,d电极有铜生成,其质量应增大,C正确。 答案:C 2. 下列关于铜电极的叙述正确的是( ) A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时,粗铜作阴极 C.在镀件上电镀铜时可用金属铜做阳极 D.电解稀硫酸制H2和O2时铜做阳极 解析:铜锌原电池中锌活泼,锌做负极;电解精炼铜时,粗铜中的铜失去电子, 做阳极;电镀铜时,应选用铜片做阳极,镀件做阴极,含有铜离子的溶液做电镀 液。电解稀硫酸时,铜做阳极,失电子的是铜而不是溶液中的OH-,因而得不到 氧气。 答案:C 3.(2010·模拟精选,山东潍坊一模)下列各装置中,在铜电极上不能产生气泡的是( ) 解析:装置A和C中无外接电源,且符合构成原电池的条件,是原电池装置,铜 作正极,放出H2。装置B是电解池装置,铜作阳极,失去电子逐渐溶解,无气体 生成。装置D也是电解池装置,铜作阴极,阴极H+得到电子生成H2。 答案:B 4.下列几种金属制品的镀层损坏后,金属腐蚀的速率最快的是( ) A.镀铝塑料 B.食品罐头盒(镀锡) C.白铁水桶(镀锌) D.镀银铜质奖章 解析:关键是看镀层损坏后,暴露出的金属与镀层能否形成原电池,形成原电池 时金属是否是负极。A项塑料不会被腐蚀;B项Fe为原电池负极,锡为原电池的 正极,加速了Fe的腐蚀;C项Zn为原电池的负极,铁为原电池的正极,铁被保 护起来;D项Cu为原电池的负极,Ag为原电池的正极,Cu被腐蚀,但Fe比Cu 活泼。 答案:B 5. 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一 段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈 浅红色。则下列说法错误的是( ) A.b电极是阴极 B.a电极与电源的正极相连接 C.电解过程中,水是氧化剂 D.b电极附近溶液的pH变小 解析:根据题意,a电极应产生Cl2,为阳极,与电源正极相连,则b为阴极。D 项中b电极上H+放电,附近OH-浓度增大,pH变大。 答案:D 6.(2010·原创)如图所示,烧杯中装有稀硫酸,A、B、C、D分别为铜、锌、碳棒、 碳棒,下列说法正确的是( ) A.A、D棒上均产生气泡 B.B、C棒上均产生气泡 C.电子流动方向A→D D.左边烧杯中溶液的pH会降低 解析:左边的装置是原电池,A为正极,B为负极;右边为电解池,C为阴极, D为阳极;A棒上有氢气产生,C棒上也有氢气产生,D棒上有氧气产生,左边 烧杯中有H2生成,c(H+)减小,溶液的pH会升高,右边烧杯中水被电解,c(H+) 增大,溶液的pH会降低。 答案:A 7.为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小 相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( ) (1) (2) (3) A.实验结束时,装置(1)左侧的液面一定会下降 B.实验结束时,装置(1)左侧的液面一定比装置(2)的低 C.实验结束时,铁钉b腐蚀最严重 D.实验结束时,铁钉c几乎没有被腐蚀 解析:(1)中发生化学腐蚀:Fe+2HCl===FeCl2+H2↑ (2)中发生析氢腐蚀,Cu为正极,铁钉为负极。 (3)中不被腐蚀,因为浓H2SO4有强吸水性,处于干燥环境的铁钉难以被腐蚀。 答案:B 8. (2010·改编)某学生欲制做一种家用环保型消毒液发生器,下列是他所设计的装置, 你认为比较合理的是( ) 解析:家用环保型消毒液发生器是利用电解饱和食盐水原理,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,Cl2和NaOH反应生成NaClO。 答案:B 9.(2010·模拟精选,广州模拟)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在 其表面。下列说法不正确的是( ) A.锡青铜的熔点比纯铜高 B.在自然环境中,锡青铜中的锡可对铜起保护作用 C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,也是化学反应过程 解析:本题考查合金的性质及电化学腐蚀知识,意在考查考生理论联系实际的能 力。合金的熔点比成分金属的低,A错;金属的电化学腐蚀属于化学反应,D对。 答案:A 10. (2010·试题调研,西安八校联考)常温下,某溶液中含有两种溶质NaCl和H2SO4, 它们的物质的量之比为5∶2,用石墨作电极电解该混合溶液时,根据电解产物, 可分为三个阶段。下列叙述不正确的是( ) A.溶液pH不断增大,最后为7 B.阳极先析出Cl2,后析出O2 C.阴极始终只析出H2 D.电解最后阶段为电解水 解析:由题意知溶质为NaCl和H2SO4且物质的量之比为5∶2,即Cl-∶H+=5∶4。 阳极(阴离子放电):2Cl--2e-===Cl2↑,4OH--4e-===O2↑+2H2O;阴极(阳离 子放电):2H++2e-===H2↑。所以,阴极产物始终为H2;阳极先产生Cl2 ,后析 出O2;电解的最后阶段为电解水;因Cl-∶H+=5∶4,H2SO4电离出的H+反应完 后,再放电的H+来自水的电离,最终pH大于7。 答案:A 二、非选择题 11.如图所示是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片, 插在CuSO4稀溶液中,铜片与引出的导线相连,引出端分别为X、Y。 (1)当以I=0.21 A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则装 置中的X端与直流电源的________极相连,它是电解池的________极。 (2)电解后铜片B的质量________,(填“增加”、“减少”或“不变”)。 (3)列式计算阿伏加德罗常数NA(已知电子电量e=1.60×10-19 C) 解析:因为铜片A的质量增加,A为电解池的阴极,Cu2++2e-===Cu,X端应与 直流电源的负极相连接。铜片B则为电解池的阳极:Cu-2e-===Cu2+,其质量减 少。 答案:(1)负 阴 (2)减少 (3)NA=6.048×1023 mol-1 12.(2010·试题调研,北京质量检测)如图装置中,A、B中电极为多孔的惰性电极;C、 D为夹在湿的Na2SO4滤纸条上的铂夹,a、b为电源两极。在A、B中充满KOH 溶液后使其倒立于盛有KOH溶液的水槽中。切断K1,闭合K2、K3,通直流电, 电解一段时间后A、B中均有气体产生,如图所示。 (1)电源的a极为________(填“正极”或“负极”)。 (2)在湿的Na2SO4滤纸条中心滴KMnO4溶液,现象是 ___________________________________________________________________。 (3)写出A中电极反应式: ____________________________________________________________________。 (4)若电解一段时间后A、B中均有气体包围电极。此时切断K2、K3,闭合K1,电 流表的指针发生偏转,此时B极的电极反应式为 _____________________________________________________________________。 解析:(1)由图示得电解时B中产生气体的体积是A中的2倍,而电解KOH溶液 的本质是电解水,故A中生成的是氧气,A为阳极,B为阴极;a为负极、b为正 极;C作阴极、D作阳极。(2)MnO向阳极移动,故紫色移向D铂夹。(3)A中是 OH-放电。(4)中构成了氢氧燃料电池,KOH溶液作电解质溶液,B作负极,H2 失去电子后与OH-结合生成水。 答案:(1)负极 (2)紫色向D铂夹靠近 (3)4OH--4e-===O2↑+2H2O (4)H2-2e-+2OH-===2H2O 13.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙 中滴入酚酞溶液,在F极附近显红色。试完成以下问题: (1)电源A极的名称是________。 (2)甲装置中电解反应的总化学方程式是 _______________________________________________________________。 (3)如果收集乙装置中产生的气体,两种气体的体积比是________。 (4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要 成分是________(填化学式)。 (5)装置丁中的现象是__________________________________________________, 说明 _________________________________________________________________。 解析:本题考查电解池有关串联电解的知识。综合性较强。由向乙中滴入酚酞溶 液,在F极附近显红色,说明F为阴极,那么E为阳极,所以B为电源的负极, A为电源的正极。甲是电解CuSO4溶液,总方程式:2CuSO4+2H2O2Cu +O2↑+2H2SO4。乙装置中生成的气体为V(Cl2)∶V(H2)=1∶1。丙是电镀池, 所以给铜镀银阳极G应为Ag,阴极H为Cu,电镀液为AgNO3溶液。由于氢氧化铁胶粒带正电,所以有外加电源时,胶粒定向移动,向阴极移动,所以Y极附近红褐色变深。 答案:(1)正极 (2)2CuSO4+2H2O2Cu+O2↑+2H2SO4 (3)1∶1 (4)银 AgNO3 (5)Y极附近红褐色变深 氢氧化铁胶粒带正电荷 14.如图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电 镀槽,接通电路后,发现B上的c点显红色,请填空: (1)电源A上的a为________极。 (2)滤纸B上发生的总化学反应方程式为 ___________________________________________________________________。 (3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生 的反应为 __________________________________________________________________, 电极f上发生的反应为 ___________________________________________________________________, 槽中盛放的电镀液可以是__________或__________(只要求填两种电解质溶液)。 解析:(1)含酚酞试液的滤纸变红,表示电解时有OH-生成,是由于H2O H++OH-,2H++2e-===H2↑,余下OH-之故,所以c是B电解池的阴极,d为 阳极,则可得出:b是A原电池的负极,a为正极,e是C电镀槽的阳极,f为阴 极。 (2) (3)待镀金属铁作阴极f:Zn2++2e-===Zn 镀层金属锌作阳极e:Zn-2e-===Zn2+, 用含镀层金属离子的溶液作电镀液, 可用ZnSO4溶液或ZnCl2溶液。 答案:(1)正 (2)2NaCl+2H2OH2↑+Cl2↑+2NaOH (3)Zn-2e-===Zn2+ Zn2++2e-===Zn ZnSO4溶液 ZnCl2溶液 一、选择题 1. (2010·原创)下列有关金属腐蚀与防护的说法正确的是( ) A.纯银器表面在空气中因化学腐蚀渐渐变暗 B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了外加直流电源的阴极保护法 D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 解析:本题考查了金属的腐蚀与防护。纯银器表面在空气中易形成硫化银而使银 器 表面变黑,所以是化学腐蚀,A正确;铁与锡构成原电池,铁作负极,加快了铁的 腐蚀,B错;海轮外壳中的金属与连接的锌块构成原电池,锌作负极,可以保护海 轮,C错;外加直流电源保护器件时,必须连接电源负极,D错。 答案:A 2. (2010·试题调研,江苏南通3月)下列描述中,不符合生产实际的是( ) A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极 C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极 解析:电解熔融的氧化铝制取金属铝时,应用惰性材料作电极;铜的精炼:阳极(粗 铜):Cu-2e-===Cu2+;阴极:Cu2++2e-===Cu。电解质溶液:CuSO4(含H2SO4); 电解饱和食盐水:阳极(钛网):2Cl--2e-===Cl2↑;阴极(碳钢网):2H++2e-===H2↑, 总反应:2NaCl+2H2O2NaOH+H2↑+Cl2↑;镀锌:阳极(锌):Zn-2e-===Zn2; 阴极(镀件):Zn2++2e-===Zn,电镀液:ZnCl2溶液。 答案:A 3.(2010·模拟精选,湖北宜昌1月)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电解质为导电固体。下列有关LiFePO4电池的说法正确的是( ) A.该电池可用硫酸作电解质溶液 B.放电时,电池内部的Li+向负极移动 C.充电时,阳极的反应为:LiFePO4-e-===FePO4+Li+ D.放电过程中,电池正极材料的质量减少 解析:硫酸作电解质溶液将会与Li反应,A错;放电时,阳离子移向正极,B错; 充电时,阳极发生的是失去电子的氧化反应,C对;放电时,正极上有LiFePO4生成,质量增大。 答案:C 4.下列现象与电化学腐蚀无关的是( ) A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 B.生铁比纯铁容易生锈 C.铁质器件附有铜质配件,在接触处易生锈 D.银制奖牌久置后表面变暗 解析:A项,铜锌合金构成原电池,被腐蚀的是锌而不是铜;B项,生铁中含较多的碳,与铁构成原电池后加快铁的腐蚀;C项,铁铜两器件在接触处易构成原电池加快铁的腐蚀;D项,银制奖牌久置表面变暗是由于生成了Ag2S的缘故,故D项与电化学腐蚀无关。 答案:D 5.一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2===O3+3H2O2。下列有关说法正确的是( ) A.电解池的阳极生成双氧水,阴极生成臭氧 B.电解池中硫酸溶液的pH保持不变 C.产生臭氧的电极反应式为:3H2O-6e-===O3+6H+ D.产生双氧水的电极反应式为2H2O-2e-===H2O2+2H+ 解析:此电解池的阴极反应为:6H++6e-+3O2===3H2O2,阳极反应为:3H2O-6e-===O3+6H+。故电解池的阴极生成双氧水,阳极生成臭氧;由于电解过程中不断消耗水,使硫酸溶液的浓度逐渐增大,溶液的pH逐渐减小。 答案:C 6.如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( ) A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应 C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生 解析:本题考查原电池知识中金属的吸氧腐蚀。铁铜组成原电池铁作负极,铁铝组 成原电池铁作正极,a中铁被氧化,正极铜丝周围氧气得电子发生还原反应,生成 氢氧根离子使酚酞变红,b中铁钉上氧气得电子发生还原反应,生成氢氧根离子使 酞变红,铝条失电子变为铝离子无气泡产生。 答案:B 7. (2010·试题调研,山东威海5月)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( ) A.放电时锌作负极 B.充电时氢氧化铁被氧化 C.放电时溶液的碱性增强 D.放电时转移3 mol e-,有2 mol FeO被还原 解析:由电池反应知,Zn从0价变为+2价的Zn(OH)2,失去电子,作为原电池的负极,A项正确;充电时,Fe(OH)3中的+3价的铁被氧化为K2FeO4中的+6价的铁,B项正确;放电时,生成OH-,对应的溶液碱性增强,C项正确;此反应共转移6 mol e-,对应有2 mol FeO被还原,D项错误。 答案:D 8. (2010·模拟精选,山东潍坊4月)一些科学家采用高质子导电性的SCY陶瓷(能传递 H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学合成氨的有关叙述正确的是( ) A.N2在阴极上被氧化 B.可选用铁作为阳极材料 C.阳极的电极反应式是N2+6e-+6H+―→2NH3 D.该过程的总反应式是N2+3H22NH3 解析:N2在阴极上被还原,A错误。铁是活泼的金属,作阳极材料会被氧化,B错误。阴极的电极反应式是N2+6e-+6H+―→2NH3,C错误。D为正确选项。 答案:D 9. (2010·试题调研,浙江金华十校5月)用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( ) ①2Cu2++2H2O2Cu+4H++O2↑ ②Cu2++2Cl-Cu+Cl2↑ ③2Cl-+2H2O2OH-+H2↑+Cl2↑ ④2H2O2H2↑+O2↑ A.①②③ B.①②④ C.②③④ D.②④ 解析:假设混合溶液中含有1 mol Cu2+、1 mol SO、3 mol Na+、3 mol Cl-、H+、 OH-,又因阴极上Cu2+得电子能力强于H+,阳极上Cl-失电子能力强于OH-,故 Cu2+放电完全时,还剩余1 mol Cl-没放电,当剩余1 mol Cl-放电时,则由来自水电离出的H+同时放电,当剩余1 mol Cl-放电完全后,则是电解水,故选C。 答案:C 10.(2010·试题调研,广东广州3月)用两支惰性电极插入CuSO4溶液中,通电电解, 当有1×10-3 mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( ) A.阳极上析出5.6 mL O2(标准状况) B.阴极上析出16 mg Cu C.阴极上析出11.2 mL H2(标准状况) D.阳极和阴极质量都无变化 解析:用惰性电极电解CuSO4溶液时,电极反应为,阴极:2Cu2++4e-===2Cu,阳 极:4OH--4e-===O2↑+2H2O。当有1×10-3 mol的OH-放电时,生成标准状况 下的O2为5.6 mL,此时转移电子为1.0×10-3 mol,则在阴极上析出32 mg Cu。 答案:A 二、非选择题 11.(2010·试题调研,江苏连云港1月)请从下图中选用必要的装置进行电解饱和食盐水的 实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。 (1)A极发生的电极反应式是________________________________________________________________________, B极发生的电极反应式是________________________________________________________________________。 电解饱和食盐水的化学方程式是________________________________________________________________________。 (2)电源、电流表与A、B两极的正确连接顺序为: L→( )→( )→( )→( )→M。 (3)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接________。 (4)在实验中,盛有KI淀粉溶液的容器中发生的反应的离子方程式为________________________________________________________________________。 (5)已知饱和食盐水50 mL,某时刻测得H2体积为16.8 mL(标准状况)。此时溶液pH约为__________。(lg 2=0.3,lg 3=0.5,lg 5=0.7) 解析:(1)要达到电解食盐水的目的,则电解池中铁棒必须接上电源的负极而成为阴极,碳棒则接上电源的正极而成为阳极,反之,铁作阳极则Fe2+进入溶液,无法实现电解食盐水的目的。 (2)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极。 (3)电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,则有:H←F←G←A B→D→E→C,相应装置的作用: (5)2NaOH ~ H2 2 mol 22.4 L 1.5×10-3 mol 16.8×10-3 L c(OH-)==3×10-2 mol/L c(H+)===×10-12 mol/L pH=-lg=12.5。 答案:(1)2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2NaCl+2H2O2NaOH+H2↑+Cl2↑ (2)A B J K (3)H F G D E C (4)Cl2+2I-===2Cl-+I2 (5)12.5 12.电解原理在化学工业中有广泛的应用。如右图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连。 (1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U型管两边各滴入几滴酚酞试液,试判断 ①a是________极(填“正”或“负”),B是________极(填“阴”或“阳”); ②A电极上的电极反应式为________________________________________________________________________, B电极上的电极反应式为________________________________________________________________________; ③检验A电极产物的方法是________________________________________________________________________。 (2)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则 ①A电极的材料是________,电极反应式为________; ②B电极的材料是________,电极反应式为________。 (3)用惰性电极电解CuSO4溶液。若阴极上析出Cu的质量为3.2 g,则阳极上产生的气体在标准状况下的体积为________;常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为________。 解析:(1)电流从正极流出,流入电解池的阳极,所以a是正极,B是阴极;A电极的反应式为:2Cl--2e-===Cl2↑,B电极反应为:2H++2e-===H2↑;检验Cl2的方法一般用湿润的淀粉碘化钾试纸,Cl2能使试纸变蓝。也可以用湿润的有色布条或纸条,Cl2能使布条或纸条褪色。 (3)电解的总反应方程式为:2Cu2++2H2O2Cu+O2↑+4H+。当阴极上析出3.2 g Cu时,产生的O2在标况下的体积为0.56 L,同时产生的H+为0.1 mol,故pH=1。答案:(1)①正 阴 ②2Cl--2e-===Cl2↑ 2H++2e-===H2↑ ③把湿润的淀粉碘化钾试纸放在A电极附近,试纸变蓝 (2)①粗铜 Cu-2e-===Cu2+ ②纯铜 Cu2++2e-===Cu (3)0.56 L 1 13. (2010·模拟精选,广东韶关2月)在右图中,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,则 (1)电源E为________极,F为________极。 (2)A极的电极反应式为_____________________________________________________, 析出物质________mol。 (3)B极的电极反应式为______________________________________________________, 析出气体________ mL(标准状况)。 (4)C极的电极反应式为_____________________________________________________, 析出物质________mol。 (5)D极的电极反应式为_____________________________________________________, 析出气体________mL(标准状况)。 (6)甲烧杯中滴入石蕊试液,________附近变红,如果继续电解,在甲烧杯中最终得到________溶液。 解析:本题是以电解知识为依托的综合性较强的题目。由于有外接直流电源,所以装置甲、乙均为电解池,两个电解池的关系为串联。电解一段时间后,A极比C极重。故A极上必有Ag析出,由于Ag+在A极上获得电子发生了还原反应,故A极为电解池的阴极,在电解池中阴极与外接直流电源的负极相连,故E极为负极,F为正极。根据电解池甲、乙的串联关系,可进一步得出A、B、C、D依次为阴极、阳极、阴极、阳极。电极反应依次为:A极:Ag++e-===Ag,B极:4OH--4e-===2H2O+O2↑,C极:Cu2++2e-===Cu,D极:2Cl--2e-===Cl2↑,由于串联时各电极上流过的电量是相同的,假设电路中均通过4 mol电子,则A极上生成4 mol Ag,B极上生成1 mol O2,C极上生成2 mol Cu,D极上生成2 mol Cl2,这样便可得出一个关系式:4e-~4Ag~O2~2Cu~2Cl2,A极比C极重4 mol×108 g·mol-1-2 mol×64 g·mol-1=304 g,根据A极比C极重1.9 g,可列出比例式求出反应生成的Ag和Cu的物质的量:n(Ag)=×4 mol=0.025 mol,n (Cu)=0.012 5 mol,n(O2)=0.006 25 mol,n(Cl2)=0.012 5 mol。电解时甲池随着B极附近水电离产生的OH-的不断消耗,H+的物质的量逐渐增大,所以滴入石蕊试液后B极附近变红,而A极上Ag+不断得到电子析出Ag,故在甲烧杯中最终得到HNO3溶液。 答案:(1)负 正 (2)Ag++e-===Ag 0.025 (3)4OH--4e-===2H2O+O2↑ 140 (4)Cu2++2e-===Cu 0.012 5 (5)2Cl--2e-===Cl2↑ 280 (6)B HNO3 阳离子 Na+、K+、Cu2+ 阴离子 SO、OH- 14. (2010·山东青岛模拟)A、B、C三种强电解质,它们在水中电离出的离子如右表所示: 如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题: (1)M为直流电源的________极,b电极上发生的电极反应为______________________。 (2)计算e电极上生成的气体在标准状况下的体积为________________。 (3)写出乙烧杯中的总反应方程式:________________________________________________________________________。 (4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么? ___________________________________________________________ (5)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是________________________________________________________________________。 解析:测得乙中c电极质量增加了16 g,只有Cu2+能放电析出金属,其他的都不可能,而Cu2+只能和SO结合,可以确定B为硫酸铜;由常温下各烧杯中溶液的pH与电解时间t的关系图,可以确定A为KOH或NaOH,C为Na2SO4或K2SO4。c电极上发生的反应为:Cu2++2e-===Cu,即c电极为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。甲中为KOH或NaOH溶液,相当于电解H2O,b电极(阳极)为OH-放电,即4OH--4e-===2H2O+O2↑。当乙中有16 g Cu析出时,转移的电子为0.5 mol。整个电路是串联的,故每个电极上转移的电子数是相等的。丙中为Na2SO4或K2SO4溶液,相当于电解水,由方程式2H2O2H2↑+O2↑可知,当整个反应中转移0.5 mol电子时,e电极上生成的H2为0.25 mol,标准状况下的体积为0.25 mol×22.4 L/mol=5.6 L。此时丙烧杯中消耗水0.25 mol,若要恢复到原来的状态,需要向烧杯中加4.5 g水。 答案:(1)负 4OH--4e-===2H2O+O2↑ (2)5.6 L (3)2CuSO4+2H2O2Cu+O2↑+2H2SO4 (4)能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应 (5)向丙烧杯中加4.5 g水查看更多